吉林白鹅α干扰素在大肠杆菌中的表达及抗病毒活性检测
李公美,李玉梅,胡静涛,刘可越,钱爱东
(1.吉林农业大学动物科技学院,吉林 长春 130118;2.吉林大学畜牧兽医学院,吉林 长春 130062;3.江西九江学院,江西 九江 332000)
干扰素(IFN)是体内一种重要的干扰病毒繁殖的免疫活性细胞因子,由Isaacs等[1]在研究鸡胚绒毛尿囊膜中禽流感病毒时首次发现。Ⅰ型干扰素主要由病毒和微生物诱导产生,Ⅱ型干扰素主要由淋巴细胞受有丝分裂原或特异性抗原刺激产生,IFN-α可抑制感染细胞中病毒mRNA翻译,并促使病毒mRNA降解,能提高细胞表面MHCⅠ类分子的表达水平,有助于向T细胞递呈抗原,引起靶细胞的溶解,并可增强NK细胞对病毒的杀伤能力[2]。
20世纪80年代以来,人的干扰素基因[3]克隆表达成功后应用到了临床,获得了抗病毒的显著效果,随后,狗[4]、猪[5]干扰素基因也相继被克隆,近年来,Digby[6]、Sick和夏春等[7]报道了鸡IFN 序列。Schultz等[8]报道了鸭IFN序列,并开展了其抗病毒的研究。但目前关于鹅IFN的报道较少,养鹅业是我国养殖业中重要的支柱产业,鹅绒、鹅羽都是贵重的出口商品,在国际上非常受欢迎,目前我国在客观上急需大力发展养鹅业。鹅细小病毒、鹅副黏病毒等感染是危害养鹅业最严重的大敌。但目前该类疾病的防治相对落后,而且鸡、鸭等禽类IFN药物已经投入生产使用,因此加强鹅IFN的研究显得尤为重要,本试验参照有关鸭等禽类IFN的报道,无菌取鹅肝脏,利用动物基因组试剂盒提取鹅肝脏中的总DNA,采用PCR技术,成功克隆获得吉林白鹅IFN-α基因,并对其进行表达、纯化,检测其抗病毒活性,为进一步研究吉林白鹅IFN抗病毒作用机制及研制防治鹅病毒性疾病的新型制剂奠定基础。
1 材料与方法
1.1 细胞、质粒与毒株 含吉林白鹅IFN-α基因的重组质粒pMD-T-IFN-α由吉林农业大学重点实验室构建,鸭瘟病毒由吉林农业大学重点实验室保存,E.coli BL21(DE3)、pGEX-6p-1由吉林大学兽医研究所馈赠。
1.2 主要试剂 限制性内切酶Bam HⅠ、Eco RⅠ、Taq DNA聚合酶及T4DNA连接酶等均购自宝生物工程(大连)有限公司;GST融合蛋白纯化试剂盒为Amersham Pharmacia公司产品,低分子质量蛋白质标准、预染蛋白质分子量标准为北京天根有限公司产品;IPTG、DNA分子质量标准、质粒DNA抽提试剂盒、DNA凝胶回收纯化试剂盒为杭州维特洁生物技术有限公司产品;酵母浸出粉、胰蛋白胨为Oxoid公司产品;DMEM培养基、小牛血清购自Invitrogen公司。
1.3 引物设计与目的基因PCR扩增 根据Gen-Bank上已发表的鹅IFN-α序列(登录号:HQ00-9755),用Primer 5.0软件在其完整的阅读框架外设计上、下游引物,引物序列分别为P1:5′-ATAAACATGCCTGGGCCATCAG-3′ P2:划线部分分别为Bam HⅠ和Eco RⅠ 酶切位点,引物由宝生物工程(大连)有限公司合成。
1.4 鹅IFN-α基因的PCR扩增及扩增产物的回收 以重组质粒pMD-T-IFN-α为模板,PCR扩增IFN-α,PCR反应体系:反应体系为:ddH2O 37.5 μL、10×PCR Buffer 5μL、mix dNTPs(10mmol/L)1μL、IFN-αP1(20pmol/L)/IFN-αP2(20pmol/L)各1μL、重组质粒 GoIFN-α(0.5mg/mL)1μL、Ex Taq酶(5μ/μL)0.5μL,补超纯水至50μL,混匀。PCR反应条件为:95℃预变性8min,94℃变性1min,58℃退火1min,72℃延伸1min,30个循环后,72℃延伸10min,0.8%琼脂糖凝胶电泳鉴定反应产物,用凝胶回收纯化试剂盒回收目的片段。
1.5 重组表达载体pMD-IFN-α的构建 用Bam HⅠ和Eco RⅠ双酶切含鹅IFN-α基因T载体,插入到同样经Bam HⅠ和Eco RⅠ双酶切的pGEX-6p-1表达载体的大片段中,构建重组质粒pGEXIFN-α。转化、筛选阳性克隆,提取重组质粒进行PCR和Bam HⅠ、Eco RⅠ酶切鉴定,对初步筛选出的阳性克隆送至宝生物工程(大连)有限公司测序。
1.6 重组质粒pGEX-IFN-α的诱导表达及鉴定将鉴定正确的重组质粒pGEX-IFN-α转化至表达宿主菌BL21中,挑单个菌落接种于5mL含Amp的LB液体培养基中,37℃、200r/min摇床培养。带菌液OD值为0.6~1.0时,加入IPTG至终浓度为1.0mmol/L,30℃诱导培养6h后收集菌体,同时设只含表达载体pGEX-6p-1的BL21和诱导后pGEX-6p-1的BL21对照。将诱导表达菌裂解产物进行SDS-PAGE和Western-blot。
1.7 重组鹅IFN-α的纯化 根据谷胱苷肽琼脂糖-4B(Glutathione Sepharose-4B)操作说明书纯化GST融合蛋白:(1)将谷胱甘肽琼脂糖-4B基质转移至一次性的小柱子。(2)轻扣小柱以除气泡,然后让谷胱甘肽琼脂糖-4B基质着床。(3)移去底盖。(4)加入10倍体积的1×PBS洗涤2次。(5)在基质中每次加入100μL GST Reduction Elution Buffer洗脱GST融合蛋白。(6)收集洗脱液。用SDSPAGE电泳检查纯化蛋白的纯度,用薄层扫描仪进一步扫描分析目的蛋白纯度。蛋白经纯化后,用紫外分光光度计测定样品在波长260nm和280nm处的OD值,按照公式计算样品中蛋白质质量浓度。计算公式为:蛋白质质量浓度(mg/mL)=(1.45×OD280-0.74×OD260)稀释倍数。
1.8 定量PCR检测重组鹅IFN-α抗病毒活性的测定 制备鸭胚成纤维细胞(DEF),待鸭胚成纤维细胞长成单层后分3组:DPV感染细胞阳性对照组、BL21(DE3)/pGEX空载体培养物处理的DPV感染细胞对照组和保护组(加入含2μg/mL重组鸭IFN-α处理18h后感染DPV),DPV强毒的感染量为100PFU。在接毒1h、5h、10h、15h、23h、32h、40h、48h、55h、63h每组分别取2瓶冻存。试验重复4次,每次间隔7d。按文献[9]用定量PCR检测DPV强毒。每日置于倒置显微镜下观察细胞培养板的细胞病变情况,即能看到引起病毒增殖的最高稀释度,依据Reed-Muench法[10],计算其鸭瘟病毒的TCID50,采用微量中和试验测定GoIFN-α的抗病毒效价[11]。
2 结果
2.1 重组质粒pGEX-6p-1的鉴定 对重组质粒pGEX-6p-1进行PCR鉴定,结果在约570bp处得到了1条目的条带;用Bam HⅠ和Eco RⅠ进行双酶切鉴定,分别在约4900bp和约570bp处出现1条带(图1),与预期结果相符。将经PCR和酶切鉴定为阳性的重组质粒测序,测序结果与鹅IFN-α全基因的编码序列完全一致。
2.2 重组鹅IFN-α基因的表达及鉴定 SDSPAGE电泳结果显示,含有重组质粒pGEX-IFN-α的重组菌液出现1条约为43.0ku的融合蛋白(GST-IFN-α)与预期结果相一致;而只含表达载体pGEX-6P-1的BL21,在26.0ku处有1条明显的蛋白带(GST);未含重组质粒和表达载体的宿主菌BL21,没有出现这一条带(图2)。表明重组质粒pGEX-IFN-α在BL21中可诱导表达重组鹅α干扰素融合蛋白。薄层扫描分析结果显示,表达蛋白占菌体总蛋白的18.6%。SDS-PAGE电泳结束后,将凝胶上的蛋白转印至硝酸纤维素(NC)上,用GST单抗作一抗,辣根过氧化物酶标羊抗鼠IgG作二抗进行Western-blot检测。结果(图3)显示,融合蛋白43.0ku出现一条特异条带,同时表达空载体在26.0ku处出现一条带,因此根据分子质量的大小推测,这条带的相对分子质量与目的蛋白的相对分子质量相同,表明诱导表达的目的蛋白是重组的鹅α干扰素。



2.3 重组鹅IFN-α的抗DPV强毒活性 定量PCR检测重组鹅IFN-α不同时间抗DPV强毒的结果(图4)。在感染后15h内,重组鹅IFN-α组与DPV感染细胞对照组和BL21(DE3)/pGEX空载体培养物对照组差异不显著(P>0.05),病毒核酸拷贝数均在105.6~105.2间;从23h开始,鹅IFN-α保护组的核酸拷贝数低于阳性对照组并在感染后47~55h其拷贝数差异达到最大,差异显著(P<0.05)。55h时,与阳性对照组的DPV拷贝数相比,鹅IFN-α保护组能减少病毒108.54个核酸拷贝数,相对抑制率80%;DPV感染细胞对照组和空载体培养物对照组各时间段病毒的增殖趋势和核酸拷贝数基本一致,无统计学差异(P>0.05)。
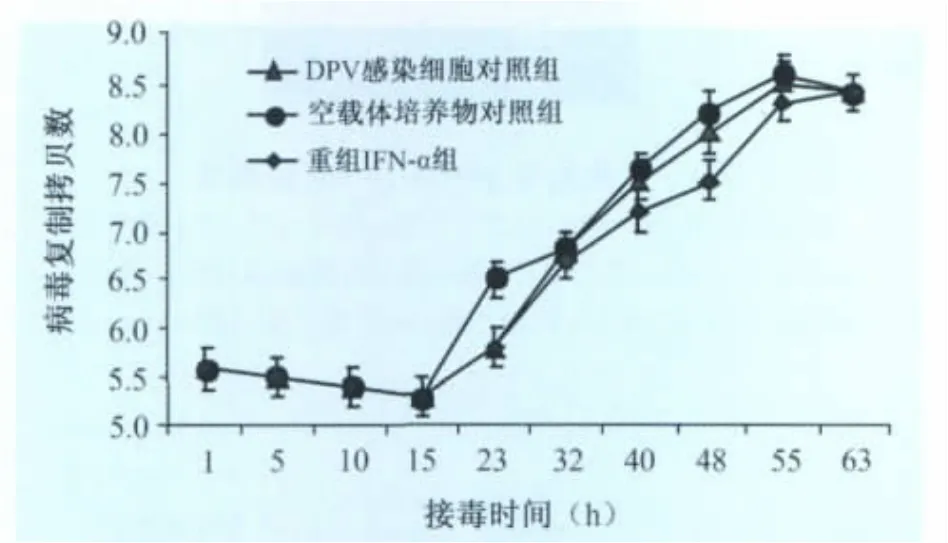
图4 定量PCR检测重组pGEX-IFN-α抗DPV强毒效果
3 分析与讨论
因本试验做克隆与序列分析时经比对鹅IFN-α与鸭IFN-α同源性为97.2%,因此为探讨鹅IFN-α应用于生产的可能性,本试验选用了对我国养鸭业危害最为严重的传染病之一的DPV强毒为重组IFN-α抗病毒活性的研究对象,同时采用具有高度敏感和特异性的FQ-PCR技术来检测重组IFN-α对DPV的动态干扰效果。这样不但可以避免传统方法[12-13]。
受非特异性因素的各种影响(如干扰素本身可以影响多数细胞的分裂等),客观的反映了干扰素对病毒复制的抑制效果。DPV感染DEF的最初15 h,病毒处于静止期,各试验组差异不显著;随后DPV复制开始进入对数期,重组鹅IFN-α抗DPV组的病毒核酸拷贝数低于不加鹅IFN-α的阳性对照组差异显著(P<0.05);阳性组中的DPV在55h附近达到复制高峰,到63h后由于细胞老化会被破坏,病毒量有所减少,而重组鹅IFN-α保护组中病毒增殖期明显较阳性组慢,在63h时仍未达到阳性组在55h的含病毒量。因此重组鹅IFN-α对DPV的复制有明显的抑制效果,能抑制DPV强毒在DEF上形成空斑。由于鹅IFN-α是通过抑制病毒核酸的合成达到抗病毒效果,其抗病毒机理与中和抗体不同,具有光谱性。
干扰素作为一种抑制和干扰病毒繁殖的可溶性细胞因子,可刺激机体淋巴细胞分泌产生多种广谱抗病毒蛋白质,阻断病毒的繁殖,当干扰素系统被激活后,细胞接触干扰素只需几分钟,就产生抗病毒状态,动物可在1~3周时间内对其他病毒的重复感染也有抵抗作用[14],虽然病毒性疾病能诱导机体产生少量干扰素,在体内抑制病毒的增殖,但因表达量低,所以难以保护机体抵抗疾病的侵袭,因此我们希望能通过基因工程方法规模化获得鹅重组干扰素应用到临床。本试验为进一步研究鹅IFN-α在抗病毒、抗肿瘤等方面的作用及鹅IFN生物制剂的研究奠定了基础。
[1]Isaacs A,Lindanmann J.Virus interference I.The interferon[J].Proc Roy Soc London Ser B,1957,147(927):258-273.
[2]焦茂兴,王声会,黄毓茂.猪α-干扰素基因的分子克隆和序列分析[J].广东畜牧兽医科技,2007,32(2):47-49.
[3]Patrick W,Gray,David W,et al.Expression of human immune interferon cDNA in E.Coli and monkey cells[J].Nature,1982,295:503-508.
[4]Himmler A,Hauptmann R,Adolf G R,et al.Structure and expression in Escherichia coli of canine interferon alpha genes[J].J Interferon Res,1987,7:173-174.
[5]Artursson K,Gobl A,Lindersson,et al.Molecular cloning of agene encoding porcine interferon beta[J].J Interferon Res,1992,12(3):153-160.
[6]Dig by M R,Lowent hal J W.Cloning and expression of the chicken interferon gamma gene[J].Interferon Cytoline Res,1995,15(11):939-945.
[7]夏春,汪明,朱凌云,等.惠阳胡须鸡干扰素基因分子克隆与序列分析[J].畜牧兽医学报,2000,31(6):563-566.
[8]Schultz U,Chisari F V.Recombinant duck interferon Gamma inhibits duck hepat itis B virus replication in primary hepatocytes[J].Virol,1999,73(4):3162-3168.
[9]郭宇飞,程安春,汪铭书.鸭病毒性肠炎病毒荧光定量PCR检测方法的建立及应用[J].中国兽医科学,2006,36(6):444-448.
[10]殷震,刘景华.动物病毒学[M].北京:科学出版社,1985:270-275.
[11]XIA C,LIU J,WU Z G,et al.T he interferon-alpha genes from three chicken lines and its effect s on H9N2influenza viruses[J].Animal Biotechol,2004,15(1):77-88.
[12]刘长暖,刘兰,王军志,等.应用结晶紫染色法测定干扰素效价[J].中国生物制品学杂志,1999,12(1):36-37.
[13]Berg K,Hansen M B,Nielsen S E.A new sensitive bioassay for precise quantification of interferon activity as measured via the mitochondrial dehydrogenase function in cells(MTTmethod)[J].APM IS,1990,98(2):156-162.
[14]侯云德.分子病毒学[M].北京:学苑出版社,1990:598-642.

