维生素D3对三硝基苯磺酸诱导的大鼠结肠炎的作用*
谭 蓓 戴张晗 吕 红 王 鸥 杨 红 钱家鸣#
中国医学科学院 北京协和医学院 北京协和医院消化内科1(100730)内分泌科 卫生部内分泌重点实验室2
目前认为炎症性肠病(IBD)是以遗传易感性为基础,环境因素参与,黏膜免疫系统对肠腔内抗原物质(如共生菌)的异常免疫应答而造成的肠道损伤。近年研究发现,除具有调节钙、磷代谢的传统作用外,维生素D(VitD)还具有抗感染和调节免疫的作用[1]。IBD患者普遍存在VitD缺乏,且与病情程度相关[2],目前两者的关系日渐受到关注。本研究采用三硝基苯磺酸(TNBS)诱导大鼠结肠炎模型,通过给予不同剂量VitD3干预,旨在探讨VitD3对大鼠实验性结肠炎的疗效及其作用机制。
材料与方法
一、实验动物、主要试剂
雄性Sprague-Dawley(SD)大鼠66只,4~8周龄,体质量0.20~0.25 kg,购自北京大学医学部实验动物科学部,于北京协和医院动物中心SPF级实验室饲养。
TNBS、活性 VitD31,25(OH)2D3购自 Sigma 公司;5-氨基水杨酸(5-ASA)为德国Dr.Falk Pharma GmbH生产的美沙拉嗪灌肠液;VitD3(商品名:英康利)购自上海信谊金朱药业有限公司。髓过氧化物酶(MPO)试剂盒购自南京建成生物工程研究所。RNAprep pure动物组织总RNA提取试剂盒、Quant cDNA第一链合成试剂盒、2×Taq PCR MasterMix均购自天根生化科技(北京)有限公司。
二、研究方法
1.结肠炎模型的建立和药物干预:将大鼠随机分为11组,每组各6只。根据Morris等[3]的方法,将TNBS 100 mg/kg溶于50%乙醇溶液0.25 mL后灌肠各组大鼠(除外空白对照组),以制备结肠炎模型。造模24 h后开始药物干预,具体方法见表1。造模第10 d处死大鼠,心脏取血和采集结肠组织。
2.结肠炎病情评估:每日观察大鼠体质量变化、大便性状和隐血等情况,行疾病活动指数(DAI)评分[4]。取距肛门3 cm至回盲部的结肠,行大体损伤评分[5]。取距肛门4~5 cm结肠组织,4%甲醛固定,行HE染色,评估组织病理学评分[6]。取距肛门3~4 cm结肠组织,以0.9%NaCl溶液混合后匀浆,按照试剂盒说明书检测MPO活性。
3.RT-PCR 检测T-bet、GATA-3 mRNA 表达:取距肛门5 cm起的结肠组织约20 mg,提取结肠组织总RNA,逆转录酶逆转录为 cDNA,行PCR扩增。各目的基因引物序列[7]见表2,均由北京诺赛基因组研究中心有限公司合成。PCR反应体系25μL,反应条件:94℃预变性3 min;94℃变性30 s,各自退火温度退火30 s,72℃延伸1 min,共45个循环;72℃延伸5 min。扩增产物行1.5%琼脂糖凝胶电泳,Quantity One软件分析各条带平均灰度值,比较目的条带与内参照条带比值,行半定量分析。
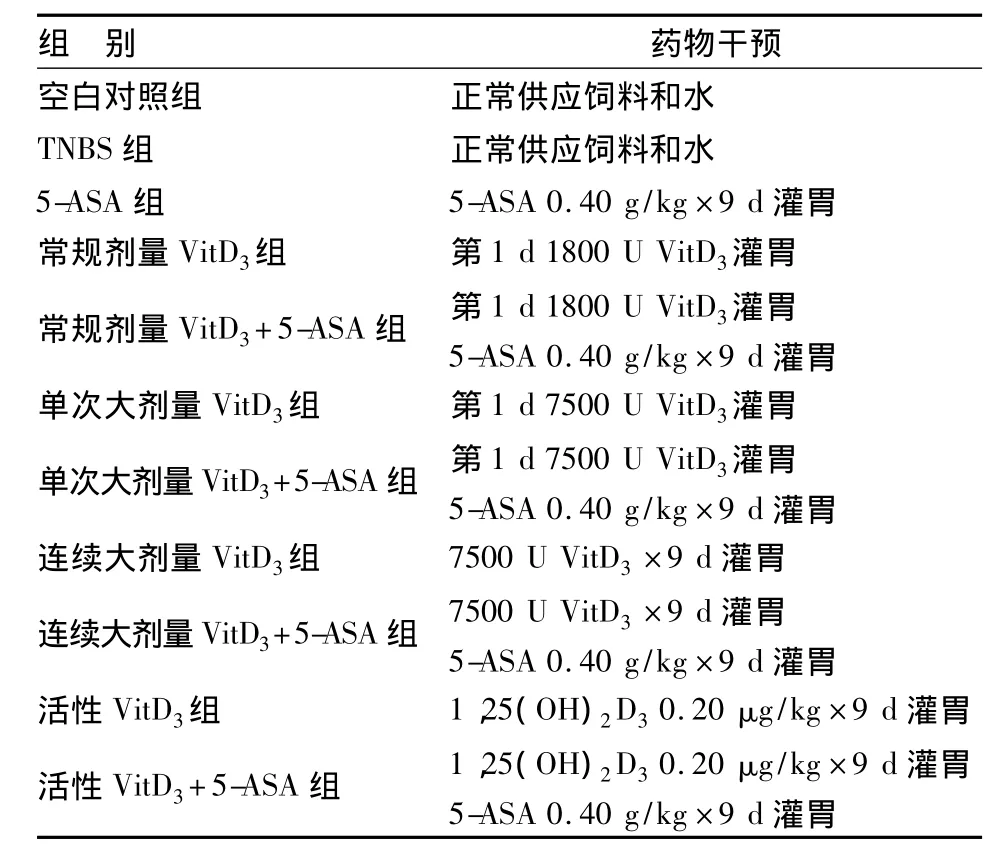
表1 各组大鼠药物干预情况
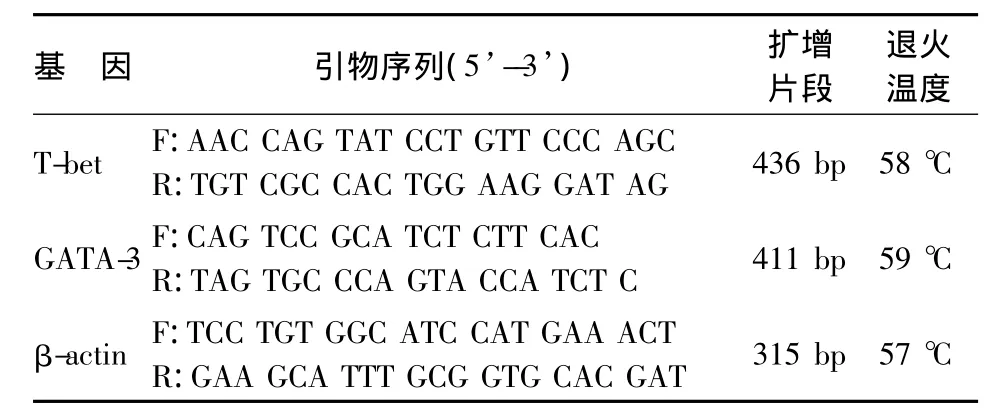
表2 目的基因引物序列、扩增片段和退火温度
4.不良反应监测:心脏取血5 mL,离心分离血清,采用日本Olympus AU-5400全自动生化仪测定钙和肌酐水平。
三、统计学分析
应用SPSS19.0统计软件。计量资料以¯x±s表示,各组间比较采用单因素方差分析,若存在统计学意义,进一步两两比较应用LSD法。P<0.05为差异有统计学意义。
结 果
一、结肠炎模型
造模后大鼠均出现腹泻、血便、体质量减轻等症状;可见肠壁增厚、充血糜烂、活动期溃疡,甚至肠腔狭窄、透壁性溃疡、与周围组织黏连等;结肠上皮层局部黏膜缺失,固有层腺体破坏,黏膜下层大量中性粒细胞、淋巴细胞浸润(见图1)。与空白对照组相比,TNBS组DAI评分、大体损伤评分、组织病理学评分和MPO活性均明显升高(P<0.001)(见表3)。
表3 各组大鼠DAI、大体损伤和组织病理学评分、MPO活性以及T-bet、GATA-3 mRNA表达±s)
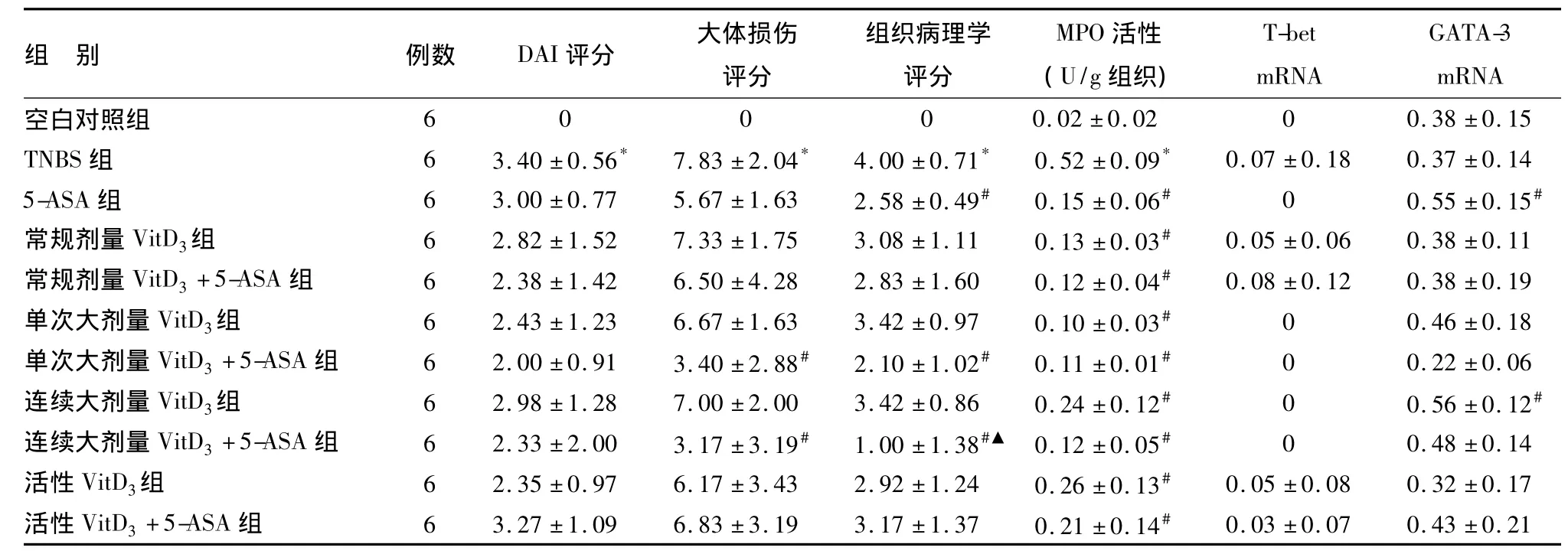
表3 各组大鼠DAI、大体损伤和组织病理学评分、MPO活性以及T-bet、GATA-3 mRNA表达±s)
*与空白对照组比较,P<0.001;#与TNBS组比较,P<0.05;▲与5-ASA组比较,P<0.05
组 别 例数 DAI评分 大体损伤评分GATA-3 0 0.02±0.02 0 0.38±0.15 TNBS组 6 3.40±0.56* 7.83±2.04* 4.00±0.71* 0.52±0.09* 0.07±0.18 0.37±0.14 5-ASA组 6 3.00±0.77 5.67±1.63 2.58±0.49# 0.15±0.06# 0 0.55±0.15#常规剂量VitD3组 6 2.82±1.52 7.33±1.75 3.08±1.11 0.13±0.03# 0.05±0.06 0.38±0.11常规剂量VitD3+5-ASA组 6 2.38±1.42 6.50±4.28 2.83±1.60 0.12±0.04# 0.08±0.12 0.38±0.19单次大剂量VitD3组 6 2.43±1.23 6.67±1.63 3.42±0.97 0.10±0.03# 0 0.46±0.18单次大剂量VitD3+5-ASA组 6 2.00±0.91 3.40±2.88# 2.10±1.02# 0.11±0.01# 0 0.22±0.06连续大剂量VitD3组 6 2.98±1.28 7.00±2.00 3.42±0.86 0.24±0.12# 0 0.56±0.12#连续大剂量VitD3+5-ASA组 6 2.33±2.00 3.17±3.19# 1.00±1.38#▲ 0.12±0.05# 0 0.48±0.14活性VitD3组 6 2.35±0.97 6.17±3.43 2.92±1.24 0.26±0.13# 0.05±0.08 0.32±0.17活性VitD3+5-ASA组 6 3.27±1.09 6.83±3.19 3.17±1.37 0.21±0.14#mRNA空白对照组组织病理学评分MPO活性(U/g组织)T-bet mRNA 6 0 0 0.03±0.07 0.43±0.21
二、药物干预对结肠炎的影响
各药物干预组结肠壁充血、溃疡、狭窄、黏连以及结肠上皮黏膜缺失、细胞浸润等情况均较TNBS组有所减轻(见图1)。与TNBS组相比,各药物干预组DAI评分虽下降,但差异无统计学意义(P>0.05);单次大剂量VitD3+5-ASA组、连续大剂量VitD3+5-ASA组大体损伤评分明显下降(P=0.007和P=0.003);5-ASA组、单次大剂量VitD3+5-ASA组和连续大剂量VitD3+5-ASA组组织病理学评分明显下降(P=0.026、P=0.005和P<0.001);各药物干预组MPO活性均明显下降(P<0.001)。联合5-ASA后,各组DAI、大体损伤评分、组织病理学评分和MPO活性与5-ASA组相比均无明显差异(P>0.05),连续大剂量VitD3+5-ASA组组织病理学评分较5-ASA组明显下降(P=0.013)(见表3)。
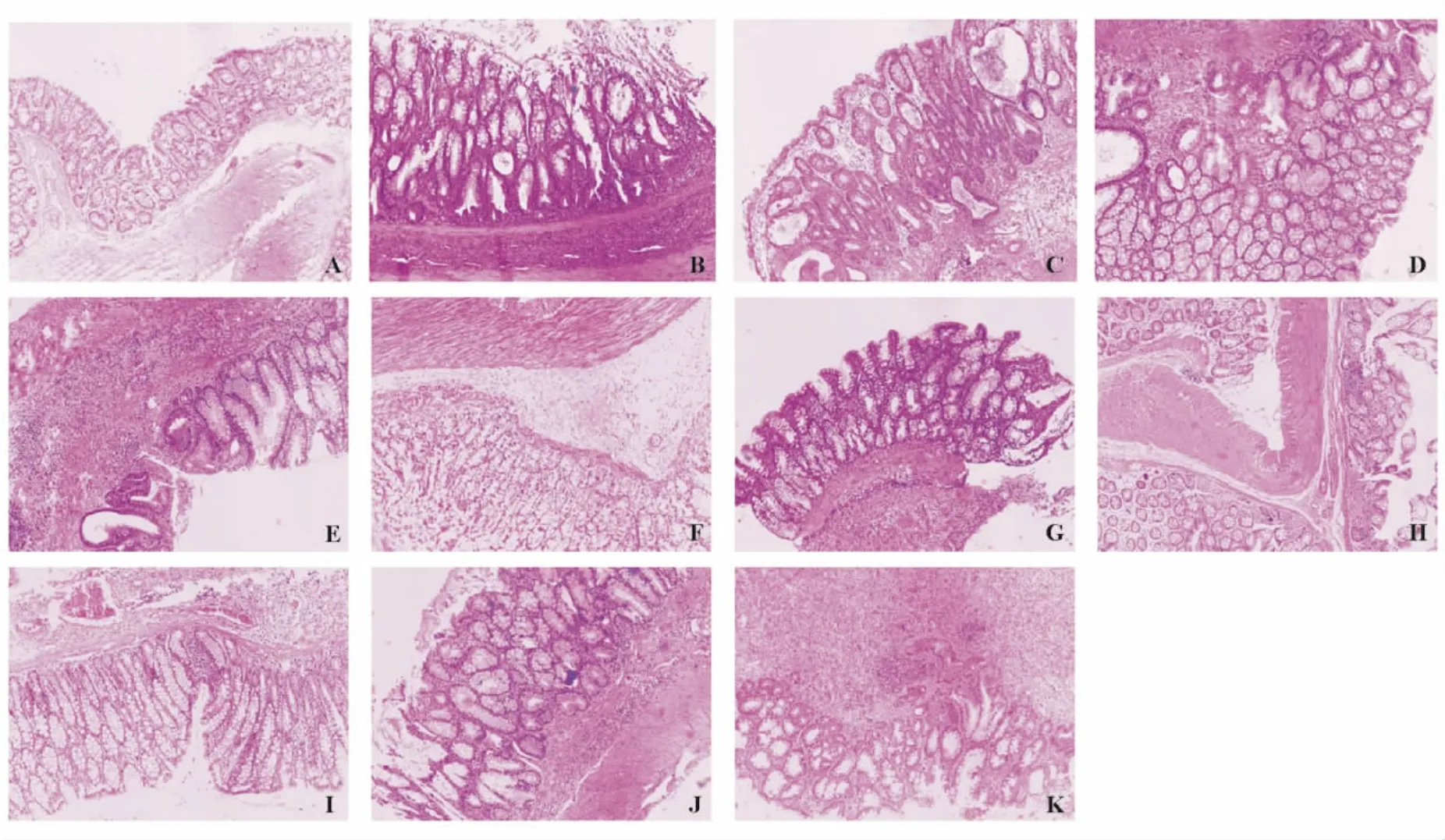
图1 各组大鼠结肠组织病理(HE染色 ×100)
三、T-bet、GATA-3 mRNA 表达
1.T-bet mRNA表达:T-bet在空白对照组无表达,TNBS组表达较弱,两组相比差异无统计学意义(P=0.101)。各药物干预组T-bet mRNA表达与TNBS组相比差异均无统计学意义(P>0.05),其中5-ASA组、单次大剂量VitD3组、单次大剂量VitD3+5-ASA组、连续大剂量VitD3组、连续大剂量VitD3+5-ASA组表达均缺失(见表3、图2)。
2.GATA-3 mRNA表达:与空白对照组相比,TNBS组GATA-3 mRNA表达无明显差异(P=0.838)。与TNBS组相比,5-ASA组(P=0.037)、连续大剂量VitD3组(P=0.035)表达明显升高,其余药物干预组无明显差异(见表3、图2)。

图2 各组大鼠结肠组织T-bet、GATA-3 mRNA表达的电泳图
四、不良反应监测
连续大剂量 VitD3组、连续大剂量 VitD3+5-ASA组大鼠出现高钙血症,血钙水平明显高于其余各组(P<0.05)。所有组别大鼠肌酐水平均在正常范围内[8],但连续大剂量 VitD3组血肌酐水平明显高于其余各组(P<0.05)(见表4)。
表4 各组大鼠血钙和血肌酐水平±s)
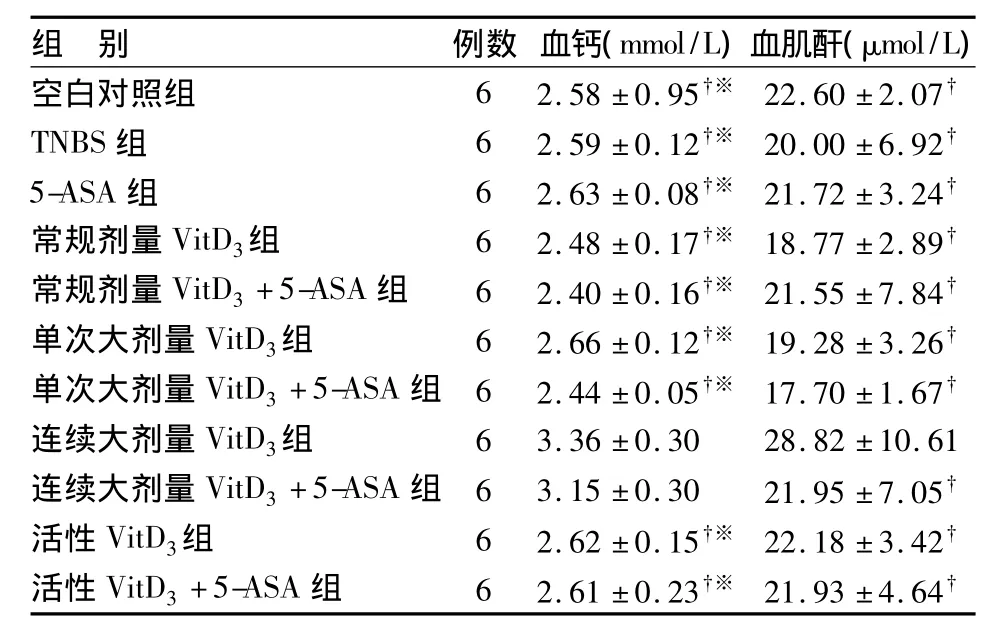
表4 各组大鼠血钙和血肌酐水平±s)
†与连续大剂量VitD3组比较,P<0.05;※与连续大剂量 VitD3+5-ASA组比较,P<0.05
组 别 例数 血钙(mmol/L)血肌酐(μmol/L)空白对照组 6 2.58±0.95†※ 22.60±2.07†TNBS组 6 2.59±0.12†※ 20.00±6.92†5-ASA 组 6 2.63±0.08†※ 21.72±3.24†常规剂量 VitD3组 6 2.48 ±0.17†※ 18.77±2.89†常规剂量VitD3+5-ASA组 6 2.40±0.16†※ 21.55±7.84†单次大剂量VitD3组 6 2.66±0.12†※ 19.28±3.26†单次大剂量VitD3+5-ASA组 6 2.44±0.05†※ 17.70±1.67†连续大剂量VitD3组 6 3.36±0.30 28.82±10.61连续大剂量VitD3+5-ASA组 6 3.15±0.30 21.95±7.05†活性 VitD3组 6 2.62 ±0.15†※ 22.18±3.42†活性VitD3+5-ASA组 6 2.61±0.23†※ 21.93±4.64†
讨 论
1989年Morris等[3]首次提出以TNBS法制备大鼠结肠炎模型,TNBS是一种半抗原物质,在乙醇破坏肠黏膜屏障后,与肠黏膜角蛋白结合成为全抗原,激发局部免疫反应,造成与人类IBD相似的实验性结肠炎。MPO是中性粒细胞嗜天青颗粒中的酶之一,与急性炎症的严重程度呈正相关。本研究以TNBS诱导后大鼠均出现腹泻、血便、体质量下降,结肠壁增厚、充血糜烂和溃疡,并伴有大量中性粒细胞、淋巴细胞浸润,大体损伤评分和组织病理学评分、MPO活性均明显升高,表明TNBS成功诱导了实验性结肠炎。
目前VitD3的推荐剂量主要针对普通人群预防和治疗骨质疏松,尚缺乏VitD3对IBD患者起免疫调节作用所需剂量的相关数据。因此,本研究采用常规剂量、单次大剂量和连续大剂量VitD3三种不同剂量梯度以观察大鼠炎症改善情况。结果显示不同剂量VitD3干预组MPO活性均较TNBS组明显下降,表明VitD3可减轻肠道中性粒细胞浸润的急性炎症。其中单次或连续大剂量VitD3联合5-ASA的疗效较常规剂量VitD3更为突出,表现为大体损伤和组织病理学评分较TNBS组明显减轻,而常规剂量VitD3组与TNBS无明显差异。然而随着VitD3剂量增加,不良反应亦增多,连续大剂量VitD3导致血钙和血肌酐水平均明显升高。目前有研究[9,10]应用VitD3类似物治疗IBD,均取得良好的疗效,为将来增加VitD3治疗剂量提供了一定依据。
传统上将CD4+T细胞分为Th1和Th2细胞,其分化受转录因子影响。T-bet是Th1型免疫的关键调节因子[11],GATA-3是一种锌指蛋白,为Th2的关键调节因子[12]。Th1/Th2细胞比例失衡在IBD发病中起重要作用。TNBS诱导的实验性结肠炎以Th1为主,类似于人类克罗恩病(CD),抑制T-bet表达而上调GATA-3表达可影响T细胞从Th1细胞向Th2细胞的分化。有研究发现VitD3具有免疫调节作用,Daniel等[13]发现活性 VitD3和活性 VitD3+地塞米松组中GATA-3表达分别是TNBS实验性结肠炎小鼠的2倍和5倍,且活性VitD3联合地塞米松较单用地塞米松可明显下调T-bet。本研究中,空白对照组不表达T-bet,TNBS组弱表达,符合TNBS诱导的实验性结肠炎以Th1为主,单次或连续大剂量VitD3联合5-ASA均可使 T-bet表达缺失,同时5-ASA、连续大剂量VitD3可上调 GATA-3表达,因此考虑VitD3可能通过Th1/Th2平衡调节T细胞免疫。
本研究中,活性VitD3组补充的1,25(OH)2D3仅为常规剂量,其对大鼠大体、组织学和T细胞免疫均未表现出明显的治疗作用。因而,考虑VitD3所表现出的减轻炎症作用与剂量而非剂型相关,活性VitD3价格相对昂贵,临床上可选择普通VitD3并适当增加补充剂量。
本研究中,应用5-ASA虽在T细胞免疫和组织学评估中表现出一定治疗效果,但并未能使大体损伤较TNBS组明显减轻,与临床上5-ASA治疗CD的效果相一致。而5-ASA联合大剂量VitD3后,大鼠结肠炎组织病理学进一步减轻,提示在IBD临床治疗中辅以中-高剂量VitD3或许能提高传统药物的治疗效果,起较好的协同作用。
此外,本研究中TNBS组大体损伤和组织病理学评分均明显高于空白对照组,但T-bet和GATA-3 mRNA表达与空白对照组无明显差异,原因可能为大鼠于造模后第10 d处死时,其实验性结肠炎已趋于慢性化且存在自愈趋势,故炎性因子水平已有所下降,但组织学修复需一定过程,故迟于炎性因子变化。
综上所述,VitD3可减轻TNBS诱导的实验性结肠炎急性炎症,单次和连续大剂量VitD3联合5-ASA可进一步明显减轻大体损伤和组织病理学炎症,单次或连续大剂量VitD3及其联合5-ASA可下调T-bet表达,5-ASA和连续大剂量 VitD3上调 GATA-3表达,但VitD3剂量过大会引发高钙血症和肌酐升高。说明VitD3可通过调节T细胞免疫减轻TNBS诱导的实验性结肠炎,但具体机制仍有待进一步研究证实,并控制不良反应的发生。
1 Raftery T,O’Morain C,O’Sullivan M.Vitamin D:New roles and therapeutic potential in inflammatory bowel disease[J].Curr Drug Metab,2012 [Epub ahead of print].
2 Leslie WD,Miller N,Rogala L,et al.Vitamin D status and bone density in recently diagnosed inflammatory bowel disease:the Manitoba IBD Cohort Study[J].Am J Gastroenterol,2008,103(6):1451-1459.
3 Morris GP,Beck PL,Herridge MS,et al.Hapten-induced model of chronic inflammation and ulceration in the rat colon[J].Gastroenterology,1989,96(3):795-803.
4 Murano M,Maemura K,Hirata I,et al.Therapeutic effect of intracolonically administered nuclear factor kappa B(p65)antisense oligonucleotide on mouse dextran sulphate sodium(DSS)-induced colitis[J].Clin Exp Immunol,2000,120(1):51-58.
5 Wallace JL,Keenan CM.An orally active inhibitor of leukotriene synthesis accelerates healing in a rat model of colitis[J].Am J Physiol,1990,258(4 Pt 1):G527-G534.
6 Sykes AP,Bhogal R,Brampton C,et al.The effect of an inhibitor of matrix metalloproteinases on colonic inflammation in a trinitrobenzenesulphonic acid rat model of inflammatory bowel disease[J].Aliment Pharmacol Ther,1999,13(11):1535-1542.
7 陈冬,李玉晓,李添应,等.大蒜新素对变应性鼻炎大鼠转录因子T-bet和GATA-3表达的影响[J].中华耳鼻咽喉头颈外科杂志,2010,45(2):133-138.
8 林健,郑丽红,陈润,等.SD大鼠血液生化指标正常参考值范围的探讨[J].医学动物防制,2005,21(5):321-322.
9 Daniel C,Radeke HH,Sartory NA,et al.The new low calcemic vitamin D analog 22-ene-25-oxa-vitamin D prominently ameliorates T helper cell type 1-mediated colitis in mice[J].J Pharmacol Exp Ther,2006,319(2):622-631.
10 Stio M,Martinesi M,Bruni S,et al.Interaction among vitamin D(3)analogue KH 1060,TNF-alpha,and vitamin D receptor protein in peripheral blood mononuclear cells of inflammatory bowel disease patients[J].Int Immunopharmacol,2006,6(7):1083-1092.
11 Peng SL.The T-box transcription factor T-bet in immunity and autoimmunity[J].Cell Mol Immunol,2006,3(2):87-95.
12 Ray A,Cohn L.Th2 cells and GATA-3 in asthma:new insights into the regulation of airway inflammation[J].J Clin Invest,1999,104(8):985-993.
13 Daniel C,Sartory NA,Zahn N,et al.Immune modulatory treatment of trinitrobenzene sulfonic acid colitis with calcitriol is associated with a change of a T helper(Th)1/Th17 to a Th2 and regulatory T cell profile[J].J Pharmacol Exp Ther,2008,324(1):23-33.

