天冬总皂苷对D-半乳糖致衰老大鼠肾脏p53基因表达的影响
李艳菊 李琴山 田 硕 刘 洋 (贵阳医学院附属医院血液科,贵州 贵阳 550004)
随着我国老年人群的比重逐年增加,老年人群慢性肾功能减退的比率明显升高。这不仅能够导致终末期肾脏疾病,而且能够增加老年人心血管病的发病概率,肾脏衰老正逐渐成为影响我们国民健康和社会发展的主要疾病。中药天冬(Riadix asparag)为百合科植物天门冬〔Asparagus cochinchinensis(Lour.)Merr.〕的干燥块根〔1〕。其主要成分为天冬总皂苷〔2〕,研究证明天冬具有抗衰老、抗肿瘤等多种生物活性〔3~6〕,但对于天冬总皂苷治疗肾脏衰老的作用及其机制未见报道,本实验通过皮下注射D-半乳糖建立大鼠衰老模型,研究天冬总皂苷治疗衰老大鼠肾脏的效应及其作用机制。
1 材料与方法
1.1 动物 选用清洁级雄性SD大鼠(购自第三军医医科大学动物实验中心,动物编号:2007-0005),8~9周龄,体重160~180 g。
1.2 材料 天冬总皂苷购于上海尚谊化工科技有限公司(纯度为98%);D-半乳糖 (Sigma产品);Trizol试剂、RT-PCR试剂盒(大连宝生物公司);引物序列由primer 3设计,上海英俊公司合成;倒置相差荧光显微镜(德国Lica公司);全自动生化分析仪(德国Lica公司)。
1.3 衰老模型的制备及给药 实验分5组,每组随机分配10只雄性大鼠,比较各组大鼠间的体重差异,无统计学意义;①正常组:每日皮下注射生理盐水0.5 ml,连续注射3个月;②模型组:每日皮下注射 D-半乳糖 400 mg/kg,连续注射 3 个月〔7,8〕;③天冬总皂苷低剂量组(Asp1):每日皮下注射D-半乳糖建立大鼠衰老模型的同时,将3 g/kg天冬总皂苷灌胃治疗3个月;④天冬总皂苷中剂量组(Asp2):每日皮下注射D-半乳糖建立大鼠衰老模型的同时,将6 g/kg天冬总皂苷灌胃治疗3个月;⑤天冬总皂苷高剂量组(Asp3):每日皮下注射D-半乳糖建立大鼠衰老模型的同时,将12 g/kg天冬总皂苷灌胃3个月。
1.4 血清中肌酐(Cr)及尿素(UREA)的检测 治疗结束后,腹腔注射氯胺酮对大鼠进行麻醉,心脏取血,3 000 r/min离心15 min提取大鼠血清,应用全自动分析仪检测血清中Cr及UREA的含量变化。
1.5 肾脏组织光镜定量分析 取一侧肾组织块放入10%Formalin固定,常规石蜡包埋,切片5 μm厚,HE染色,于显微镜下观察并计算各组肾小球硬化程度改变。
1.6 超氧化物歧化酶(SOD)和丙二醛(MDA)表达的测定
治疗结束后对大鼠进行麻醉,心脏取血,3 000 r/min离心15 min提取大鼠血清,按照试剂盒说明书测定各组血清中和各个组织中SOD和MDA的水平。
1.7 实时PCR测定肾脏组织p53 mRNA表达 大鼠肾脏总RNA采用Trizol法提取,采用实时定量-逆转录聚合酶链反应进行基因片段扩增并定量。PCR反应各管所加模板RNA的量约为1 μg。最终通过Real-time PCR仪记录的Ct值而对起始模板相对定量。
2 结果
2.1 尿素、肌酐的检测 正常组与模型组,模型组与治疗组,组间比较差异显著(P<0.05),而且随着天冬总皂苷剂量的增加,其降低UREA及Cr作用增强。见表1。
表1 天冬总皂苷对血清中Cr和UREA水平的影响(±s,n=10)

表1 天冬总皂苷对血清中Cr和UREA水平的影响(±s,n=10)
与正常组比较:1)P<0.05;与模型组比较:2)P<0.05;3)P<0.01,下表同
组别 UREA(mmol/ml) Cr(μmol/ml)正常组3.12±0.28 82.15±6.18模型组 7.14±0.651) 112.51±8.161)ASP1 6.09±0.422) 105.95±10.592)ASP2 4.78±0.363) 95.45±6.482)ASP3 4.02±0.213) 88.75±6.853)
2.2 肾脏组织的光镜分析结果 100倍光镜下,正常组无硬化肾小球存在,而模型组硬化的肾小球显著增加,治疗组随用药浓度的增加,其硬化率有降低趋势。见表2。
2.3 SOD和MDA表达的测定 治疗组大鼠血清中和肾脏组织中SOD活性明显高于模型组,MDA含量明显低于模型组,并呈剂量依赖性(P<0.05)。表3,表4。
2.4 Real-time PCR测定肾脏组织p53 mRNA表达 模型组p53 mRNA的表达高于正常组〔(203.66±11.63)vs(72.38±5.17),P <0.05〕,ASP1、ASP2、ASP3 组随着药物浓度的提高,p53 mRNA表达降低,有剂量依赖性〔(160.27±10.48)、(144.48±11.54)、(96.35±6.78),P <0.05〕。
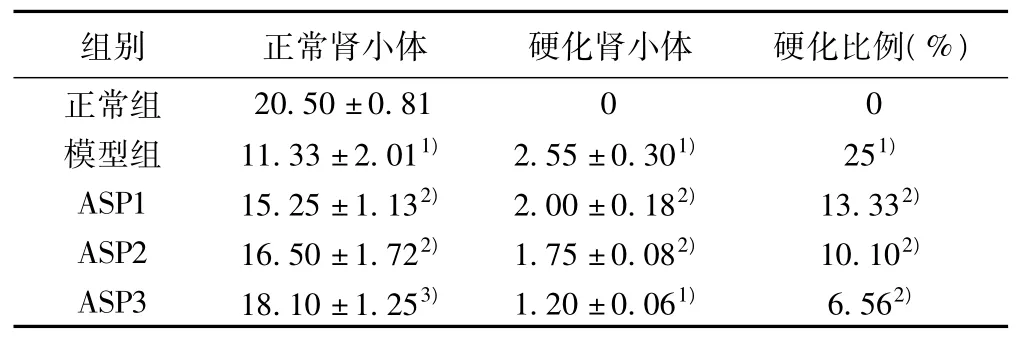
表2 光镜下肾小体及硬化肾小体计数(x ±s,个/视野,n=10)
表3 天冬总皂苷对大鼠血清中SOD活性和MDA含量的影响(±s,n=10)
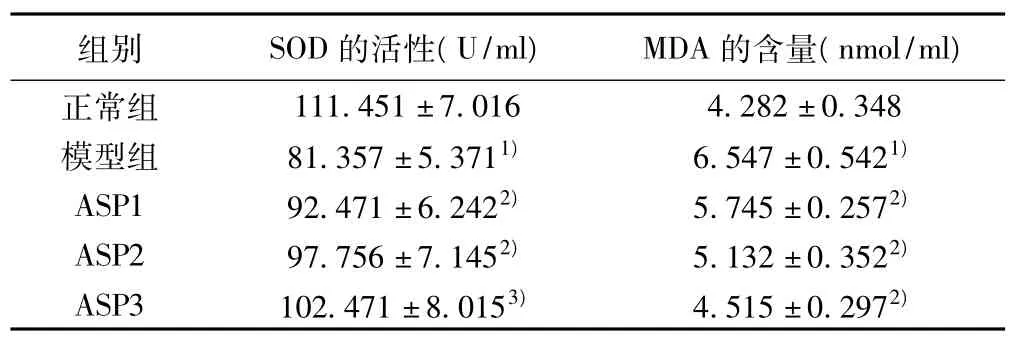
表3 天冬总皂苷对大鼠血清中SOD活性和MDA含量的影响(±s,n=10)
与正常组比较:1)P<0.05;与模型组比较:2)P<0.05;与模型组比较:3)P<0.01
?
表4 天冬总皂苷对大鼠肾脏中SOD活性和MDA含量的影响(±s,n=10)
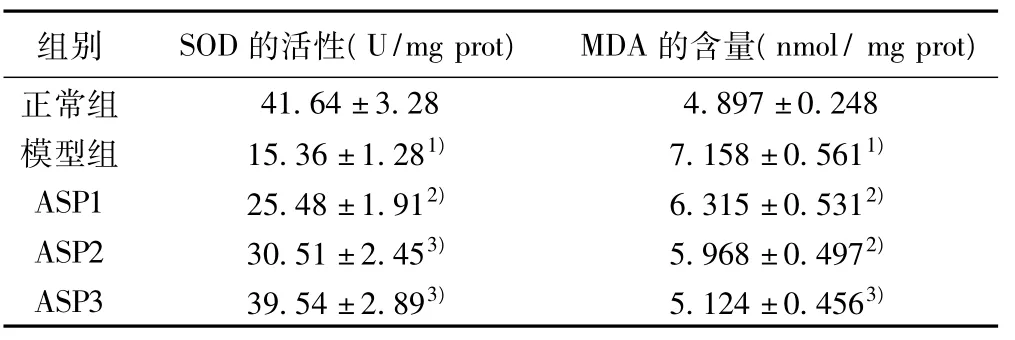
表4 天冬总皂苷对大鼠肾脏中SOD活性和MDA含量的影响(±s,n=10)
?
3 讨论
肾脏是功能减退最快的重要器官之一,也是受衰老影响最明显的器官之一。D-半乳糖引起的代谢紊乱使机体过氧化反应增强是其致肾脏衰老反应的重要因素〔6〕。D-半乳糖在体内氧化产生的大量自由基超过机体的清除能力,引发脂质过氧化的链式反应,产生大量的脂质过氧化物MDA,加重对细胞的损伤,并伴随着抗氧化酶SOD的减少,所以本实验采取D-半乳糖致肾脏衰老模型〔7,8〕,并发现,与模型组相比,天冬总皂苷治疗组能够提高血清与肾脏中SOD的活性、降低MDA含量,具有剂量依赖性,说明天冬总皂苷可能通过氧自由基途径具有治疗肾脏衰老的作用。
肾脏的形态学老化改变表现为肾小球硬化性改变,会出现肾小球系膜细胞增生,系膜容积相对增大,肾小球入球血管硬化,毛细血管丛较少,基膜增厚,这些改变导致肾小球滤过面积减少,本实验发现天冬总皂苷治疗组能够降低肾小球硬化率,而且有剂量依赖趋势。
Cr是小分子物质,可通过肾小球滤过,在肾小管内很少吸收,每日体内产生的Cr,几乎全部随尿排出,一般不受尿量影响。肾功能不全时,Cr在体内蓄积成为对人体有害的毒素。血Cr测定是诊断肾脏衰竭的重要指标,与肾功能的损伤程度呈正相关。UREA为人体蛋白质代谢的终末产物,主要由肾脏排泄,UREA含量的高低取决于机体的蛋白质的分解代谢与肾脏的排泄功能。在一般活动和比较稳定的情况下,血尿素和肾小球滤过功能成反比关系,UREA增高多提示肾小球滤过功能减退。本实验说明模型组大鼠存在肾功能的减退,治疗组能够改善衰老大鼠的肾功能,并且治疗组降低Cr及UREA的作用具有剂量依赖趋势。
衰老与细胞凋亡密切相关,目前认为衰老是一种与基因相关的疾病,在衰老细胞中起重要作用的是p53抑癌基因。p53基因是重要的细胞周期、凋亡调节基因,活化的p53可以影响许多基因的表达,因此p53基因被认为是影响人类寿命的一个关键基因〔9~12〕。本实验发现与模型组相比,天冬总皂苷治疗组能够降低肾脏组织p53基因表达,因此推测天冬总皂苷降低p53基因的表达可能是其改善衰老大鼠肾脏的机制之一,进而本实验为天冬总皂苷的临床应用提供实验依据。
1 中华人民共和国国家药典委员会.中华人民共和国药典〔S〕.北京:化学工业出版社,2005:37.
2 Nishritha B,Sanjay S.Asparagus racemosus-Ethnopharmacological evaluation and conservation needs〔J〕.J Ethnopharmacol,2007;110(1):1-15.
3 Cornwell T,Cohick W,Raskin I.Review:dietary phytoestrogens and health〔J〕.Phytochemistry,2004;65(8):995-1016.
4 Parihar MS,Hemnani T.Experimental excitotoxicity provokes oxidetive damage in mice brain and attenuation by extract of Asparagus racemosus〔J〕.J Neural Transm,2004;111(1):1-12.
5 Bhattacharya A,Murugandam AV,Kumar V,et al.Effect of polyherbal formulation,EuMil,on neurochemical perturbations induced by chronic stress〔J〕.Indian J Exp Biol,2002;40(10):1161-3.
6 Dahanukar SA,Kulkarni RA,Rege NN,et al.Pharmacology of medicinal plants and natural products〔J〕.Indian J Chem,2003;32(3):81.
7 李艳菊,胡亮杉,郭坤元.骨髓间充质干细胞回输对大鼠肾脏衰老的影响〔J〕.中华肾脏病杂志,2009;25(3):241-2.
8 李艳菊,邓 兰,黄 睿.骨髓间充质干细胞对大鼠肾脏衰老的影响〔J〕.中华内科杂志,2009;48(6):458-61.
9 Ander Matheu,Antonio Maraver,Manuel Serrano.The Arf/p53 pathway in cancer and aging〔J〕.Cancer Res,2008;68(15):6031-4.
10 Lawrence A,Donehower A.Using mice to examine p53 functions in cancer,aging,and longevity〔J〕.Cold Spring Harb Perspect Biol,2009;1(6):a001081.
11 Zhaohui Feng,Meihua Lin,Rui Wu.The Regulation of aging and longevity:a new and complex role of p53〔J〕.Genes Cancer,2011;2(4):443-52.
12 Zhaohui Feng,Wenwei Hu,Angelika K,et al.Declining p53 function in the aging process:a possible mechanism for the increased tumor incidence in older populations〔J〕.Proc Natl Acad Sci U S A,2007;104(42):16633-8.

