烟草NtRAX基因的克隆和序列分析
高晓明,张泽坤,王卫锋,刘贯山,李凤霞,崔萌萌,孙玉合*
(1.农业部烟草生物学与加工重点实验室,中国农业科学院烟草研究所,青岛 266101;2.青岛农业大学,青岛 266109)
烟株上腋芽的存在,会消耗大量养分,严重影响烟叶的产量和品质[1]。烟草中,已经获得与腋芽分生组织形成相关基因NtLS,该基因与拟南芥中控制腋芽分生组织形成的LAS基因高度相似[2],对该基因进行 RNA干扰研究,所获得的转基因烟草植株,在腋芽的发生方面与野生型相比没有明显的区别[3]。LAS和RAX是两条相对独立的调控途径,但是在功能上可能存在互补[4-5]。拟南芥中,现已发现RAX1、RAX2、RAX3基因,同属于MYB基因家族。MYB基因家族是植物最大的转录因子家族之一,现有研究表明,植物MYB转录因子在植物器官形成、植物叶片的形态建成及抗病中起重要作用[6],其途径之一包括调节腋芽分生组织的形成[7]。拟南芥中,RAX基因控制腋芽分生组织形成的非常早期的一步。RAX突变株沿茎轴侧芽形成有缺陷。RAX基因在功能上的冗余,对拟南芥次生轴的形成产生微调。其中,RAX1、RAX3基因在腋芽中心组织表达量较高[8]。
本研究通过在GenBank中寻找拟南芥RAX基因相关序列,通过同源比对,采用RACE技术,克隆获得普通烟草中与RAX基因高度相似的基因,目的是为研究该基因的功能奠定基础,进而为通过分子手段解决烟草腋芽问题奠定基础。
1 材料与方法
1.1 材料
供试烟草品种为K326。2010年冬,在温室内播种,自然光照条件下生长至营养生长期。
1.2 方法
1.2.1 总RNA的提取和检测 取烟草K326幼嫩叶片为材料,Trizol法提取幼嫩叶片的总RNA。1×TBE缓冲液,1%琼脂糖凝胶,电泳检测总RNA。
1.2.2 反转录获得cDNA 以总RNA为模板,按照PrimeScriptTM RT-PCR Kit的说明书进行。
1.2.3NtRAX中间片段的获得 以 NCBI的拟南芥AtRAX2基因的序列(NM_129245.2)为信息探针,在烟草EST数据库中进行Blastp检索,获得若干与之同源性较高的蛋白质序列。选取与e值最低的蛋白质序列对应的核酸序列(471 bp)为参照,设计引物,RAX-1:GAAGACAGAGTCATTTGTAGCC;RAX-2:ATTTGGAGTAGAGGGGAAG,以cDNA模板,进行PCR扩增,对400 bp附近的条带回收并测序。
1.2.4NtRAX末端 cDNA第一链的合成 3′RACE和5′末端第一链cDNA的合成,分别以提取的RNA为模板,按照Invitrogen的Generacer试剂盒说明书进行。
1.2.5 3′末端片段的扩增 用已经获得并测序验证的404 bp大小的中间片段为模板链,设计2条末端扩增引物:
3race-GSP1:CCAGTTACCAGGCAGGACAGACAATG;
3race-GSP2:TGAAGGCGGAGGAAAGCCAATGAATG;
按照Generacer试剂盒说明书配制PCR扩增体系。反应程序如下:94 ℃,5 min;94 ℃,30 s,66 ℃,30 s,72 ℃,2 min,5个循环;94 ℃,30 s,65 ℃,30 s,72 ℃,2 min,5个循环;94 ℃,30 s,64 ℃,30 s,72 ℃,2 min,5个循环;94 ℃,30 s,62 ℃,30 s,72 ℃,2min,5 个循环;72 ℃,10 min,4 ℃,HOLD。
1.2.6 5′末端片段的扩增 用已经获得并测序验证的404 bp大小的中间片段为模板链,设计2条末端扩增引物:
5race-GSP1:TCATTGTCTGTCCTGCCTGGTAACTGG;
5race-GSP2:CCATTTCCATTCATTGGCTTTCCTCCG;
按照Generacer试剂盒说明书配制PCR扩增体系。反应程序如下:94 ℃,5 min;94 ℃,30 s,68 ℃,30 s,72 ℃,2 min,5 个循环;94 ℃,30 s,66 ℃,30 s,72 ℃,2 min,5 个循环;94 ℃,30 s,64 ℃,30 s,72 ℃,2 min,5 个循环;94 ℃,30 s,62 ℃,30 s,72 ℃,2 min,5 个循环;72 ℃,10 min,4℃,HOLD。
1.2.7 PCR产物的回收、连接及测序 1%琼脂糖凝胶电泳,紫外灯下切胶,按照康为世纪琼脂糖凝胶产物回收试剂盒说明书进行凝胶回收。将回收产物与pMD18-T载体连接,转化TOP10E.coil感受态细胞,进行蓝白斑筛选,挑取白斑进行菌落PCR鉴定后,选择阳性克隆摇菌并测序。
1.3 序列分析
采用 ContingExpress软件进行序列的拼接组装;NCBI的ORF finder预测开放阅读框;用NCBI的BLASTn序列比对工具进行同源性比对;蛋白质的等电点和分子量计算,采用 ExPASy网站的Compute PI/Mw tool;Pfam在线(http://pfam.sanger.ac.uk/)进行序列保守功能区的分析;采用 Clustalx软件进行多序列比对;以序列比对的结果为基础,利用MEGA5.0软件构建系统进化树。
2 结 果
2.1 NtRAX中间片段的获得
以cDNA为模板,RAX-1和RAX-2为引物,扩增获得一条 400 bp附近片段。经测序验证,共404 bp。
2.2 NtRAX全长基因的获得
通过3′末端扩增,获得了723 bp的3′末端,该末端有24个碱基的PolyA尾巴,表明获得了完整的3′端编码序列。通过5′末端扩增,获得了407 bp的5′末端,在起始密码子ATG 42 bp前有一个终止密码子TAG,表明获得了完整的5′端编码序列。
2.3 NtRAX基因的序列分析
使用contingExpress软件对382 bp的5′RACE序列、418 bp的3′RACE序列和404 bp的中间序列进行拼接,获得长度为1112 bp的全长基因cDNA序列。该序列全长 1112 bp,含有 429个腺嘌呤(38.6%)、179个胞嘧啶(16.1%)、293个鸟嘌呤(19.0%)、293个胸腺嘧啶(26.3%)。
对该序列进行ORF分析,得出该序列5′端非编码区长度为96 bp,编码区长度为954 bp,3′端非编码区长度为62 bp,其中编码区编码317个氨基酸(图1)。将该基因命名为NtRAX(NCBI登录号为JQ228591)。

图1 NtRAX的cDNA和蛋白质全长序列Fig.1 Full-length sequences of NtRAX cDNA and protein
将获得的NtRAX基因的 cDNA序列在 NCBI上进行 BLAST分析,发现该序列与已有的番茄cDNA文库中的单个克隆(LEFL1032AE06)部分序列相似性为74%,E值为0.0;与拟南芥RAX2基因的序列(NM_129245)相似性为 80%,E值为9e-86。
用ExPASy网站的Compute PI/Mw tool分析得到NtRAX基因所编码的蛋白质的等电点为7.02,分子量为35.42 KDa。在线进行保守区域分析,结果表明,该蛋白在N端分别含有由52个和49个氨基酸组成的两个MYB结构域,并且每个结构域含有典型的MYB转录因子所特有的保守的色氨酸残基W(图2),说明所克隆的NtRAX基因是MYB基因家族成员。
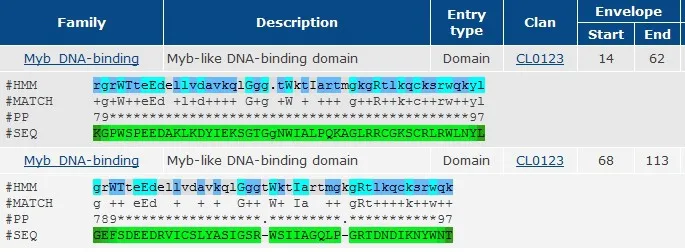
图2 NtRAX的保守结构域Fig.2 Conserved domains of NtRAX
采用 Clustalx软件对来自拟南芥的AtRAX1、AtRAX2、AtRAX3,来自大豆的GmMYB12a、GmMYB12B2、GmMYBJ6、GmMYBJ7、GmMYBZ1、GmMYBZ2,来自杨树的PeMYBF1、PeMYBL1进行多序列比对(图3)。由图3分析,NtRAX蛋白功能与AtRAX具有较高同源性,推测NtRAX具有调节腋芽分生组织形成功能。采用MEGA5软件分析绘制系统进化树(图4)。由进化树可以看出,NtRAX和GmMYBJ7的进化关系最近,推测NtRAX是具有转录激活活性的MYB家族基因。
3 讨 论
MYB类转录因子以保守的MYB结构域为共同特征。MYB结构域是一段约51~53个氨基酸的肽段,每个结构域含有3个保守的色氨酸残基(W)[9],分别被18~19个氨基酸残基隔开,折叠成螺旋-转角-螺旋结构,组成1个疏水核心。按照含有的MYB结构域的数量,MYB转录因子可分成 R1、R2R3、R1R2R3三个家族[9]。MYB转录因子主要参与生物的生长、发育和抗胁迫等方面的调节[10]。绝大多数MYB转录因子在植物代谢调控中起转录激活作用,也有少量起转录抑制作用[11-13]。

图3 NtRAX蛋白与其他MYB蛋白多重比对Fig.3 Multi-alignment of NtRAX and other MYB proteins

图4 烟草、拟南芥、大豆、杨树的部分MYB基因系统进化树Fig.4 A phylogenetic tree of MYB gene from Nicotiana tabacum, Arabidopsis, Glycine max and Populus euramericana
本研究克隆获得了NtRAX基因,对新基因功能的预测,主要是通过同源比对,利用同源基因的功能来推测,得出NtRAX基因是具有转录激活活性的烟草腋芽分生组织形成的调控基因。该基因的功能,还应在后续试验中不断验证。
本试验中烟草品种选择了作为常规对照的品种 K326,所取组织为幼嫩叶片。从研究腋芽基因的角度考虑,有以下想法,可在将来的试验中进一步研究:(1)选择腋芽多发的烟草品种。不同品种的烟草有其独特的生物学表现,腋芽多发品种中相关基因的存在与表达情况是否与常规品种一致。(2)选择烟草植株不同组织,研究相关基因在不同组织的表达情况。(3)对烟草植株进行打顶处理,研究打顶前和打顶后不同组织相关基因的表达情况。
4 结 论
本研究运用RACE方法克隆得到了烟草腋芽基因NtRAX,NCBI登录号为JQ228591,该基因全长1112 bp,编码区954 bp,编码317个氨基酸,同源性分析表明,NtRAX属于MYB基因家族。MYB家族蛋白是一类转录因子,因此,NtRAX基因编码的产物可能通过与相关的转录调节因子结合,激活和促进腋芽的生长。NtRAX基因的克隆,为进一步研究烟草腋芽,从分子角度对腋芽的发生进行干扰奠定了基础。
[1]中国农业科学院烟草研究所.中国烟草栽培学[M].上海:上海科学技术出版社,2005.
[2]太帅帅.烟草GRAS和CDPK基因家族的研究[D].北京:中国农业科学院研究生院,2009.
[3]王卫锋,太帅帅,王鲁,等.烟草NtLS基因RNA干扰表达载体的构建及遗传转化[J].中国烟草科学,2011,32(4)31-35.
[4]Greb T, Clarenz O, Schafer E, et al.Molecular analysis of the LATERAL SUPPRESSOR gene in Arabidopsis reveals a conserved control mechanism for axillary meristem formation [J].Genes Dev, 2003, 17:1175-1187.
[5]Keller T, Abbott J, Moritz T, et al.Arabidopsis regulator of axillary meristems controls a leaf axil stem cell niche and modulates vegetative development[J].Plant Cell,2006, 18: 598-611.
[6]Vannini C, Locatelli F, Bracale M, et al.Overexpression of the riceOsmyb4gene increases chilling and freezing tolerance of Arabidopsis thaliana plants[J].Plant Journal,2004, 37(1): 115-127.
[7]Schmitz G, Tillmann E, Carriero F, et al.The tomato blind gene encodes a MYB transcription factor that controls the formation of lateral meristems[J].Proc Natl Acad Sci USA, 2002, 99: 1064-1069.
[8]Dörte Müller, Gregor Schmitz, Klaus Theres.Blind Homologous R2R3 MYB Genes Control the Pattern of Lateral Meristem Initiation in Arabidopsis[J].The Plant Cell, 2006, 18: 586-597.
[9]Thompson M A, Ramsay R G.MYB:an old oncoprotein with new roles[J].Bioessays, 1995, 17: 341-350.
[10]Stracker.The R2R3MYB gene family in Arabidopsis thaliana [J].Curr Opin Plant Biol, 2001, 4: 447-456.
[11]Lodovico T, Angel M, Adrian P, et al.TheAmMYB308andAmMYB330transcription factors from antirrhinum regulate phenylpropanoid and lignin biosynthesis in transgenic tobacco [J].The Plant Cell, 1998, 10:135-154.
[12]Jin H, Cominelli E, Bailey P, et al.Transcriptional repression byAtMYB4controls production of UV-protecting sunscreens in Arabidopsis[J].European Molecular Biology Organization Journal, 2000, 19:6150-6161.
[13]Aharoni A, De Vos C H, Wein M, et al.The strawberryFaMYB1transcription factor suppresses anthocyanin and flavonol accumulation in transgenic tobacco[J].Plant Journal, 2001, 28: 319-332.

