三个烟草防御素基因的克隆及序列分析
林世锋,任学良,王 轶,王仁刚
(贵州省烟草科学研究所,贵阳 550081)
植物防御素(Plant defensins)是一类富含半胱胺酸的低分子量短肽,广泛分布于植物体内,参与植物的防卫反应,是极为重要的一种抗病因子[1]。植物防御素因种类和结构的差别具有不同作用,包括抗真菌[2-3]和抗细菌[4],以及蛋白酶抑制和抗虫作用[5-6],部分研究也发现防御素可以在环境胁迫情况下对植物体起保护作用[7]。目前,已有不同学者分别从烟草属的普通烟草(Nicotiana tabacum)[8]、高烟草(N.excelsior)[9]、圆锥烟草(N.paniculata)、渐狭叶烟草(N.attenuata)[10]和花烟草(N.alata)[11-12]中克隆到防御素基因,其中部分基因的功能已初步明确,如从花烟草中获得的防御素基因具有抗真菌和抗虫双重作用。
电子克隆(In silico cloning)是近年来伴随着基因组计划和 EST计划而发展起来的基因克隆新方法[13],它依赖于各种生物信息数据库,利用生物软件拼接延伸EST序列,获得目的基因的部分乃至全长的cDNA序列。本研究采用电子克隆的方法获得烟草栽培品种K326(N.tabacum)的3个防御素基因cDNA序列并进行生物信息学分析,以期为进一步研究该类基因的进化关系和功能差异,比较其在烟草病虫害防御反应中的作用奠定基础。
1 材料与方法
1.1 烟草防御素基因的电子克隆
以辣椒防御素CaDEF1基因的全长cDNA序列(GenBank登陆号:AF442388)[7]为信息探针,对GenBank中 EST_others数据库指定物种烟草(Nicotiana tabacum)进行BLAST检索,将检索到的来自于烟草栽培品种K326的全部EST序列利用DNAMAN 6.0软件进行拼接,形成重叠群(contig)。然后用此重叠群再次进行同源检索、拼接,重复以上过程直至没有更多烟草栽培品种 K326的重叠EST检出,最终获得烟草栽培品种 K326防御素cDNA序列片段。再以此片段在 GenBank中进行blastx同源搜索,与其他物种的防御素同源蛋白进行序列比较,进而判断拼接得到的烟草防御素基因cDNA的正确性以及其ORF序列的完整性。
1.2 烟草防御素基因的生物信息学分析
利用NCBI网站(http://www.ncbi.nlm.nih.gov/)提供的ORF finder软件对开放阅读框进行分析并翻译成蛋白质,通过BlastP程序进行序列相似性分析和氨基酸保守性预测;利用瑞士生物信息研究所网站(http://www.expasy.org/tools/)提供的ProtParam、SignalP和NetPhos软件进行蛋白的基本特性、信号肽和磷酸化位点分析,通过 SWISS-MODEL和CPHmodels在线工具对蛋白质的三级结构进行预测;利用 http://www.predictprotein.org/网站提供的Predict Protein软件进行蛋白质二硫键的预测;运用DNAMAN 6.0、ClustalX 2.0和MEGA3.1软件进行氨基酸序列比对和进化树分析。
2 结 果
2.1 烟草防御素基因的电子克隆
利用已知的辣椒防御素基因的核苷酸序列对GenBank中烟草EST数据库进行BLAST检索分析,发现 97条相似性高的 EST序列来自烟草品种K326。对它们进行重叠群分析,结果显示97条EST可拼接成3个独立的cDNA序列,长度为554 bp、496 bp和434 bp,代表烟草3个不同的防御素基因,分别命名为NtDEF1、NtDEF2和NtDEF3(Nicotiana tabacumdefensins)。经NCBI ORF finder分析,三者分别包括一个长度237 bp、234 bp和231 bp的开放读码框,依次编码由78、77和76个氨基酸组成的防御素(图1)。
2.2 烟草防御素的结构特征分析
将推导出的 3个烟草防御素氨基酸序列利用SignalP软件进行信号肽分析,发现 NtDEF1和NtDEF2蛋白氨基端的前20个氨基酸,NtDEF3蛋白氨基端的前19个氨基酸为信号肽(图1)。植物防御素的信号肽不仅具有帮助多肽有效靶向分泌的作用,同时也具有缓解蛋白毒性的作用,只在到达作用空间需要防御素发挥毒性作用的时候才将成熟多肽释放出来[14]。
用推测的氨基酸序列进行BLASTp比较,发现NtDEF1、NtDEF2和NtDEF3均具有γ-硫素蛋白家族(γ-thionin family)结构域(图1),该序列编码具有杀菌功能的毒素功能结构[14-15]。
2.3 烟草防御素的基本特性分析
利用ProtParam软件对3个烟草防御素成熟蛋白进行基本特性分析,结果显示NtDEF1含有原子总数为855,分子式为C259H415N87O84S10,其分子量为6412.2 Da,理论等电点为8.52。在氨基酸组成上,半胱氨酸和精氨酸相同各有8个,均占13.8%;其次是甘胺酸和苏氨酸相同各有6个,均占10.3%。总的带正电荷和总的带负电荷的氨基酸残基数分别为9和6。预测该蛋白不稳定指数为61.06,属于不稳定蛋白。
显示NtDEF2含有原子总数为860,分子式为C268H414N90O78S10,其分子量为6 465.3 Da,理论等电点为8.95。在氨基酸组成上,半胱氨酸含量最高有8个,占14.0%;其次是精胺酸7个占12.3%。总的带正电荷和总的带负电荷的氨基酸残基数分别为11和4。预测该蛋白不稳定指数为63.59,属于不稳定蛋白。

图1 烟草防御素1(A)、2(B)和3(C)cDNA序列及推导的氨基酸序列Fig.1 Nucleotide and deduced amino acid sequences of the tobacco defensins
显示NtDEF3含有原子总数为879,分子式为C271H430N90O80S8,其分子量为 6485.4 Da,理论等电点为9.22。在氨基酸组成上,半胱氨酸含量最高有8个,占14.0%;其次是甘胺酸和精氨酸相同各有7个,均占12.3%。总的带正电荷和总的带负电荷的氨基酸残基数分别为11和4。预测该蛋白不稳定指数为28.89,属于稳定蛋白。
总平均亲水性 GRAVY(grand average of hydropathicity)分析表明,三者 GRAVY值分别为-0.579、-0.523和-0.705,这表明三者均为亲水性蛋白。
2.4 烟草防御素的二硫键预测
NtDEF1、NtDEF2和NtDEF3都含有8个半胱氨酸,经PredictProtein预测软件分析,发现8个半胱氨酸在烟草3种防御素中形成的二硫键连接方式一致,均为Cys-1-Cys-8、Cys-2-Cys-5、Cys-3-Cys-6、Cys-4-Cys-7。其中,图2为NtDEF1二硫键预测结果,这与典型的植物防御素二硫键结构模型相同[14]。

图2 烟草防御素NtDEF1二硫键预测Fig.2 Predicted disulifide bridges in NtDEF1
2.5 烟草防御素三维结构预测
分别应用SWISS-MODEL和CPHmodels在线工具对3个烟草防御素进行蛋白三维结构预测,以PDB数据库中大麦(Hordeum vulgare)防御素(DEF1_HORVU)[16-17]的三维结构(PDB id=1gpt)为模板,对NtDEF1和NtDEF2进行三维结构同源建模,序列一致性为53.2%;以PDB数据库中小麦(Triticum aestivum)防御素(DEF1_WHEAT)[17-18]的三维结构(PDB id=1gps)为模板,对 NtDEF3进行三维结构同源建模,序列一致性为46.8%。预测结果如图3所示。从图中可以看出烟草三种防御素蛋白的三维结构都含有三段反向平行的 β-折叠和一段α-螺旋,与己推导出的植物防御素蛋白结构一致。

图3 烟草防御素1(A)、2(B)和3(C)的三级结构预测Fig.3 Tertiary structure prediction of the tobacco defensins
2.6 氨基酸序列比对和同源性分析
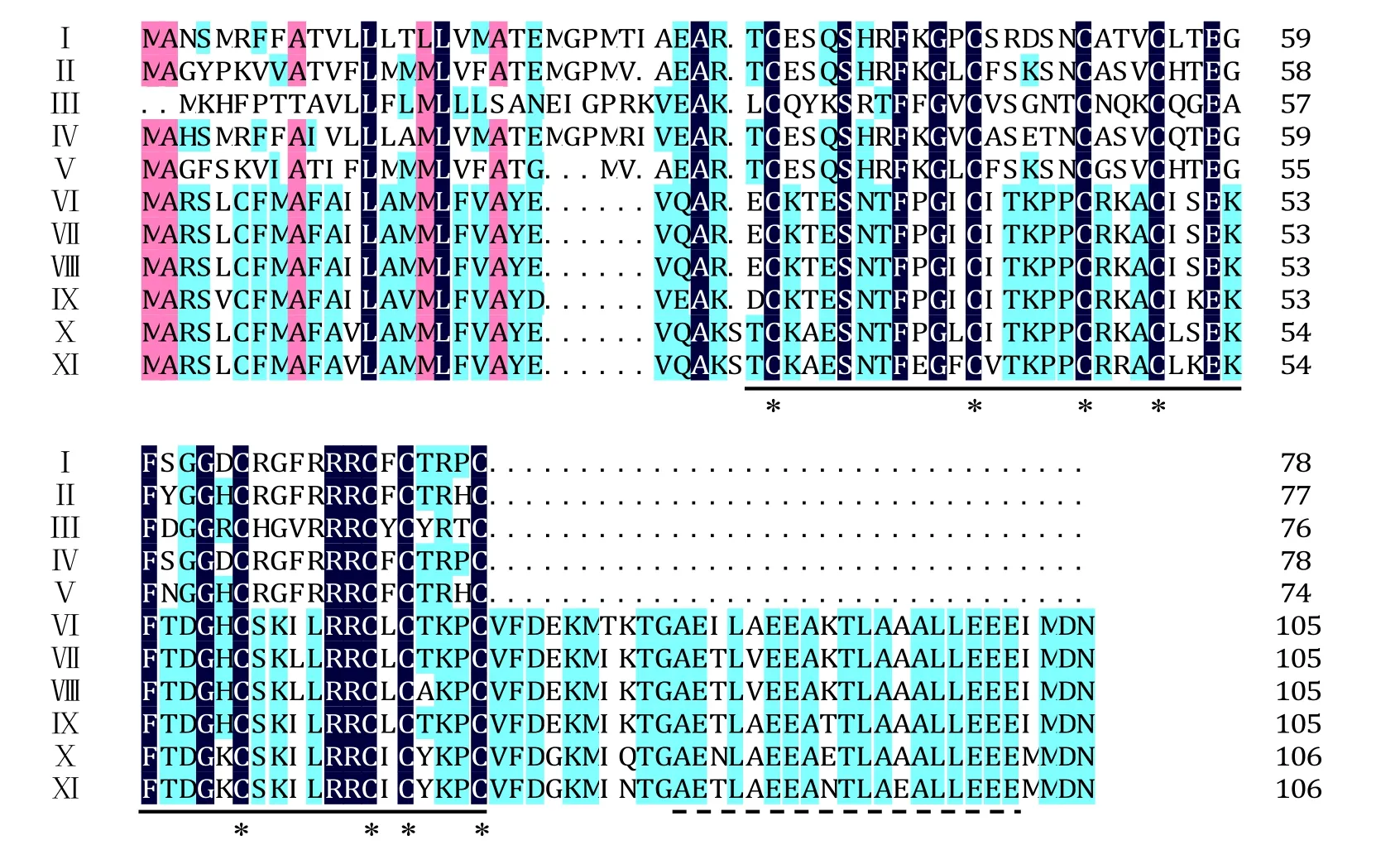
图4 不同植物防御素基因氨基酸序列同源性比较Fig.4 Alignment of deduced amino acid sequences of defensin genes of different plants
3个烟草防御素氨基酸序列与部分其他植物进行比对,结果显示在植物防御素中一些保守的氨基酸在烟草中同样存在(图4),例如:植物防御素的典型特征序列即γ-硫素蛋白结构域在烟草中同样保守,且具有构成4个二硫键所需的8个半胱氨酸残基。利用DNAMAN软件对烟草3种防御素进行同源性分析显示,NtDEF1和NtDEF2的一致性最高为72%,NtDEF1和NtDEF3的一致性最低为40%,NtDEF2和NtDEF3的一致性为47%。与其他物种相比较,三者均与辣椒的一致性最高,在50%~87%。尽管在普通烟草、高烟草、圆锥烟草、渐狭叶烟草及花烟草中已有防御素基因的报道,但是与其一致性都较低,在 33%~40%,且氨基酸 C-端不具备与其对应的低复杂性区域(Low Complexity Region,LCR),表明NtDEF1、NtDEF2和NtDEF3是3个新的烟草防御素基因。
2.7 系统进化树分析
从 GenBank上获得已知的植物防御素的氨基酸序列经ClustalX 2.0比对后,利用Mega 3.1以邻位相接(NJ)构建系统进化树(图5)。结果表明,防御素基因在烟草、辣椒、番茄、拟南芥等植物中均以多种形式存在,且序列差异较大,在系统进化树中分散在遗传距离很远的分支上。NtDEF1、NtDEF2和NtDEF3处于第Ⅰ分支的不同小分支上,而已报道的烟草属防御素基因均处于第Ⅱ分支上,进一步证明前者是烟草3种新的防御素基因。

图5 烟草与其他物种防御素同源蛋白的系统进化分析Fig.5 Phylogenetic analysis of amino acid sequences of defensin genes from tobacco and other species
3 讨 论
基于表达序列标签(Expressed Sequence Tags,EST)的电子克隆策略,具有简单、快速、针对性强等优点,现已成为一种广泛使用的基因克隆技术[13]。本研究以烟草与辣椒同属茄科植物,物种间同源基因序列相对保守为切入点,以辣椒防御素CaDEF1基因cDNA序列作为探针,对烟草EST数据库进行检索拼接,成功克隆到目的物种的3个新防御素基因序列。在电子克隆检索过程中,目标物种锁定烟草(Nicotiana tabacum),全部EST序列来源于同一品种 K326,避免了品种间基因多态性造成序列拼接工作的复杂性,进而增加了电子克隆的准确性。同时,K326是我国主栽烟草品种之一,对其重要功能基因的研究,势必具有重要的理论及应用价值。
研究证实植物防御素具有抗真菌[2-3]、抗细菌[4]和蛋白酶抑制剂[5]等生物活性,而 γ-硫素类防御素由于其功能广泛、分子量小以及稳定等特点在植物基因工程中极具应有前景[14-15]。γ-硫素蛋白超家族功能区具有严格保守的8个半胱氨酸残基,形成4个分子内二硫键以稳定三段反向平行的 β-折叠和一段α-螺旋,从而形成具有复杂三维折叠结构的抗菌短肽[14-15]。尽管本研究克隆到的3个防御素同样具备上述保守功能区,但3个防御素在氨基酸组成上存在一定的区别,如缬氨酸、赖氨酸、苏氨酸和苯丙氨酸的数目差异较显著。这些氨基酸的差异是否造成功能上的差异还需要进一步深入研究。
目前,在番茄、辣椒等茄科植物中已克隆得到多个防御素cDNA序列,其中辣椒防御素CaDEF1和CaDEF2的氨基酸序列一致性为64%,它们在根、茎、叶和果实中的表达模式各不相同[7,19]。我们利用本研究克隆的防御素基因进行 Blastn同源检索时,在烟草的EST数据库中得到了数目不同且高度同源的烟草品种K326的防御素EST序列,其中以NtDEF1为最高。这预示着在烟草中尽管存在结构相对保守的多种防御素,但是其表达分布或者在同一组织中的表达量可能各不相同,提示它们可能在不同或相同的组织中发挥着特异的作用。
[1]Broekaert W F, Terras F R, Cammue B P, et al.Plant defensins: novel antimicrobial peptides as components of the host defense system [J].Plant Physiol, 1995, 108:1353-1358.
[2]Lai F M, DeLong C, Mei K, et al.Analysis of the DRR230 family of pea defensins: gene expression pattern and evidence of broad host-range antifungal activity [J].Plant Sci, 2002, 163: 855-864.
[3]Solis J, Medrano G, Ghislain M.Inhibitory effect of a defensin gene from the Andean crop maca (Lepidium meyenii) againstPhytophthora infestans[J].J Plant Physiol, 2007, 164: 1071-1082.
[4]Choi Y, Choi Y D, Lee J S.Antimicrobial activity of γ-thionin-like soybean SE60 inE.coliand tobacco plants[J].Biochem Biophys Res Commun, 2008, 375: 230-234.
[5]Wijaya R, Neumann G M, Condron R, et al.Defense proteins from seed ofCassia fistulainclude a lipid transfer protein homologue and a protease inhibitory plant defensin [J].Plant Sci, 2000, 159: 243-255.
[6]Chen K C, Lin C Y, Kuan C C, et al.A novel defensin encoded by a mungbean cDNA exhibits insecticidal activity against bruchid [J].J Agric Food Chem, 2002, 50:7258-7263.
[7]Do H M, Lee S C, Jung H W, et al.Differential expression and in situ localization of a pepper defensin(CADEF1) gene in response to pathogen infection,abiotic elicitors and environmental stresses inCapsicum annuum[J].Plant Sci, 2004, 166: 1297-1305.
[8]Gu Q, Kawata E E, Morse M J, et al.A flower-specific cDNA encoding a novel thionin in tobacco [J].Mol Gen Genet, 1992, 234: 89-96.
[9]Yamada S, Komori T, Imaseki H.cDNA cloning of γ-thionin fromNicotiana excelsior(Accession No.AB005266) (PGR97-131) [J].Plant Physiol, 1997, 115:314.
[10]Lou Y, Baldwin I T.Nitrogen supply influences herbivore-induced direct and indirect defenses and transcriptional responses inNicotiana attenuate[J].Plant Physiol, 2004, 135: 496-506.
[11]Lay F T, Brugliera F, Anderson M A.Isolation and properties of floral defensins from ornamental tobacco and petunia [J].Plant Physiol, 2003, 131: 1283-1293.
[12]Lay F T, Schirra H J, Scanlon M J, et al.The three-dimensional solution of NaD1,a new floral defensin fromNicotiana alataand its application to a homology model of the crop defense protein alfAFP [J].J Mol Biol, 2003, 325: 175-188.
[13]Gill R W, Sanseau P.Rapid in silico cloning of genes using expressed sequence tags (ESTs) [J].Biotechnol Annu Rev, 2000, 5: 25-44.
[14]Carvalho A O, Gomes V M.Plant defensins-prospects for the biological functions and biotechnological properties[J].Peptides, 2009, 30: 1007-1020.
[15]Pelegrini P B,Franco O L.Plant γ-thionins: novel insights on the mechanisms of actions of a multi-functional class of defense proteins [J].Int J Biochem Cell Biol, 2005, 37:2239-2253.
[16]Mendez E, Moreno A, Colilla F, et al.Primary structure and inhibition of protein synthesis in eukaryotic cell-free system of a novel thionin, γ-hordothionin, from barley endosperm [J].Eur J Biochem, 1990, 194: 533-539.
[17]Bruix M, Jimenez M A, Santoro J, et al.Solution structure of gamma 1-H and gamma 1-P thionins from barley and wheat endosperm determined by 1H-NMR: a structural motif common to toxic arthropod proteins [J].Biochemistry, 1993, 32: 715-724.
[18]Colilla F J, Rocher A, Mendez E.γ-Purothionins: amino acid sequence of two polypeptides of a new family of thionins from wheat endosperm [J].FEBS Lett, 1990,270: 191-194.
[19]Meyer B, Houlne G, Pozueta-Romero J, et al.Fruit-specific expression of a defensin-type gene family in bell pepper.Upregulation during ripening and upon wounding [J].Plant Physiol, 1996, 112: 615-622.

