黄芩茎叶黄酮对慢性脑缺血大鼠脑内NMDA受体和VEGF表达的影响*
王玉梅,刘永平,曹 凯,秦博文,商亚珍
(河北省重要研究与开发重点实验室/承德医学院中药研究所,河北 承德 067000)
血管性痴呆(vascular dementia,VD)是由脑血管因素导致脑组织损害引起的痴呆综合征,包括缺血性脑血管病、出血性脑血管病以及急性或慢性缺氧性脑血管病引起的痴呆,是老年期痴呆病中最常见的类型之一[1]。严重影响患者的身心健康,给家庭、社会造成了沉重负担。随着医药工作者对VD的认识和研究的不断深入,发现兴奋性氨基酸及其受体的激活以及血管内皮生长因子(vascular endothelial growth factor,VEGF)的生成都与VD的发生、发展和预后密切相关[2]。引起神经元死亡的兴奋性毒性理论已成为脑缺氧缺血性损伤的主要学说,而VEGF促进血管的生成对脑缺血后血管重建及神经功能的恢复起重要作用。
黄芩茎叶黄酮(Scutellaria baicalensis Georgi stem flavonoids,SSF)是从中药黄芩地上部分提取分离的黄酮类化合物,其多羟基结构具有较强的还原性,对神经损伤有很好的保护作用。我们的前期工作已经证明SSF具有抗炎、抗氧化、抗缺氧和改善记忆障碍等作用[3-6]。本实验采用大鼠双侧颈总动脉结扎模型,探讨SSF对慢性脑缺血大鼠海马细胞中N-甲基-D-天门冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)和皮层细胞中VEGF表达的影响。
材料和方法
1 动物和试剂
健康雌性SD大鼠60只(购于河北医科大学实验动物中心,合格证编号为90912),300~320 g;SSF由承德医学院中药研究所制备;引物由上海生工公司合成,NMDAR1(498 bp)上游引物5'-GCAGTAAACCAGGCCAATAAGCG -3',下游引物5'-CTCCATCAGCAGAGCCGTCACAT-3';NMDAR2A(459 bp)上游引物5'-TGGAGATGACACGGACCAGGAG -3',下游引物 5’-AAATCATAGCCAGTGAGGCCGAG-3';NMDAR2B(314 bp)上游引物 5’-GAACGAAACTGACCCAAAGAGC-3',下游引物 5’-CAGGGAA GTAGGTGGTGACGAT-3';VEGF(462 bp)上游引物5'-CTGTACCTCCACCATGCCAAG -3',下游引物5'-ACAAGGCTCACAGTGAACGC-3';β-actin(207 bp)上游引物 5'-CACCCGCGAGTACAACCTTC -3',下游引物 5'- CCCATACCCACCATCACACC - 3';TaKaRa RNA PCR Kit(AMV)Ver.3.0(100次量)购于大连宝生物工程有限公司。
2 大鼠慢性脑缺血模型制备
大鼠仰卧位固定在手术台上,颈内部去毛、强力碘消毒后沿颈正中切开,分离双侧颈总动脉,并套以“0”号线。待动物清醒后结扎双侧颈总动脉。术前称重并腹腔注射10%水合氯醛(3 mL/kg)进行麻醉。术中保证大鼠能自主呼吸,术后每只动物腹腔注射8×104U青霉素钠预防细菌感染。待大鼠完全清醒后送至温度为22℃ ±1℃的动物房饲养,观察;做同样手术操作但不结扎双侧颈总动脉作为假手术组。术后30 d利用水迷宫进行模型筛选,成模率为75%。在手术后第35 d,将造模成功的大鼠随机分为4组:模型组,17.5 mg·kg-1·d-1、35 mg·kg-1·d-1和 70 mg·kg-1·d-1SSF 3个剂量给药组,每组8只。实验动物连续灌胃给药38 d后取材,假手术组和模型组灌胃等体积生理盐水。
3 脑组织细胞中 NMDAR1、NMDAR2A、NMDAR2B和VEGF的检测
采用RT-PCR法检测海马细胞中 NMDAR1 mRNA、NMDAR2A mRNA、NMDAR2B mRNA和皮层细胞中 VEGF mRNA的含量。各组大鼠在术后72 d,末次灌胃给药60 min后,乙醚麻醉,断头冰上取脑,分离海马和皮层并保存于-80℃冰箱中。分别提取海马和皮层细胞中RNA,用DU800紫外可见分光光度计测定RNA浓度和纯度。严格按照TaKaRa RNA PCR Kit(AMV)Ver.3.0 试剂盒说明书进行反转录和PCR反应,PCR反应结束后,进行琼脂糖凝胶电泳,凝胶于紫外透射仪中确认PCR反应产物并摄取图像。利用Quantity One 4.6.2软件进行定量分析,以目的条带的吸光度值与β-actin条带吸光度值的比值,作为各目的基因mRNA表达的相对水平。
4 统计学处理
结 果
1 SSF对慢性脑缺血大鼠海马细胞中 NMDAR1、NMDAR2A和NMDAR2B表达的影响
结果显示,双侧颈总动脉结扎2个月可使大鼠海马细胞中NMDAR1、NMDAR2A和NMDAR2B的mRNA表达明显增加,灌胃给予 SSF 17.5 mg·kg-1·d-1、35 mg·kg-1·d-1和70 mg·kg-1·d-1治疗38 d可不同程度降低大鼠海马细胞中NMDAR1、NMDAR2A和NMDAR2B mRNA的表达。与假手术组相比,慢性脑缺血大鼠海马中NMDAR1、NMDAR2A和NMDAR2B mRNA的表达分别增加了75.86%、75.68% 和84.14%(P<0.01);而3个剂量SSF可不同程度地降低NMDAR1、NMDAR2A和NMDAR2B mRNA的表达,分别降低了10.48%、7.92% 和 13.04%(17.5 mg·kg-1SSF,P <0.05),28.43%、26.09%和 28.67%(35 mg·kg-1SSF,P <0.01),36.24%、39.72% 和 39.80%(70 mg·kg-1SSF,P <0.01),见图1。
2 SSF对慢性脑缺血大鼠皮层细胞中VEGF表达的影响
皮层细胞中VEGF的RT-PCR结果显示,双侧颈总动脉结扎2个月可使大鼠皮层中VEGF mRNA的表达增加了18.57%,具有统计学意义(P<0.01)。灌胃给予SSF 17.5 mg·kg-1·d-1、35 mg·kg-1·d-1和70 mg·kg-1·d-1治疗38 d可不同程度增强慢性脑缺血模型组大鼠皮层中VEGF mRNA的表达,分别增加了11.95%(17.5 mg·kg-1SSF,P<0.05)、16.70%(35 mg·kg-1SSF,P <0.01)和 33.09%(70 mg·kg-1SSF,P <0.01),见图2。
讨 论
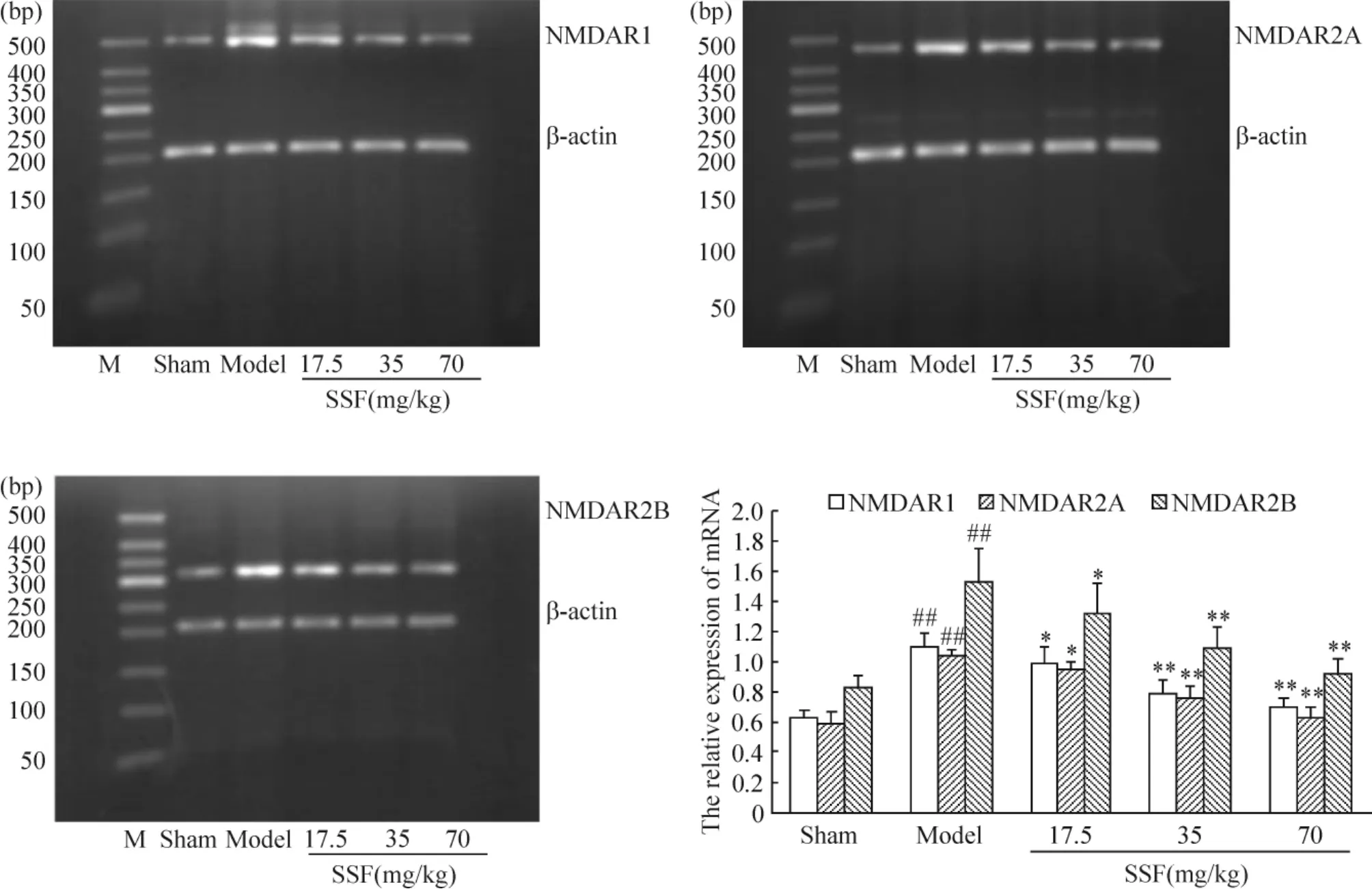
Figure 1.The expression of NMDAR1,NMDAR2A and NMDAR2B mRNA in hippocampus of chronic cerebral ischemia rats.M:marker..n=6.##P<0.01 vs sham group;*P<0.05,**P<0.01 vs model group.图1 SSF对慢性脑缺血大鼠海马细胞中NMDAR1、NMDAR2A和NMDAR2B表达的影响
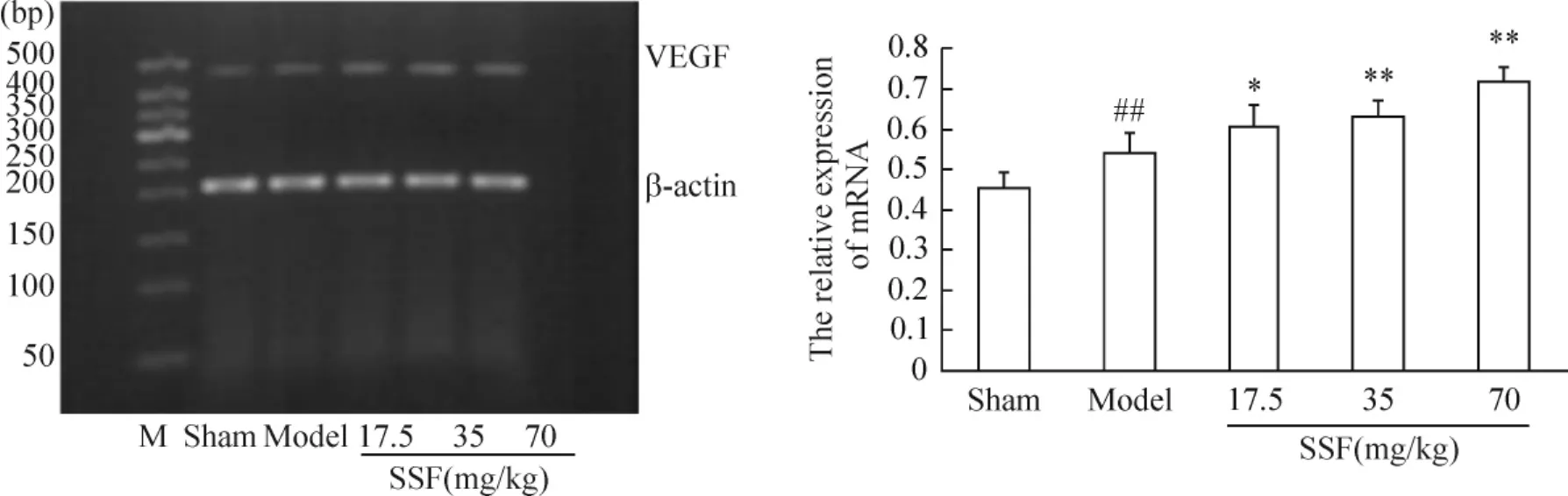
Figure 2.The expression of VEGF mRNA in hippocampus of chronic cerebral ischemia rats.M:marker..n=6.##P<0.01 vs sham group;*P <0.05,**P <0.01 vs model group.图2 SSF对慢性脑缺血大鼠皮层细胞中VEGF表达的影响
中枢内的兴奋性氨基酸是维持正常脑功能,包括学习、记忆、运动、认知和发育等所必需的,如果含量过高,会作为一种神经毒素引起神经细胞肿胀和空泡变性,甚至导致神经细胞死亡[7]。近年来,引起神经元死亡的兴奋性毒性理论已成为脑缺氧缺血损伤的主要学说。在中枢神经系统中,神经元之间的信息传递通过突触来完成。在突触前神经元所释放的不同神经递质的作用下,引起突触后神经元或去极化使其兴奋,或超极化使其抑制[8]。兴奋性氨基酸(excitatory amino acid,EAA)是脑内含量最高且能使神经元兴奋的一类酸性氨基酸神经递质,包括天门冬氨酸和谷氨酸两种,与之相对应的受体分为两大类,离子型EAA受体和代谢型EAA受体。离子型EAA受体包括NMDA受体、α-氨基-3-羟基-5-甲基-4-异噁唑-丙酸受体和海人酸受体[9]。NMDA受体是目前研究最为深入的兴奋性氨基酸受体,也是哺乳动物中枢神经系统主要的EAA受体之一,参与中枢神经许多重要的病理生理过程[10-11]。NMDA受体是一种对 Ca2+高度通透的配体电压门控钙离子通道受体,现已克隆出两类NMDA受体的亚单位,一类为 NMDAR1(NR1),一类为NMDAR2(NR2);NMDAR2又分为 NMDAR2A、NMDA2B、NMDAR2C和NMDAR2D四个亚基,各亚基在不同区域表达有所不同。NR1和NR2A分布广泛,NR2B主要存在于前脑,NR2C多居于小脑,NR2D含量相对较少[12]。NR1是功能亚单位,它自身或与NR2亚单位聚合形成的通道复合体都具有NMDA受体的全部功能特性,而NR2是调节亚单位,它本身不具有NMDA受体的功能活性,但与NR1聚合共表达时可影响NR2的功能活性。要形成有功能的NMDA受体通道,需要组合NR1及NR2亚单位中的一个亚基。新生鼠海马以NR2B和NR1 mRNA表达为主,NR2A mRNA水平很低,此后NR2A随着发育持续增长。成年大鼠海马中以NR1/NR2B/NR2A三聚体的NMDA受体复合物形成最多,而NR1/NR2B和NR1/NR2A含量次之[13]。研究表明,NMDA受体与突触可塑性、学习记忆、神经损伤、癫痫状态、老年性痴呆症等密切相关[14]。在正常静息情况下,NMDA受体的离子通道内存在Mg2+,能阻断Ca2+内流。该受体的激活至少需要3个信号:甘氨酸与NMDA受体结合,谷氨酸与NMDA受体结合,膜去极化。在病理情况下,如缺血/缺氧、低血糖和持续性抽搐等,细胞外谷氨酸就会增加,可达正常的数倍至几十倍,突触间隙过度增加的谷氨酸刺激谷氨酸受体,启动一系列神经细胞损害的病理生化反应,其中包括两个明显不同的过程:一是由非NMDA受体过度兴奋所介导的神经细胞急性渗透性肿胀,可在数小时内发生,以Na+内流,随即Cl-和H2O被动内流为特征;二是由NMDA受体过度兴奋所介导的神经细胞迟缓性损伤,可于数小时至数日发生,以 Ca2+内流为特征[15]。并能导致蛋白酶、核酸内切酶的激活、NO的生成、自由基的产生以及线粒体膜渗透性的改变,从而导致神经元的损伤和死亡。因此,NMDA受体介导的神经兴奋性毒性在缺血性脑损伤中起关键作用[16]。刘永等[17]研究证明NMDA受体活性的持续上调,将导致胞外Ca2+大量持续内流,引起胞内Ca2+超载,激活多种蛋白激酶,并进一步导致受体上调,最终引起迟发性神经元损伤。本实验采用RT-PCR法检测海马细胞中NMDAR1、NMDAR2A和NMDAR2B mRNA的表达情况,结果发现双侧颈总动脉结扎2个月后,模型组大鼠海马细胞中NMDAR1、NMDAR2A和NMDAR2B mRNA的含量均显著上升,而SSF 3个药物组治疗38 d,能不同程度地降低模型组大鼠海马细胞中NMDAR1 mRNA、NMDAR2A mRNA和NMDAR2B mRNA的含量,从而减少兴奋性氨基酸与受体结合产生的毒性作用,减轻脑缺血损伤。
缺血缺氧可造成不同程度的神经系统损害,保护脑免于损害机制之一是增加和改善脑的血流,而新生血管形成则有助于增加组织供血和供氧,对抗缺血缺氧和促进组织修复。近年来大量研究发现,VEGF与脑组织缺血损伤密切相关,脑缺血在一定时间内,脑组织通过血管新生代偿性地促进神经组织结构与功能的恢复。在正常脑组织中仅有少量VEGF蛋白表达,在脑缺血发生时,缺血、低氧作为一种信号激活VEGF/VEGFR系统,促使VEGF蛋白表达升高,特别在海马、皮质对缺血敏感的神经元[18]。近年陆续报道,VEGF不仅可以诱导内皮细胞的增殖、促进微血管的形成,还能直接作用于多种类型的神经细胞发挥神经营养及神经保护作用[19-20]。在本实验中,脑缺血模型组大鼠和SSF 3剂量药物组大鼠脑组织中VEGF蛋白表达均较假手术组增加,且SSF 3剂量药物组VEGF蛋白表达又较脑缺血模型组明显增加。本实验结果表明大鼠脑缺血88 d,脑缺血作为一种刺激信号,可代偿性地促进VEGF的生成,反馈调节慢性脑缺血引起的神经损伤,而3剂量SSF能够进一步促进VEGF的蛋白表达,增加神经组织中VEGF的水平,增加血管通透性,促进血管生成,建立侧支循环,从而恢复神经营养、抑制神经细胞凋亡,达到神经保护作用。
本实验结合以往的研究工作,SSF多羟基结构具有较强的还原性,可通过自身氧化,降低膜脂质过氧化反应,保证细胞膜的完整性和通透性;降低有慢性脑缺血引起的NMDA受体的含量,减少了兴奋性氨基酸与NMDA受体的结合,降低了钙通道开放,降低了由于钙离子内流而引起的细胞内钙超载,从而降低了神经兴奋性毒性引起的神经损伤。同时SSF还能增强脑缺血大鼠脑内VEGF的蛋白表达,促进血管新生,建立侧支循环,从而抑制神经细胞凋亡和神经损伤。提示SSF对缺血性神经损伤的保护作用源于对脑内NMDA受体和血管内皮生长因子蛋白表达的正向调节作用,该作用有利于SSF对VD的治疗。
[1]张秀国.血管性痴呆的中医研究进展[J].天津中医药,2007,24(6):523-525.
[2]张 岗,王发渭.血管性痴呆的基础实验研究进展[J].军医进修学院学报,2010,31(7):734-736.
[3]李素婷,石艳华,杨鹤梅,等.黄芩茎叶总黄酮对肝脏MDA生成的影响[J].中国中医药信息杂志,2001,8(6):23-24.
[4]商亚珍,孟燕彬,缪 红,等.SSF抗小鼠脑缺氧作用[J].中国中医药信息杂志,2002,9(7):24-25.
[5]Shang YZ,Gong MY,Zhou XX,et al.Improving effects of SSF on memory deficits and pathological changes of neural and immunological systems in senescent mice[J].Acta Pharmacol Sin,2001,22(12):1078-1083.
[6]商亚珍,苏丙凡.黄芩根及其茎叶成分的药理学研究进展[J].承德医学院学报,2005,2(22):153-155.
[7]刘建辉,冀凤云.血管性认知障碍与轻度认知障碍的研究进展[J].中国脑血管病杂志,2007,4(5):238-240.
[8]陈惠金.缺氧缺血性脑病的发病机制研究进展及潜在的治疗对策[J].临床儿科杂志,2000,18(2):118-120.
[9]吴晓莉,崔秀玉.兴奋性氨基酸与脑缺血/缺氧预适应[J].神经疾病与精神卫生,2005,5(4):247-250.
[10]Manzerra P,Behrens MM,Canzoniero LM,et al.Zinc induces a Src family kinase-mediated up-regulation of NMDA receptor activity and excitotoxicity[J].Proc Natl Acad Sci USA,2001,98(20):11055-11061.
[11]Chen G,Greengard P,Yan Z.Potentiation of NMDA receptor currents by dopamine D1 receptors in prefrontal cortex[J].Proc Natl Acad Sci USA,2004,101(8):2596-2600.
[12]Liu L,Wong TP,Pozza MF,et al.Role of NMDA receptor subtypes in governing the direction of hippocampal synaptic plasticity[J].Science,2004,304(5673):1021 -1024.
[13]王 谧,姚志彬.NMDA受体2B亚型(NR2B)研究的分子生物学进展[J].解剖学研究,2000,22(2):131-135.
[14]Lee KY,Chou AK,Yang LC,et al.NMDA receptors offer more than one functionality[J].Anesth Analg,2003,96(5):1533-1534.
[15]曾 珍.脑缺氧缺血后谷氨酸的神经毒性机制及其对抗措施的研究[J].实用医院临床杂志,2000,(1):38-39.
[16]李建其,翁志洁.N-甲基-D-天冬氨酸受体拮抗/激动剂作为脑中风治疗药物的开发前景[J].中国药科大学学报,2006,37(2):111-113.
[17]刘 永,高 灿,张光毅.脑缺血/再灌注对海马NMDA受体2A亚基酪氨酸磷酸化的影响[J].徐州医学院学报,2000,20(4):259-261.
[18]Jazwa A,Loboda A,Golda S,et al.Effect of heme and heme oxygenase-1 on vascular endothelial growth factor synthesis and angiogenic potency of human keratinocytes[J].Free Radic Biol Med,2006,40(7):1250-1263.
[19]Stiver SL,Tan X,Brown LF,et al.VEGF-A angiogenesis induces a stable neovasculature in adult murine brain[J].J Neuropathol Exp Neurol,2004,63(8):841 -855.
[20]Mani N,Khaibullina A,Krum JM,et al.Astrocyte growth effects ofvascularendothelialgrowth factor(VEGF)application to perinatal neocortical explants:receptor mediation and signal transduction pathways[J].Exp Neurol,2005,192(2):394-406.

