早期高蛋白饮食对SGA大鼠糖代谢的影响及脂联素-AMPK信号通路在其中的作用*
余慕雪,沈振宇△,莫清萍,丘小汕
(1中山大学附属第一医院儿科,广东 广州 510080;2中山大学附属第一医院黄埔院区儿科,广东 广州 510700)
小于胎龄(small for gestational age,SGA)是指出生体重和(或)身长在同胎龄标准参照群体-2倍标准差(standard deviation,SD)以下[1]。SGA 的远期可发生糖代谢障碍,导致机体胰岛素敏感性下降[2],相关机制尚不明确。生长追赶学说[2]认为随着SGA宫外营养状态改善,在体格追赶生长的过程中可致体脂成分增加,而体脂增加与胰岛素抵抗发生有关。脂联素(adiponectin)是脂肪组织合成和分泌的一种改善机体胰岛素敏感性的激素蛋白质。体脂积聚过程中,脂联素负反馈抑制脂肪组织脂联素的形成和分泌[3]。脂联素-AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)信号通路是脂肪-肌肉轴[4]中的一条与机体糖代谢相关的主要信号通路。体外研究[5]表明活化AMPK可促进胰岛素信号通路效应分子葡萄糖转运蛋白4(glucose transporter 4,GLUT4)的表达,改善骨骼肌对糖的利用,但是目前尚无脂联素-AMPK信号通路在SGA个体的研究报道。阻止SGA胰岛素抵抗的发生,是降低成年期代谢综合征易患性风险的关键。高蛋白饮食对高脂喂养肥胖大鼠的体脂和糖代谢有改善[6];同样我们的前期研究[7]显示SGA大鼠早期高蛋白饮食后恢复正常饮食,能减少体脂成分和避免胰岛素抵抗的发生,高脂高热卡饮食则使体脂增多,并放大了胰岛素抵抗的效应,高蛋白等热卡饮食是营养干预一个较好的饮食结构。本研究旨在研究SGA脂联素-AMPK信号通路的变化及其在高蛋白饮食对SGA大鼠糖代谢影响的作用,为SGA胰岛素抵抗的早期防治提供实验依据。
材料和方法
1 材料
1.1 动物饲料 参考AIN93-G饲料成分配制基础饲料[8],能量为3948 kcal/kg,可利用蛋白质能量占基础饲料总能量的20%;高蛋白饲料能量与基础饲料成分一致,在基础饲料的基础上增加可利用酪蛋白100 g/kg diet、减少淀粉100 g/kg diet,可利用蛋白质能量占高蛋白饲料总能量的30%。
1.2 主要试剂 血糖试剂盒购于上海复旦张江生物医药股份有限公司。胰岛素试剂盒购于中国同位素公司。脂联素试剂盒购于Millipore。PMSF、RIPA(P0013B)裂解液购于碧云天生物技术研究所。BCA法蛋白定量检测试剂盒购于南京凯基生物科技发展有限公司。AMPKα (23A3)rabbit mAb、phospho-AMPKα (Thr172)(40H9)rabbit mAb、GLUT4(1F8)mouse mAb、辣根过氧化酶标记羊抗兔IgG和辣根过氧化酶标记马抗小鼠IgG购于Cell Signaling。小鼠抗GAPDH单克隆抗体购于上海康成生物公司。
2 方法
2.1 SGA大鼠动物模型建立 广东省医学动物中心提供SPF级Sprague-Dawley大鼠。雌、雄性大鼠2∶1合笼自然交配,交配后雌性大鼠阴道涂片,发现精子视为妊娠第1 d,然后雌性孕鼠分笼喂养。正常对照组孕鼠受孕后基础饲料自由饮食,平均每天进食饲料(25±2)g;SGA模型组孕鼠,受孕后第1 d始限制饮食,以自由饮食雌性孕鼠前1 d食量的约40%为进食量,平均每天进食基础饲料(10±0.5)g,待自然分娩。正常母鼠分娩的正常新生雄鼠24只为正常对照组(CN组)。SGA模型组孕鼠分娩鼠仔出生体重和身长低于正常对照组孕鼠分娩鼠仔-2SD以下者为SGA大鼠。48只SGA新生雄鼠出生时随机分为SGA对照组(CS组)、SGA高蛋白质组(HPS组)各24只。哺乳期所有分组的鼠仔每窝控制为8只,保留符合条件的雄性鼠仔,不足8只雄性鼠仔则保留部分符合条件的雌性鼠仔。
2.2 动物分组和处理
2.2.1 动物分组和饲养 CN和CS组大鼠,0~3周哺乳期母鼠予以基础饲料自由饮食,断乳后幼鼠再予以基础饲料自由饮食至满12周龄;HPS组大鼠,0~3周哺乳期母鼠予以高蛋白饲料自由饮食,断乳后幼鼠再予以高蛋白饲料1周,4周龄(相当于人类儿童期)后予基础饲料自由饮食至满12周龄(相当于人类成年期)。
2.2.2 动物处理 4周龄时,各组12只大鼠禁食12 h,腹腔内注射10%水合氯醛(3 mL/kg)麻醉,眼眶静脉丛取血1~2 mL,血标本立即离心吸取血清;开腹分离双侧肾周和附睾脂肪组织称重,分离大鼠右后肢股二头肌骨骼肌组织,所有组织-80℃冷冻保存。12周龄时,各组12只大鼠禁食12 h,腹腔内注射10%水合氯醛(3 mL/kg)麻醉,眼眶静脉丛取血1~2 mL,血标本立即离心吸取血清;然后各组随机取6只大鼠行口服糖耐量试验(oral glucose tolance test,OGTT),予50%葡萄糖(5 mL/kg)灌胃,分别于灌胃后30、60、120 min眼眶静脉丛取血1 mL,血标本立即离心吸取血清;次日各组12只大鼠禁食12 h后腹腔内注射10%水合氯醛(3 mL/kg)麻醉,开腹分离双侧肾周和附睾脂肪组织称重,分离大鼠右后肢股二头肌骨骼肌组织,所有组织-80℃冷冻保存。
2.3 各指标检测方法和计算
2.3.1 血清学指标检测 眼眶静脉丛取血后血标本立即离心,吸取血清,马上采用氧化酶-过氧化物酶法在全自动生化分析仪上检测血糖;其余置于-80℃冰箱储存,取空腹血清统一放射免疫法检测胰岛素水平、酶联免疫吸附法检测脂联素水平。
2.3.2 计算胰岛素抵抗指数(homeostasis model assessment model for insulin resistance,HOMA-IR)HOMA-IR=空腹胰岛素(mU/L)×空腹血糖(mmol/L)/22.5[9]。
2.3.3 OGTT血糖曲线下面积(area under the curve,AUC) 采用梯形面积法[10]计算。
2.3.4 内脏脂肪计算 内脏脂肪质量(visceral fat mass,VFM)为双侧肾周脂肪与附睾脂肪质量之和。计算内脏脂肪体重百分比(VFM%)。VFM%=VFM(g)/体重(g)×100%。
2.3.5 脂肪细胞面积计算 每组随机抽取8只大鼠的附睾脂肪组织标本,甲醛固定后石蜡包埋切片、常规HE染色。Olympus BX60显微镜下采用Image-Pro Plus 5.1中文版软件进行图像分析,同一标本在400倍高倍显微镜下任选10个视野,测量每个视野的脂肪细胞面积,取算术平均值为该标本的内脏脂肪细胞面积。
2.3.6 骨骼肌AMPKα、p-AMPKα和GLUT4蛋白测定 用Western blotting法。提取骨骼肌蛋白后,采用BCA法测定蛋白质浓度。孵育Ⅰ抗:加入用4%BSA/TBS溶液稀释的浓度为1∶500的AMPK、p-AMPK、GLUT4Ⅰ抗以及1∶8000的 GAPDH Ⅰ抗,用塑料膜封闭后置冷库孵育过夜。用1×TBST洗膜10 min×3次。孵育Ⅱ抗:将膜浸泡于用5%的脱脂奶粉/TBST溶液按照1∶2000配制的辣根过氧化酶标记的抗兔或抗小鼠的Ⅱ抗,室温下孵育60 min,用1×TBST洗膜10 min×3次。使用ODYSSEY红外荧光扫描成像系统扫描图像并进行灰度分析。半定量分析各检测骨骼肌靶蛋白和内参照GAPDH的含量,分别计算各个实验组与同周龄正常对照组检测蛋白的表达相对量。
3 统计学处理
结 果
1 体重和内脏脂肪体重百分比
表1显示,CN组新生雄鼠的出生体重显著高于CS组和HPS组(均P<0.01),CN组和HPS组差异无统计学意义(P>0.05)。4周龄时CS组体重显著低于CN组和HPS组(均P<0.05),而CN组与HPS组比较差异无统计学意义(P>0.05)。12周龄时各组体重差异无统计学意义(P>0.05)。4和12周龄时CS组VFM%显著高于CN组和HPS组(均P<0.01),CN组和 HPS组差异无统计学意义(P>0.05)。
2 内脏脂肪细胞面积
4和12周龄CS组大鼠内脏脂肪细胞面积显著大于CN组和HPS组(均P<0.01),而CN组和HPS组差异无统计学意义(P>0.05),见图1。
表1 各组大鼠4和12周龄体重、内脏脂肪质量和内脏脂肪体重百分比Table 1.Body weight,visceral fat mass(VFM)and body visceral fat mass percentage(VFM%)at 4 and 12 weeks of age()
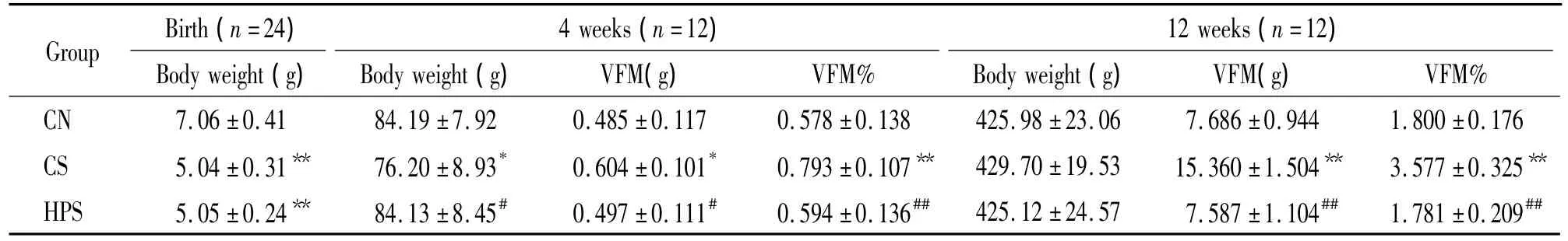
表1 各组大鼠4和12周龄体重、内脏脂肪质量和内脏脂肪体重百分比Table 1.Body weight,visceral fat mass(VFM)and body visceral fat mass percentage(VFM%)at 4 and 12 weeks of age()
CN:normal control;CS:SGA control;HPS:high-protein intervention SGA group.*P <0.05,**P <0.01 vs CN group;#P <0.05,##P<0.01 vs CS group.
4 weeks(n=12)Group Birth(n=24)12 weeks(n=12)Body weight(g) Body weight(g) VFM(g) VFM% Body weight(g) VFM(g) VFM%CN 7.06±0.41 84.19±7.92 0.485±0.117 0.578±0.138 425.98±23.06 7.686±0.944 1.800±0.176 CS 5.04±0.31** 76.20±8.93* 0.604±0.101* 0.793±0.107** 429.70±19.53 15.360±1.504** 3.577±0.325**HPS 5.05±0.24** 84.13±8.45# 0.497±0.111# 0.594±0.136## 425.12±24.57 7.587±1.104## 1.781±0.209##

Figure 1.Adipocyte area of visceral fat at 4 weeks(A)and 12 weeks(B)of age..n=8.**P<0.01 vs CN group;##P<0.01 vs CS group图1 各组大鼠4和12周龄内脏脂肪细胞面积
3 糖代谢和血清脂联素水平
4周龄各组大鼠HOMA-IR差异无统计学意义(P>0.05)。12周龄CS组HOMA-IR显著高于CN组和HPS组(均P<0.01),CN组和HPS组差异无统计学意义(P>0.05)。4和12周龄血清脂联素水平CS组低于CN组和HPS组(P<0.05或P<0.01),CN组和 HPS组差异无统计学意义(P>0.05),见表 2。
表2 各组大鼠4和12周龄空腹血糖、胰岛素、HOMA-IR和脂联素水平Table 2.Fasting blood glucose,insulin,HOMA-IR and serum adiponectin levels at 4 and 12 weeks of age(.n=12)

表2 各组大鼠4和12周龄空腹血糖、胰岛素、HOMA-IR和脂联素水平Table 2.Fasting blood glucose,insulin,HOMA-IR and serum adiponectin levels at 4 and 12 weeks of age(.n=12)
**P <0.01 vs CN group;#P <0.05,##P <0.01 vs CS group.
4 weeks HOMA-IR Adiponectin(mg/L)CN 5.13±0.60 5.41±0.96 1.23±0.20 7.766±0.52 Group 12 weeks Glucose(mmol/L)Insulin(mU/L)HOMA-IR Adiponectin(mg/L)Glucose(mmol/L)Insulin(mU/L)3 5.41±0.83 7.30±0.58 1.76±0.36 5.839±0.587 CS 5.17±0.72 5.48±0.98 1.26±0.32 6.825±0.639** 5.64±0.78 9.31±0.72** 2.34±0.46** 4.741±0.613**HPS 5.04±0.51 5.57±1.00 1.24±0.26 7.493±0.652# 5.32±0.75 7.21±0.79## 1.72±0.38## 5.784±0.676##
12周龄大鼠OGTT见图2,各组空腹血糖水平差异无统计学意义(P>0.05),血糖高峰期均在30 min,30 min血糖CS组显著高于CN组(P<0.01)和HPS组(P<0.05),CN组和HPS组差异无统计学意义(P>0.05);各组之间60、90、120 min血糖差异无统计学意义(P>0.05);OGTT中血糖AUC见图3,CS组显著高于CN组和HPS组(均P<0.05),CN组和HPS组差异无统计学意义(P>0.05)。
4 骨骼肌AMPKα和磷酸化AMPKα的表达
各组大鼠骨骼肌AMPKα和p-AMPKα的表达见图4。4和12周龄时各组骨骼肌AMPKα表达的相对量差异无统计学意义(P>0.05);p-AMPKα的表达相对量CS组低于CN组和 HPS组(均 P<0.01),CN组和 HPS组差异无统计学意义(P>0.05)。
5 骨骼肌GLUT4的表达
4和12周龄时CS组大鼠骨骼肌GLUT4蛋白表达的相对量显著低于 CN组和 HPS组(均 P<0.01),而CN组和HPS组骨骼肌GLUT4表达差异均无统计学意义(均P>0.05),见图5。

Figure 2.Blood glucose in response to OGTT in rats at 12 weeks of age..n=6.**P<0.01 vs CN group;#P<0.05 vs CS group.图2 各组大鼠12周龄OGTT血糖改变
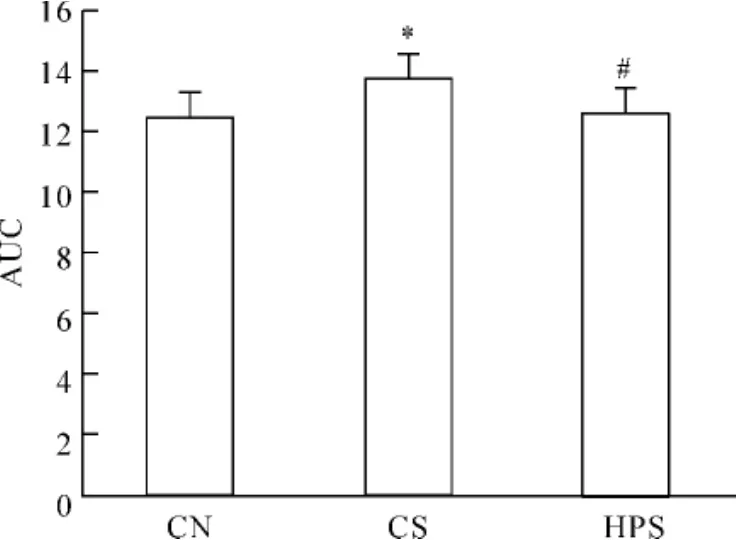
Figure 3.Areas under the curves(AUC)of blood glucose in response to OGTT in rats at 12 weeks of age..n=6.*P<0.05 vs CN group;#P<0.05 vs CS group图3 各组大鼠12周龄OGTT血糖曲线下面积
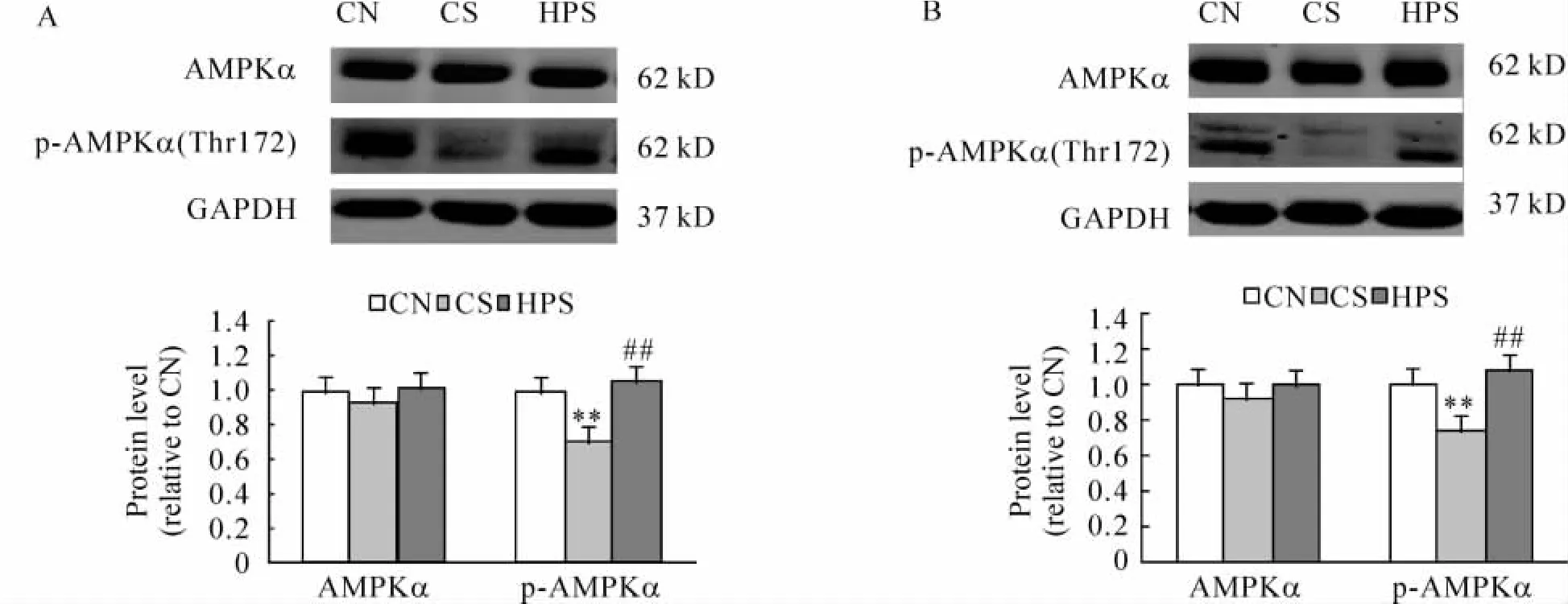
Figure 4.AMPKα and p-AMPKα expression in skeletal muscle of rats at 4 weeks(A)and 12 weeks(B)of age..n=6.**P<0.01 vs CN group;##P<0.01 vs CS group.图4 各组大鼠4和12周龄骨骼肌AMPKα和p-AMPKα的表达

Figure 5.GLUT4 expression in skeletal muscle of rats at 4 weeks(A)and 12 weeks(B)of age..n=6.**P<0.01 vs CN group;##P<0.01 vs CS group.图5 各组大鼠4和12周龄骨骼肌GLUT4的表达
讨 论
糖代谢障碍是胰岛素抵抗的基础,胰岛素抵抗导致机体胰岛素介导的葡萄糖代谢能力下降[11]。GLUT4是胰岛素和非胰岛素信号通路共同的下游效应分子,表达于对胰岛素敏感的组织(如肌肉和脂肪组织)中,其从细胞内转移到细胞膜,实现葡萄糖的跨膜转运[12]。骨骼肌在维持机体糖代谢中起重要作用,胰岛素刺激后的糖摄取85%由骨骼肌完成,骨骼肌GLUT4的表达、从胞浆移位到细胞膜是糖摄取的主要过程[11]。GLUT4表达障碍可致机体糖代谢异常的发生[12]。本研究12周龄SGA大鼠HOMA-IR增高,OGTT显示其糖代谢异常;4周龄SGA大鼠未见HOMA-IR改变,推测与SGA大鼠脂肪组织快速增长过程中,利用糖增多,糖由肌肉组织转移到脂肪组织,且骨骼肌糖摄取障碍时,肝脏可以发挥部分代偿作用[13]等有关。本研究还发现4和12周龄SGA大鼠骨骼肌 GLUT4表达下调,可能与脂联素 -AMPK通路活化受损、下调其下游效应分子GLUT4表达有关,而早期予SGA大鼠高蛋白饮食则上调脂联素-AMPK通路,提高骨骼肌GLUT4表达,改善其糖代谢。
SGA有关GLUT4上游信号通路研究大部分集中在胰岛素信号通路磷脂酰肌醇3-激酶(phosphatidy linositol 3-kinase,PI3K)途径的研究。Oak等[14]研究示SGA成年大鼠骨骼肌PI3K途径中的远端关键分子蛋白激酶Cζ活化减弱是肌肉组织对外源性胰岛素发生抵抗的主要原因;而Jensen等[15]对SGA青年男性骨骼肌活检检测示PI3K途径中蛋白激酶B磷酸化水平低下。我们的研究显示SGA大鼠骨骼肌GLUT4表达下降,与非胰岛素信号通路脂肪-肌肉轴中脂联素-AMPK通路活化受损有关。AMPK是脂联素信号转导通路和胰岛素信号转导通路间的重要联系分子。AMPK是一个异三聚体蛋白,α亚单位中的苏氨酸172位点磷酸化对AMPK活性的调节起重要作用。除了AMP/ATP比值升高是激活AMPK的经典途径外,脂联素参与了AMPK信号途径转导[16]。脂联素通过激活AMPK调节糖代谢,骨骼肌中脂联素-AMPK信号通路通过脂联素受体1相结合蛋白/LKB1和磷脂酶C/Ca2+/Ca2+调钙蛋白依赖性蛋白激酶的激酶通路转导,使AMPK磷酸化[17]。Tomas等[18]在大鼠肌肉中加入脂联素,AMPK活化及糖摄取增加。活化的AMPK可以使组蛋白去乙酰酶(histone deacetylase,HDAC)5中259和498位的丝氨酸磷酸化,调节HDAC5与肌细胞加强因子2的结合状态上调GLUT4的表达[5]。此外,活化的AMPK使乙酰辅酶A羧化酶(acetyl CoA carboxylase,ACC)磷酸化,抑制ACC的活性,促进细胞脂肪酸氧化,减少游离脂肪酸含量[19],而体外骨骼肌细胞培养加入游离脂肪酸可以通过降低生长因子受体结合蛋白2、细胞外信号调节蛋白激酶2、丝裂原活化蛋白激酶激酶1/2、过氧化物酶体增殖物激活受体γ辅激活因子-1信号蛋白表达,使骨骼肌细胞GLUT4的基因和蛋白表达下降[20-22]。
本研究中,SGA大鼠出生后追赶生长时伴有内脏脂肪增多,脂肪细胞增大,而血清脂联素水平降低。宫内营养不良SGA个体出生体脂成分少于正常出生体重个体[23],SGA个体生后营养供应增加时,脂肪组织保持宫内低产热状态,骨骼肌保持宫内糖利用减少的状态,出现脂肪和肌肉组织之间能量和葡萄糖的转移和再分配,更多的能量和葡萄糖糖由肌肉组织转移到脂肪组织[24]。Isganaitis等[25]研究示SGA脂肪细胞ACC和脂肪酸合成酶等表达增高使脂肪细胞增大。在脂肪细胞形成时,脂联素合成增加,在体脂过多积聚过程中,负反馈抑制脂联素的形成和分泌[3]。临床和动物实验研究显示肥胖个体血清脂联素水平低下而减肥或体脂水平下降后血清脂联素水平上升[26]。
在肥胖成年人的研究中,血管紧张素转化酶抑制剂、血管紧张素Ⅱ受体拮抗剂等药物可用于增加脂肪组织脂联素的分泌,通过运动、饮食等方式控制体重、减少体脂成分也能提高血清脂联素水平[27]。脂联素参与AMPK信号途径转导,并为目前治疗胰岛素抵抗、改善机体糖代谢的靶点之一[16]。Hoenig等[28]予以肥胖个体高蛋白饮食后体脂减少,血脂联素上升,机体胰岛素敏感性有改善;Pasarica等[29]对肥胖糖尿病成人予以运动、低热卡饮食1年,其体脂成分减少、脂肪细胞体积减少,伴血清脂联素水平上升和胰岛素敏感性改善。Polson等[30]予以大鼠高蛋白低脂饮食后脂肪组织脂联素基因表达增加。我们的研究增加饮食中蛋白/能量比,防止SGA宫外生长过程中体脂过多积聚,且早期高蛋白饮食改善SGA大鼠血清脂联素水平及机体糖代谢。SGA大鼠经早期高蛋白营养干预,4和12周龄时骨骼肌GLUT4表达上调,推测高蛋白干预上调其脂联素-AMPK信号通路。
综上所述,早期SGA高蛋白营养干预可能是通过脂联素-AMPK信号通路提高 GLUT4表达,达到改善糖代谢的作用。
[1]Kiess W,Chernausek SD,Hokken-Koelega AC.Small for gestational age:causes and consequences[M].1st ed.Basel:Karger,2009:1-10.
[2]Ong KK.Catch-up growth in small for gestational age babies:good or bad?[J].Curr Opin Endocrinol Diabetes Obes,2007,14(1):30-34.
[3]Nedvídková J,Smitka K,Kopský V,et al.Adiponectin,an adipocyte-derived protein[J].Physiol Res,2005,54(2):133-140.
[4]Sell H,Dietze-Schroeder D,Eckel J.The adipocytemyocyte axis in insulin resistance[J].Trends Endocrinol Metab,2006,17(10):416-422.
[5]Mcgee SL,van Denderen BJ,Howlett KF,et al.AMP-activated protein kinase regulates GLUT4 transcription by phosphorylating histone deacetylase 5[J].Diabetes,2008,57(4):860-867.
[6]Honors MA,Hargrave SL,Kinzig KP.Glucose tolerance in response to a high-fat diet Is improved by a highprotein diet[J].Obesity(Silver Spring),2011 Oct 27.[Epub ahead of print]
[7]黄婷婷,丘小汕,沈振宇,等.孕期营养不良对子代大鼠胰岛素抵抗的影响[J].中华预防医学杂志,2004,38(3):182-185.
[8]Reeves PG,Nielsen FH,Fahey GC Jr.AIN-93 purified diets for laboratory rodents:final report of the American Institute of Nutrition ad hoc writing committee on the reformulation of the AIN-76A rodent diet[J].J Nutr,1993,123(11):1939-1951.
[9]Matthews DR,Hosker JP,Rudenski AS,et al.Homeostasis model assessment:insulin resistance and β-cell function from fasting plasma glucose and insulin concentrations in man[J].Diabetologia,1985,28(7):412-419.
[10]Psyrogiannis A,Kyriazopoulou V,Symeonidis A,et al.Relative iron“overload”in offspring of patients with type 2 diabetes mellitus:a new component in the conundrum of insulin resistance syndrome?[J].Hormones(Athens),2003,2(3):161-168.
[11]Peppa M,Koliaki C,Nikolopoulos P,et al.Skeletal muscle insulin resistance in endocrine disease[J].J Biomed Biotechnol,2010,2010:527850.
[12]Klip A.The many ways to regulate glucose transporter 4[J].Appl Physiol Nutr Metab,2009,34(3):481-487.
[13]Minokoshi Y,Kahn CR,Kahn BB.Tissue-specific ablation of the GLUT4 glucose transporter or the insulin receptor challenges assumptions about insulin action and glucose homeostasis[J].J Biol Chem,2003,278(36):33609-33612.
[14]Oak SA,Tran C,Pan G,et al.Perturbed skeletal muscle insulin signaling in the adult female intrauterine growthrestricted rat[J].Am J Physiol Endocrinol Metab,2006,290(6):E1321-E1330.
[15]Jensen CB,Martin-Gronert MS,Storgaard H,et al.Altered PI3-kinase/Akt signalling in skeletal muscle of young men with low birth weight[J].PLoS One,2008,3(11):e3738.
[16]Viollet B,Mounier R,Leclerc J,et al.Targeting AMP-activated protein kinase as a novel therapeutic approach for the treatment of metabolic disorders[J].Diabetes Metab,2007,33(6):395-402.
[17]Zhou L,Deepa SS,Etzler JC,et al.Adiponectin activates AMP-activated protein kinase in muscle cells via APPL1/LKB1-dependent and phospholipase C/Ca2+/Ca2+/calmodulin-dependent protein kinase kinase-dependent pathways[J].J Biol Chem,2009,284(33):22426-22435.
[18]Tomas E,Tsao TS,Saha AK,et al.Enhanced muscle fat oxidation and glucose transport by ACRP30 globular domain:acetyl-CoA carboxylase inhibition and AMP-activated protein kinase activation[J].Proc Natl Acad Sci USA,2002,99(25):16309-16313.
[19]宋 杰,李 静,胡阳黔,等.黄芪多糖活化AMPK减轻游离脂肪酸对C2C12成肌细胞的细胞毒性[J].中国病理生理杂志,2012,28(2):298-301.
[20]郭启煜,高 妍,丛 琳.游离脂肪酸对大鼠骨骼肌细胞葡萄糖转运蛋白4和胰岛素信号传导蛋白的影响[J].中华医学杂志,2001,81(14):866-867.
[21]Coll T,Jove M,Rodriguez-Calvo R,et al.Palmitatemediated downregulation of peroxisome proliferator-activated receptor-γ coactivator 1α in skeletal muscle cells involves MEK1/2 and nuclear factor- κB activation[J].Diabetes,2006,55(10):2779-2787.
[22]Michael LF,Wu Z,Cheatham RB,et al.Restoration of insulin-sensitive glucose transporter(GLUT4)gene expression in muscle cells by the transcriptional coactivator PGC-1[J].Proc Natl Acad Sci U S A,2001,98(7):3820-3825.
[23]Muhlhausler B,Smith SR.Early-life origins of metabolic dysfunction:role of the adipocyte[J].Trends Endocrinol Metab,2009,20(2):51-57.
[24]Dulloo AG.Thrifty energy metabolism in catch-up growth trajectories to insulin and leptin resistance.[J].Best Pract Res Clin Endocrinol Metab,2008,22(1):155-171.
[25]Isganaitis E,Jimenez-Chillaron J,Woo M,et al.Accelerated postnatal growth increases lipogenic gene expression and adipocyte size in low-birth weight mice[J].Diabetes,2009,58(5):1192-1200.
[26]Zhuang XF,Zhao MM,Weng CL,et al.Adipocytokines:a bridge connecting obesity and insulin resistance[J].Med Hypotheses,2009,73(6):981-985.
[27]Montecucco F,Mach F.Update on therapeutic strategies to increase adiponectin function and secretion in metabolic syndrome[J].Diabetes Obes Metab,2009,11(5):445-454.
[28]Hoenig M,Thomaseth K,Waldron M,et al.Insulin sensitivity,fat distribution,and adipocytokine response to different diets in lean and obese cats before and after weight loss[J].Am J Physiol Regul Integr Comp Physiol,2007,292(1):R227-R234.
[29]Pasarica M,Tchoukalova YD,Heilbronn LK,et al.Differential effect of weight loss on adipocyte size subfractions in patients with type 2 diabetes[J].Obesity(Silver Spring),2009,17(10):1976-1978.
[30]Polson DA,Thompson MP.Macronutrient composition of the diet differentially affects leptin and adiponutrin mRNA expression in response to meal feeding[J].J Nutr Biochem,2004,15(4):242-246.

