姜黄素对放线菌素D/TNF-α诱导的PC12细胞和大鼠海马神经元损伤的影响
行妍妍,汪军兵,谢 赛,龚 正,陆大祥,董 军△,唐红梅,潘 锐,邓钦莹,熊国吟
(1暨南大学医学院病理生理学系,国家中医药管理局重点实验室,2暨南大学-香港大学脑功能与健康联合实验室,3暨南大学附属第一医院骨科,广东 广州 510632)
随着艾滋病(acquired immunodeficiency syndrome,AIDS)在全世界的广泛传播,人们对人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染的神经系统并发症,尤其是HIV相关神经认知紊乱(HIV - associated neurocognitive disorder,HAND)的关注度逐渐增高。最新研究表明,HIV-1病毒蛋白感染激活巨噬细胞和小胶质细胞分泌细胞因子引起的脑内免疫反应是HAND神经元损伤的主要原因[1]。肿瘤坏死因子 α(tumor necrosis factor α,TNF-α)就是其中一种重要的细胞因子,能在组织损伤及炎症中通过多种机制诱导细胞凋亡。但正常细胞对TNF-α并不敏感,除非同时加用抑制RNA或蛋白质合成的药物,如放线菌素 D(actinomycin D,ActD)才能显示明显的毒性作用[2]。
中药单体姜黄素(curcumin)是从姜科姜黄属植物根茎中提取的一种天然活性成分,是一种安全有效的具有抗炎、抗HIV等多种药理活性的药物[3],这些药理活性使其具有了防治HAND的潜力。因此本研究通过观察中药单体姜黄素对ActD/TNF-α协同诱导的PC12细胞和大鼠海马神经元损伤的影响,探讨姜黄素对神经元的保护作用及其机制。
材料和方法
1 材料
高分化PC12细胞购自中国科学院上海细胞库;健康Sprague-Dawley(SD)大鼠(36只,雌雄不限)由广东省实验动物中心提供;姜黄素(DMSO溶解,超净水稀释)购自Fluka;TNF-α(超净水稀释)购自PeproTech;ActD(DMSO稀释)购自Sigma;IX-71型倒置荧光显微镜购自Olympus;Annexin V-FITC检测试剂盒购自南京凯基生物公司;FACSAria流式细胞仪购自BD。
2 方法
2.1 PC12细胞的培养 PC12细胞用含10%胎牛血清的DMEM高糖培养基培养,置于37℃、5%CO2细胞培养箱中,待单层细胞70%~80%汇合后,用0.25%胰酶消化后传代培养。
2.2 实验分组 将PC12细胞分为以下6组:对照组(control)、TNF-α组、ActD组、姜黄素组、ActD/TNF-α组和姜黄素+ActD/TNF-α组,调整药物终浓度50 μg/L TNF - α、10 μg/L ActD 和5 μmol/L 姜黄素。
2.3 倒置荧光显微镜普通光观察各组细胞的形态变化 取对数生长期细胞,将细胞种植于6孔培养板,加药处理后的细胞放入37℃、5%CO2培养箱中继续培养24 h后,倒置显微镜下观察各组细胞形态的变化。最后用Olympus Image-Pro Plus 6.0软件拍摄细胞照片并进行对比分析。
2.4 Annexin V-PI染色流式细胞仪检测细胞凋亡率取对数生长期细胞,经0.25%胰酶消化后收集,PBS洗涤2次,收集(1~5)×105细胞,依次加入binding buffer悬浮细胞 500 μL、Annexin V - FITC 5 μL 和 PI 5 μL,混匀,室温下避光反应10~15 min,进行流式细胞仪检测,激发波长488 nm,发射波长530 nm。
2.5 流式细胞术检测细胞内Ca2+浓度 取对数生长期细胞进行相应处理后,PBS洗1次,加入5 μmol/L钙离子荧光探针Fluo-3 AM,37℃细胞培养箱内孵育30 min后离心去除多余染料,用PBS洗1次,PBS悬浮细胞后用流式细胞仪检测荧光强度。
2.6 海马脑片长时程增强(long-term potentiation,LTP)的诱导和记录
2.6.1 实验分组 36只大鼠随机分为6组,每组6只。切成脑片后通过孵育给药的方式,用50 mL药液孵育各组脑片0.5 h,各组给药情况及剂量同PC12细胞。
2.6.2 离体海马脑片的制备 大鼠用戊巴比妥钠麻醉后快速断头取脑,脑组织放入冰冻的(4℃)通氧人工脑脊液(ACSF)中冰冻2 min,分离海马并用组织切片机沿海马长轴方向连续切成400 μm厚的切片,将切好的脑片移入各组预先经氧饱和的ACSF中33℃孵育30 min。
2.6.3 脑片的孵育 实验采用静置-灌流两用界面式浴槽,浴槽上置有尼龙网。脑片置于网上孵育,下面与槽内 ACSF接触。孵育过程通以含95%O2和5%CO2的混合氧,室温孵育1 h后转入记录槽准备记录。
2.6.4 LTP的诱发及记录 绝缘的双极钨电极作为刺激电极,每隔30 s给予恒定的电流刺激(50~400 μA)Schaffer侧支,刺激的强度和持续时间以能产生30%~40%最大反应为宜,此为基础刺激。充以ACSF的玻璃微电极(阻抗为2~5 MΩ)作为记录电极,将记录电极插入CA1区锥体细胞树突层100~200 μm,记录的电活动是给予电刺激后CA1区锥体细胞树突层的场兴奋性突触后电位(field excitatory postsynaptic potential,fEPSP),经放大器 (Axon 200B)放大后,通过数模转换器(Axon Digidata 1322A)在2.5 kHz频率下数字化电信号,并贮存在电脑上。给予30 min基础刺激后,用高频电刺激(high-frequency stimulation,HFS;频率100 Hz,持续1 s,串间隔20 s,共2串)刺激 Schaffer侧支轴突,在海马CA1区记录fEPSP的变化,进行60 min记录。其中,第45 min fEPSP起始斜率的值代表LTP的诱发和变化情况。如果fEPSP起始斜率增幅在20%以上,并且能维持30 min以上则认为LTP成功诱发。
3 统计学处理
使用SPSS 13.0统计软件进行统计学处理。计量数据用均数±标准差()表示,组间比较用单因素方差分析(One-way ANOVA)。LTP实验采用Original 7.0和pClamp 9.0软件分析,测量给予脑片HFS后第45 min fEPSP的起始斜率,以基础水平的百分数形式表示LTP的幅度。以P<0.05为差异有统计学意义。
结 果
1 姜黄素对ActD/TNF-α致细胞形态变化的影响
倒置显微镜下观察发现,正常组PC12细胞体积较大,神经突起明显,细胞贴壁能力强。TNF-α组、ActD组和姜黄素组PC12细胞形态与正常组无明显区别。ActD/TNF-α组细胞发生明显损伤:体积变小,突起减少变短,细胞贴壁能力减弱。而姜黄素干预组细胞与ActD/TNF-α组细胞相比,损伤程度明显改善:突起也有恢复,细胞贴壁能力增强,细胞数量也明显增加,见图1。

Figure 1.Effect of curcumin(Cur)on morphological changes of PC12 cells treated with ActD/TNF-α.A:control;B:50 μg/L TNF - α;C:10 μg/L ActD,D:5 μmol/L Cur;E:50 μg/L TNF - α +10 μg/L ActD;F:5 μmol/L Cur+50 μg/L TNF - α +10 μg/L ActD.图1 姜黄素对ActD/TNF-α诱导PC12细胞形态变化的影响
2 姜黄素对ActD/TNF-α致细胞凋亡的影响
流式细胞术检测结果显示,对照组的凋亡率为4.03% ±0.22%,TNF-α组、ActD组和单独姜黄素组的凋亡率与正常对照组相比,差异无统计学意义(P>0.05);而ActD/TNF-α处理PC12细胞后,流式细胞术检测细胞凋亡率达到38.67% ±2.08%,明显高于正常对照组细胞(P<0.05);姜黄素干预后细胞凋亡率为19.67% ±2.52%,与ActD/TNF-α组相比有显著差异(P<0.05),说明ActD和TNF-α协同处理可诱导PC12细胞明显凋亡,姜黄素则可以改善这种损伤,见图2。
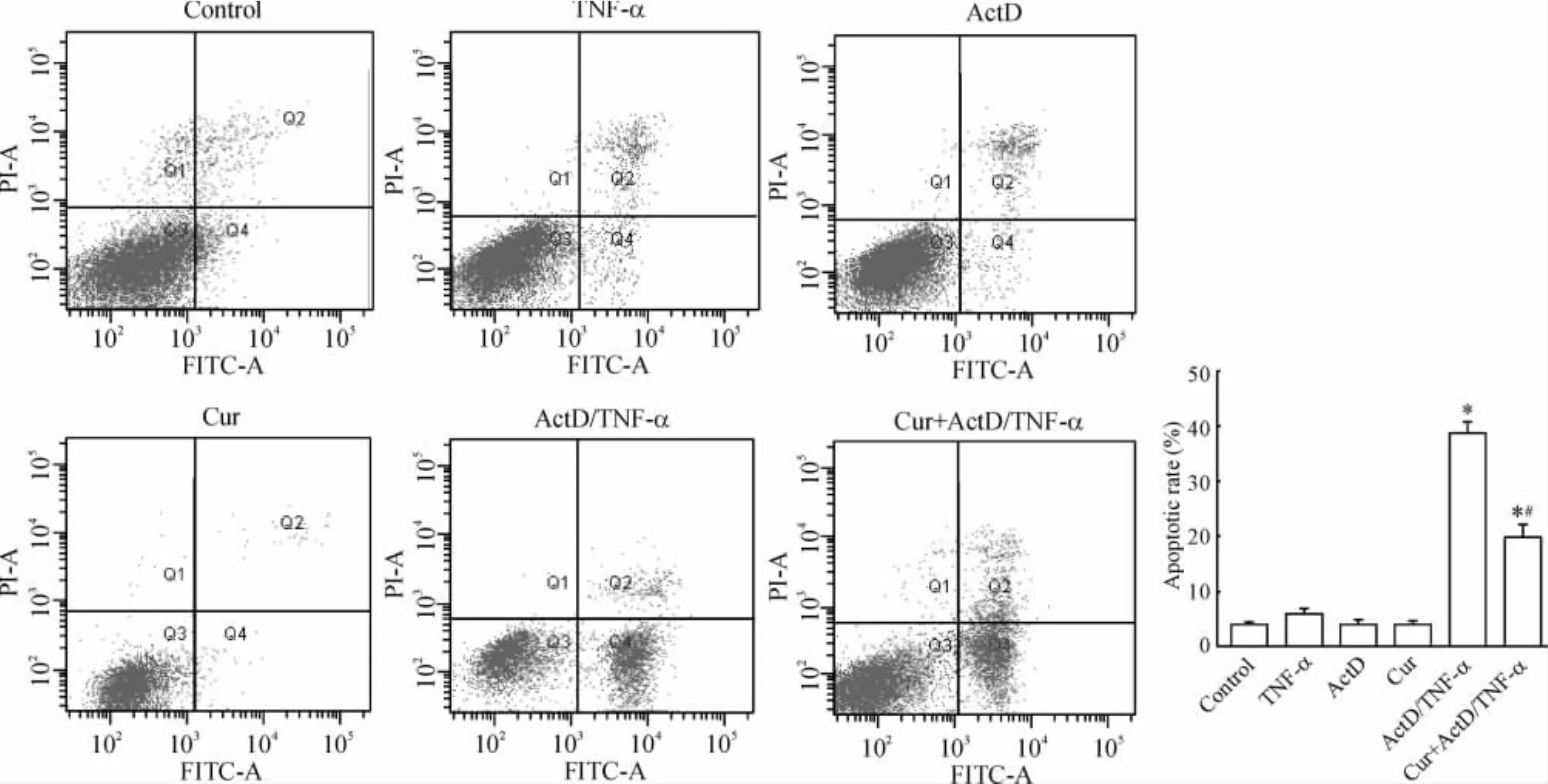
Figure 2.Effect of curcumin(Cur)on the apoptotic rate of PC12 cells damaged by ActD/TNF-α..n=3.*P<0.05 vs control;#P<0.05 vs ActD+TNF-α.图2 姜黄素对ActD/TNF-α损伤的PC12细胞凋亡率的影响
3 姜黄素对ActD/TNF-α致细胞内Ca2+浓度变化的影响
图3中流式细胞术检测各组细胞内Ca2+的荧光强度结果显示,TNF-α组、ActD组和单独姜黄素组PC12细胞内钙离子浓度与对照组相比,差异无统计学意义(P>0.05)。ActD/TNF-α组细胞荧光强度显著高于正常对照组(P<0.05)。经5 μmol/L姜黄素干预后,细胞Ca2+荧光强度显著下降(P<0.05)。这说明ActD/TNF-α可引起PC12细胞内Ca2+浓度明显升高,而姜黄素可抑制由ActD/TNF-α引起的PC12细胞内Ca2+浓度的升高。
4 姜黄素对ActD/TNF-α致海马CA1区LTP抑制作用的影响
对照组给予HFS后,fEPSP起始斜率显著增大,平均增强幅度为159.52% ±7.46%;TNF-α组、ActD组和单独姜黄素组平均增强幅度与正常对照组相比,差异无统计学意义 (P>0.05)。ActD/TNF-α组给予HFS后fEPSP起始斜率增大不明显,且很快回到基线水平,平均增强幅度为 116.80% ±7.68%,与对照组相比差别有统计学意义(P<0.05,n=6)。姜黄素与ActD/TNF-α共孵育海马脑片予以HFS后,fEPSP起始斜率为136.68% ±6.13%,与ActD/TNF-α组相比显著增大,差异有统计学意义(P<0.05,n=6)。表明本实验条件下,ActD/TNF-α显著抑制大鼠海马神经元LTP的产生,而姜黄素可改善ActD/TNF-α对大鼠海马CA1区神经元突触可塑性的抑制作用,对大鼠海马神经元有功能性保护作用,见图4。
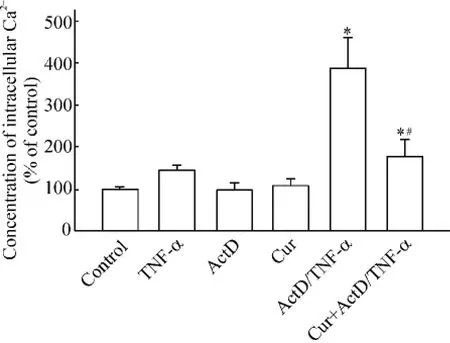
Figure 3.Effect of curcumin(Cur)on concentrations in Ca2+of PC12 cells exposed to ActD/TNF-α..n=3.*P<0.05 vs control;#P<0.05 vs ActD/TNF-α.图3 姜黄素对ActD/TNF-α致细胞内Ca2+浓度变化的影响

Figure 4.The long-term potentiation in the CA1 region of rat hippocampal slices in different groups.HFS:high-frequency stimulation;fEPSP:field excitatory postsynaptic potential.图4 各组大鼠海马脑片CA1区长时程增强
讨 论
神经细胞的凋亡是大脑发育过程中的一种正常生理过程,但在大脑损伤和疾病状态下,凋亡便成为对大脑有害的因素,导致神经退行性疾病的神经元损伤和丢失[4]。研究表明,当机体处于炎症等多种病理状态时,TNF-α能诱导某些细胞凋亡,如HAND患者脑内TNF-α合成和分泌明显增加。研究发现,TNF-α需与ActD合用才可引发明显的肝细胞凋亡。ActD为转录抑制剂,可使肝细胞对TNF-α的敏感性大大增强[2]。因此本研究采用TNF-α和ActD连用以探究二者的协同致凋亡作用。筛选出合适的用药剂量后,我们采用10 μg/L ActD和50 μg/L TNF-α协同作用PC12细胞24 h,倒置显微镜观察细胞形态发现,PC12细胞突触明显缩短、胞体皱缩、细胞数量也明显减少,细胞发生了明显损伤,流式细胞术也显示ActD/TNF-α组凋亡率明显上升,证实了ActD/TNF-α可协同诱导PC12细胞发生凋亡。
中药单体姜黄素具有抗炎、抗HIV-1、免疫调节、抗肿瘤、抗氧化等多种药理功效,并且具有毒副作用小、血脑屏障透过性好等优点,可能是治疗HAND的前景药物。本实验室前期研究表明姜黄素可改善gp120 V3环所致学习记忆障碍大鼠的行为学功能,促进学习记忆相关蛋白的表达并提高学习记忆能力;保护gp120 V3环损伤的大鼠海马神经元突触,保护神经元突触形态及其基本功能,抑制神经元的凋亡[5-7]。在此基础之上,本研究拟观察姜黄素对ActD/TNF-α诱导的PC12细胞损伤的影响并探明其可能机制。倒置显微镜实验中我们发现5 μmol/L的姜黄素可以改善ActD/TNF-α对细胞的损伤作用;流式细胞术显示姜黄素可以显著减少ActD/TNF-α引起的细胞凋亡。由此我们初步得知姜黄素对ActD/TNF-α协同诱导PC12细胞损伤具有保护作用。
1973年Bliss等[8]通过高频电刺激麻醉兔的内嗅皮层,兴奋海马表层的穿通纤维,在齿状回记录场电位,发现了LTP效应。如今此效应被公认为神经元生理活动和信息储存的客观指标,广泛用于学习记忆过程的机制及药物对学习记忆能力的影响的研究。本实验中我们采用离体大鼠海马脑片,运用细胞外微电极记录技术观察ActD/TNF-α对大鼠海马脑片CA1区神经元突触可塑性的影响。发现ActD/TNF-α处理后,LTP的诱发明显受到抑制,而用姜黄素和ActD/TNF-α共同孵育海马脑片后,海马脑片的 LTP部分恢复,fEPSP的起始斜率与ActD/TNF-α组相比差异有统计学意义。由此进一步证实,姜黄素可以部分拮抗ActD/TNF-α造成的大鼠海马LTP抑制,保护神经细胞的正常功能。
那么姜黄素究竟是通过什么机制来发挥其保护作用的呢?针对此问题,我们进行了更近一步的研究。在神经系统里,钙离子是重要的细胞内信使,是维持突触传递、可塑性和神经元发育的重要物质[9]。“钙调整点”的假说认为:细胞内适宜浓度的Ca2+可以促使生长锥的正常生长、延伸,而Ca2+浓度过高或过低时则会抑制神经突起的生长。本实验采用Fluo-3 AM标记技术测定胞内游离Ca2+的变化,发现50 μg/L TNF- α 和 10 μg/L ActD 共孵育可以显著升高细胞内的钙离子浓度,而用姜黄素共同孵育后,ActD/TNF-α造成的细胞内钙离子的高浓度显著降低。这个研究结果提示,姜黄素发挥细胞保护作用的机制可能跟降低PC12细胞内的钙离子浓度、抑制胞内发生钙超载引起的细胞不可逆损伤有关。
[1]Glass JD,Fedor H,Wesselingh SL,et al.Immunocytochemical quantitation of human immunodeficiency virus in the brain:correlations with dementia[J].Ann Neurol,1995,38(5):755-762.
[2]胡 聪,韩聚强,孙辉臣,等.TNFα/ActD诱导的大鼠肝细胞凋亡超微结构观察[J].肝脏,2001,6(2):114,144.
[3]Cole GM,Teter B,Frautschy SA.Neuroprotective effects of curcumin[J].Adv Exp Med Biol,2007,595:197 -212.
[4]Li R,Yang L,Lindholm K,et al.Tumor necrosis factor death receptor signaling cascade is required for amyloidbeta protein - induced neuron death[J].J Neurosci,2004,24(7):1760 -1771.
[5]Tang H,Lu D,Pan R,et al.Curcumin improves spatial memory impairment induced by human immunodeficiency virus type 1 glycoprotein 120 V3 loop peptide in rats[J].Life Sci,2009,85(1-2):1-10.
[6]董 军,陆大祥,潘 锐,等.姜黄素对gp120所致大鼠学习记忆障碍的作用及机制研究[J].细胞与分子免疫学杂志,2008,24(4):328-331.
[7]黄 涛,董 军,陆大祥,等.CREB在姜黄素改善gp120所致大鼠学习记忆障碍中的作用[J].暨南大学学报:自然科学与医学版,2008,29(4):362-366.
[8]Bliss TV,Lomo T.Long-lasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path[J].J Physiol,1973,232(2):331-356.
[9]Stevens TR,Krueger SR,Fitzsimonds RM,et al.Neuroprotection by nicotine in mouse primary cortical cultures involves activation of calcineurin and L-type calcium channel inactivation[J].J Neurosci,2003,23(31):10093-10099.

