小鼠肺微血管内皮细胞的培养鉴定及其血管形成功能的研究*
高润娣, 曹 婕,卢 珊, 应 琳,高 璇, 陆国华,李和权, 周建英
(浙江大学医学院附属第一医院呼吸内科,浙江 杭州 310003)
肺微血管内皮细胞(pulmonary microvascular endothelial cells,PMVECs)内衬于肺泡微血管内壁,在多种肺部疾病的血管再生过程中起着重要作用[1]。本文报道一种简单、重复性极好的PMVECs原代培养方法,并运用基质胶(matrigel)体外二维小管形成实验开展其体外功能研究。
材料和方法
1 主要试剂
RPMI-1640培养基和胎牛血清购自PAA;胰蛋白酶购自Gibco;血管内皮生长因子(vascular endothelial growth factor,VEGF)购自PeproTech;兔抗人Ⅷ因子相关抗原多克隆抗体(polyclonal rabbit anti-human factorⅧ -related antigen,ⅧF-Ag)购自DAKO;兔Ⅱ抗和DAB试剂盒购自北京中杉金桥;四甲基吲哚碳花青标记乙酰化低密度脂蛋白(1,1'-dioctadecyl-3,3,3',3'- tetramethylindo - carbocynamina perchlorate labeled acetylated low-density lipoprotein,DiI-Ac-LDL)购自Invitrogen;异硫氰酸荧光素标记的异植物血凝素(fluorescein isothiocyanate-labeled Bandeiraea simplicifolia lectin I,FITC -BSI)购自 Vector Laboratories;基质胶(matrigel)购自BD;明胶(gelatin)购自Sigma。
2 方法
2.1 小鼠肺微血管内皮细胞培养
2.1.1 原代培养 取小于1周龄的健康C57BL/6小鼠,断颈处死后置75%乙醇中浸泡3~4 min。在无菌操作台剪开胸腔,自右心室心尖处进针缓慢推注0.3 mL RPMI-1640液冲净肺循环血液。用微型镊轻轻剥离脏层胸膜,将肺组织的边缘部分剪切成1 mm×1 mm×1 mm大小的组织块后转移至盛有1 mL胎牛血清的培养皿中,置细胞培养箱内孵育30 min(37℃、5%CO2)。随后,将组织块(10块/孔)均匀贴入1%明胶包被的24孔板,斜置于培养箱中固化45 min后加入200 μL RPMI-1640液(含20%胎牛血清、肝素 9×104U/L及双抗),8 h后再添加800 μL,隔天半量换液。60 h后将组织块去除,以免成纤维细胞等混杂细胞迁出,并添加VEGF(5 μg/L)。当绝大多数区域的细胞长成致密细胞层时进行首次消化并重新铺于原孔。
2.1.2 传代培养 在细胞长满孔板面积的70% ~80%时(原代细胞培养至第7 d左右)进行传代:吸弃上清,DHanks液洗2次,加200 μL不含EDTA的0.25%胰酶消化3~4 min,加1 mL含胎牛血清的培养基终止消化,移液器吹打混匀细胞后转移至无菌离心管,210×g离心5 min,弃上清,用含VEGF的RPMI-1640液重悬,按1∶2比例(即将1个培养板孔的细胞平均分配至2个孔)传代。
2.2 细胞鉴定
2.2.1 形态学观察 倒置显微镜下观察细胞形态与生长情况。
2.2.2 Ⅷ因子相关抗原间接免疫组化染色 分别以4%多聚甲醛固定细胞(4℃、15 min)、0.2%Triton X-100穿膜15 min以及羊血清封闭10 min,加入Ⅰ抗兔抗人Ⅷ因子相关抗原(1∶50),37 ℃孵育1.5 h,再加入Ⅱ抗羊抗兔 IgG,37 ℃孵育1 h,随后进行DAB显色、苏木精复染,倒置显微镜下观察。
2.2.3 FITC -BSI结合实验以及 DiI-Ac-LDL摄取实验第3代细胞每孔加入25 mg/L DiI-Ac-LDL,37℃孵育12 h后,PBS冲洗3遍,4%多聚甲醛固定15 min后,每孔加入20 mg/L FITC-BSI,37℃孵育1 h,荧光显微镜下观察拍照。
3 PMVECs体外血管形成功能的研究
基质胶置4℃冰箱过夜融化,以RPMI-1640培养基按2∶1稀释,取50 μL均匀铺于96孔板置细胞培养箱静置(37℃,30 min),待凝固后每孔逐滴缓慢加入200 μL PMVECs悬液(1×108cells/L),提高 VEGF 浓度至10 μg/L,在倒置显微镜下观察(2 h 1次)其24 h体外血管形成过程。
结 果
1 形态学观察
组织块贴于培养板24 h后镜下即见少量PMVECs爬出,60 h后则在90%以上的组织块周围分布。至第4~5 d,细胞区域性生长密集,第7 d时内皮细胞生长均匀,融合成单层,多呈短梭形、多角形,为典型铺路石样排列,见图1。
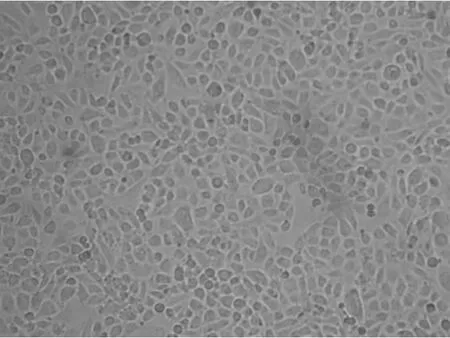
Figure 1.Phase-contrast micrograph of PMVECs(×200).Primary PMVECs are polygonal and fusiform with clear boundaries and show a cobblestone-like appearance.图1 原代培养的小鼠PMVECs
2 细胞鉴定
2.1 Ⅷ因子相关抗原间接免疫组化染色 Ⅷ因子相关抗原表达阳性,镜下可见细胞胞质和核膜周围呈棕黄色颗粒,见图2。
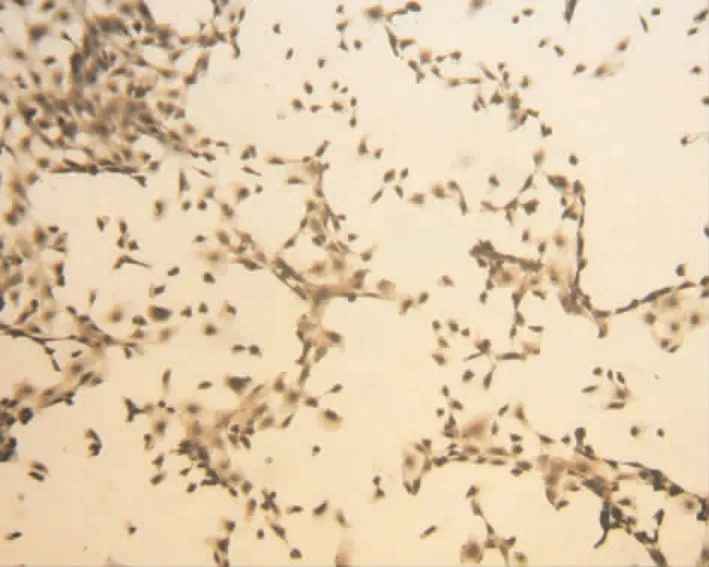
Figure 2.Identification of mouse PMVECs for factorⅧ -related antigen(×100).The expression of factorⅧ -related antigen of PMVECs is positive,and their cytoplasm is typically stained brown-yellow.图2 小鼠PMVECs的Ⅷ因子相关抗原鉴定
2.2 FITC-BSI结合实验以及DiI-Ac-LDL摄取实验 荧光显微镜下可见大部分细胞摄取DiI-Ac-LDL,胞质呈现红色荧光,细胞表面与FITC-BSI结合,呈现黄绿色荧光,见图3。
3 体外血管形成
PMVECs(纯度大于90%)接种于基质胶后,在2 h内即可贴壁、黏附,4~6 h形成分散的网状及管腔结构,管腔周围聚集单层细胞,其数量逐渐增多。10~12 h后,网状结构相互交通、连接似“蜂窝状”,随后管腔结构逐渐减少,见图4。
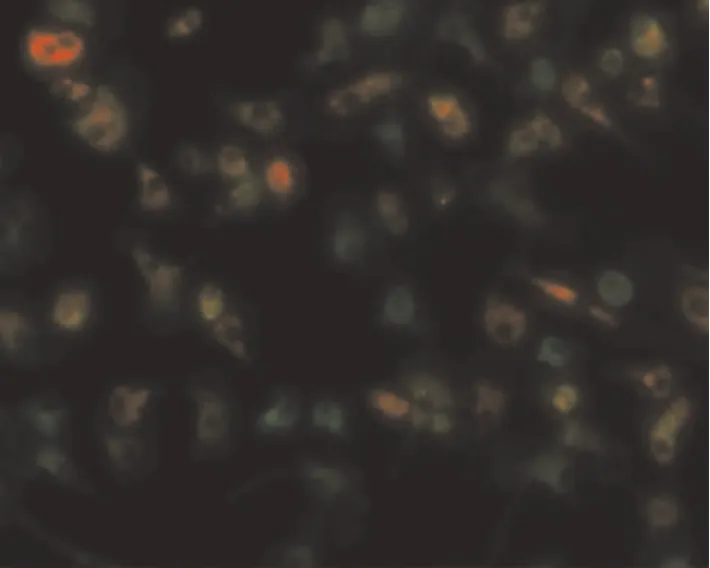
Figure 3.Identification of mouse PMVECs by immunofluorescent method(×200).Positive immunoreactivity for binding with FITC-BSI(green)is shown as well as uptake of DiI-Ac-LDL(red)by PMVECs.图3 小鼠PMVECs的免疫荧光鉴定
讨 论
自从Jaffe等[2]首次体外成功培养人脐带静脉内皮细胞以后,血管内皮细胞的培养技术不断改进,目前主要有酶消化法、组织块法等。其中,组织贴块法因操作简便、对细胞损伤较小、获得细胞活力强而广为大家采用。本文综合多种组织贴块法[3-4],并对许多细节做了改进:(1)选用出生1周以内的小鼠肺组织[3],其细胞的增殖能力较成年小鼠旺盛,爬出的细胞在短时间内即能长成单层致密层。(2)实验前小鼠予以肝素化以便灌洗去除肺循环血液,避免血细胞影响PMVECs的迁出。(3)组织块贴壁牢固与否非常关键,故我们采用1%明胶预处理24孔板,并将肺组织块置于含少许血清(可增强组织块的黏附性)的培养皿中孵育45 min后再贴块。倾斜放置培养板能够减少组织块的固化时间。在PMVECs原代培养过程中我们采取以下方法以减少混杂细胞的污染:(1)取边缘肺组织(距游离缘﹤1.5 mm)以减少大血管内皮细胞和平滑肌细胞的污染。(2)贴块24 h后PMVECs开始游出,而成纤维细胞等混杂细胞在72 h后才爬出,故在贴块60 h去除组织块能保证大部分细胞为PMVECs。(3)采用含有肝素钠与VEGF的培养基,前者不仅能提高PMVECs对VEGF的敏感性,而且可以抑制平滑肌细胞的生长[5]。(4)在PMVECs原代培养过程中,成纤维细胞污染最为常见,我们分别采用了细胞刮除法和差速消化法以去除独立成片和散在分布的成纤维细胞。
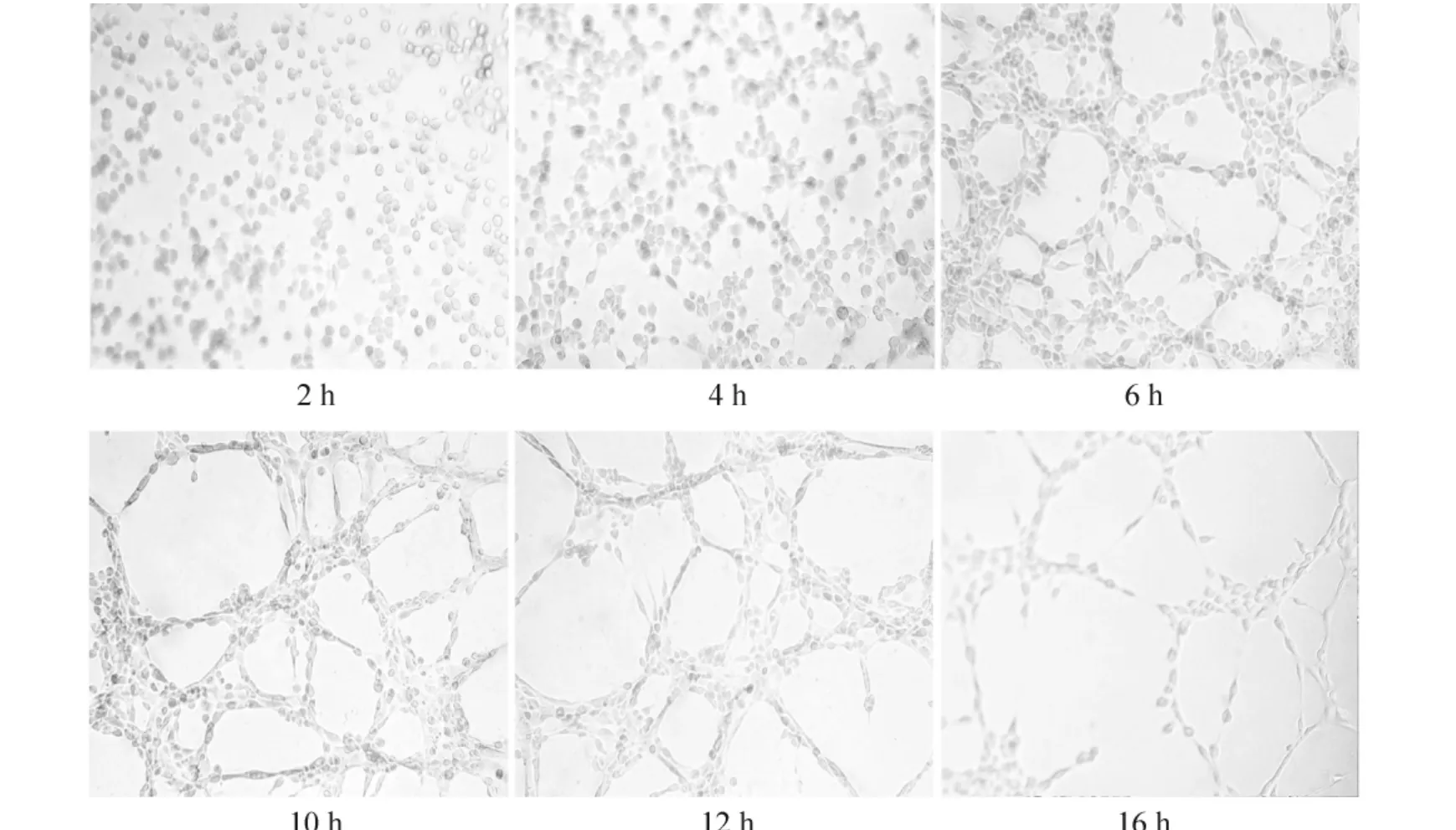
Figure 4.Dynamic process of the tube formation of PMVECs plated on matrigel(×200).The cells initially attached in the first hour,then migrated toward each other and formed capillary-like tubes over the next 4~6 h,which matured at 10~12 h with a“honeycomb”appearance.After 16 h,the tubes detached from the matrix and broke apart.图4 PMVECs体外血管形成的动态过程
体外管样形成实验是血管内皮细胞在基质胶上形成具有管腔的毛细管状结构,涉及内皮细胞的黏附、迁移、蛋白酶活性和管样形成等多个步骤,十分接近体内血管新生的机制。该方法可用于促血管形成因子和拮抗因子的确定、参与血管形成的基因和信号通路的研究以及内皮细胞或者内皮祖细胞的鉴定[6]。与文献报道一致,我们发现PMVECs接种4~6 h后出现明显的管腔结构,10~12 h呈蜂窝状结构,此后管腔结构逐渐减少,一般认为,这是由于PMVECs发生凋亡所致[6]。诸多因素可影响该实验的成败,但最为关键的是PMVECs的状态和数量。我们的经验是PMVECs传代次数不超过5代,接种前台盼蓝检测活细胞应在95%以上;铺板的PMVECs细胞数在5×104cells/cm2~6×104cells/cm2之间,否则会导致官腔形成数量过少、增厚或者细胞成片铺展等问题。
综上所述,我们建立了一种简单有效,可重复性高的PMVECs原代培养方法,并成功构建其体外血管形成模型,为今后进一步研究PMVECs的特性与生理功能及其在相关疾病过程中的作用奠定了方法学基础。
[1]Duong HT,Erzurum SC,Asosingh K.Pro-angiogenic hematopoietic progenitor cells and endothelial colony-forming cells in pathological angiogenesis of bronchial and pulmonary circulation[J].Angiogenesis,2011,14(4):411 -422.
[2]Jaffe EA,Nachman RL,Becker CG,et al.Culture of human endothelial cells derived from umbilical veins.Identification by morphologic and immunologic criteria[J].J Clin Invest,1973,52(11):2745 -2756.
[3]赵 军,路 静,赵继敏,等.新生小鼠肺微血管内皮细胞的培养和抗原制备[J].第四军医大学学报,2008,29(20):1903 -1906.
[4]肖贞良,孙耕耘,钱桂生.肺循环灌注对大鼠肺微血管内皮细胞分离和培养的影响[J].中国病理生理杂志,1999,15(11):1053 -1054.
[5]Epstein H,Rabinovich L,Banai S,et al.Predicting in vivo efficacy of potential restenosis therapies by cell culture studies:species-dependent susceptibility of vascular smooth muscle cells[J].Open Cardiovasc Med J,2008,2:60-69.
[6]Arnaoutova I,Kleinman HK.In vitro angiogenesis:endothelial cell tube formation on gelled basement membrane extract[J].Nat Protoc,2010,5(4):628 - 635.

