环磷酸腺苷葡甲胺联合骨髓间充质干细胞移植治疗心力衰竭大鼠的研究*
周 荣,杨彩红,孙 焱,徐红娟,李彦红,姚 巍,王凤芝△
(山西医科大学1第二医院心内科,2药理学教研室,3信息管理系,山西 太原 030001;4山西中医学院中医系西医内科学教研室,山西 太原 030024)
骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)因其具有向心肌细胞分化的潜能、取材方便和免疫排斥反应少的特点备受研究者青睐[1]。近几年来各国的研究者已成功进行了BMSCs移植的动物实验,极大地推动了早期非随机干细胞移植临床试验的进行,但临床试验结果却大相径庭。造成这种结果的原因之一是BMSCs中细胞类型鱼目混珠,其中能正在发挥治疗作用的干细胞数量较少且多变,致使植入细胞存活数量少,分化率低。因此,探求一种能应用于人体的、无毒的、提高移植细胞存活率,促进移植细胞向心肌细胞分化的方法,一直是干细胞移植治疗心脏病的研究热点。
环磷酸腺苷(3',5'-cyclic adenosine monophosphate,cAMP)主要通过cAMP/PKA信号转导通路发挥作用。研究发现这条通路的激活能提高与心肌分化相关的基因如转录因子GATA-4、Cx43等的表达[2]。因此我们设想细胞内 cAMP水平的升高,有助于干细胞向心肌细胞分化。为此我们选用环磷酸腺苷葡甲胺(meglumine cycle adenylate phosphate,MCA,一种环磷酸腺苷类似物)加入BMSCs培养液中,测定到细胞内cAMP水平升高,心肌特异性蛋白GATA-4、β-肌球蛋白重链(β-myosin heavy chain,β-MHC)和缝隙连接蛋白43(connexin 43,Cx43)的表达有所增加,表明MCA有促进BMSCs向心肌细胞分化的作用[3]。因此本研究建立心力衰竭(heart failure,HF)模型,在移植BMSCs的同时给予MCA,研究二者联合对心力衰竭大鼠心功能的影响,以及移植细胞在心肌组织的存活和心肌特异性蛋白的表达情况,为BMSCs治疗心力衰竭寻找一种新思路和新靶点。
材料和方法
1 材料
健康Wistar远交群大鼠,6~7周龄雄鼠,体重200~220 g左右,由山西医科大学实验动物中心提供。MCA购自江苏万邦生化医药股份有限公司;阿霉素购自浙江海门药业有限公司;5-溴脱氧尿嘧啶(5-bromo-2'-deoxyuridine,BrdU)购自 Sigma;大鼠脑利钠肽(brain natriuretic peptide,BNP)ELISA试剂盒购自上海麦莎生物科技有限公司;小鼠抗大鼠BrdU IgG、兔抗大鼠GATA-4 IgG、心肌肌钙蛋白I(cardiac troponin I,cTnI)IgG和Cx43 IgG抗体均购自Santa Cruz。免疫组化试剂盒购自北京中杉金桥生物技术有限公司。
2 方法
2.1 BMSCs的分离、扩增培养及标记 将大鼠断颈处死,用75%乙醇浸泡10 min,无菌取双侧股、胫骨,暴露骨骼端,接装有PBS的注射器,反复冲出骨髓至骨体变白。冲出的骨髓吹打成细胞悬液后,以1500 r/min离心10 min后,弃去上清,在沉淀中加入适量DMEM培养液,吹打成细胞悬液并接种于培养瓶中进行培养。72 h首次换液,以后每2~3 d换液1次。待细胞长满瓶底的80%以上时,用0.25%胰酶消化,按1∶2或1∶3比例传代,相差显微镜逐天观察细胞形态。取第4代已纯化细胞进行移植前标记细胞:在移植前的2 d,将细胞接种到25 mm培养皿,达到60%融合时,加入BrdU使其终浓度为10 μmol/L,孵育48 h,弃去培养液。消化、离心收集细胞,冰上保存备移植用。
2.2 阿霉素性心肌病心力衰竭大鼠模型的建立 参照Siveski-Iliskovic等[4]和本课题组摸索的方法建立模型。阿霉素使用剂量按每次2.5 mg/kg,腹腔注射,每周3次,用1周,间隔2周,再用1周,共计6次,总剂量达15 mg/kg。末次注射完成后,观察4周。
2.3 实验分组 (1)正常组:正常健康大鼠,无任何处理。(2)HF组:模型鼠,尾静脉注射等量生理盐水。(3)BMSCs组:尾静脉注射 BMSCs 100 μL,大约107个细胞。(4)MCA组:尾静脉注射MCA注射液(6.25 mg·kg-1·d-1),连续 5 d。(5)BMSCs+MCA组:尾静脉注射等量BMSCs 1次,同时注射等量MCA连续5 d。以上各组给予相应处理后观察4周,检测相关指标。
2.4 超声心动图检查 干预4周后,进行经胸高频超声心动图检查。使用GE Vivid 7彩色超声显像仪,经胸壁高频超声10S探头,频率11.4 MHz,图像深度2.0 cm。20%乌拉坦800 mg/kg腹腔注射麻醉大鼠,在二维超声引导下,M型超声测定左室收缩末期 内 径 (left ventricular end-systolic diameter,LVSD)、左室舒张末期内径(left ventricular end-diastolic diameter,LVDD)、左室收缩末容积(left ventricular end-systolic volume,LVSV)和左室舒张末容积(left ventricular end-diastolic volume,LVDV),每一测定值均取3个连续完整心动周期测量,取其平均值。经Simpson法换算左室射血分数(left ventricular ejection fraction,LVEF)及左室短轴缩短率(left ventricular fractional shortening,LVFS)。
2.5 多导生理仪测定心功能 干预4周后麻醉大鼠,分离右侧颈总动脉,插导管至左心室。多导生理记录仪记录左室收缩压(left ventricular systolic pressure,LVSP)、左室舒张压(left ventricular diastolic pressure,LVDP)、心率(heart rate,HR)及左室压力上升及下降最大变化速率(±dp/dtmax)。连续测取5次数据,每次隔3 min,每一数据由3次较稳定数据求平均值作为结果。
2.6 血清BNP测定 各组在干预前和干预4周后,取清晨空腹尾静脉血,离心后取血清。参照说明书方法,采用双抗夹心ELISA法测定血清BNP水平。
2.7 标记细胞的存活数量 干预4周后取BMSCs组和MCA+BMSCs组,处死动物后立即开胸,取出心脏,PBS液冲洗,甲醛固定,血清封闭。滴加I抗小鼠抗大鼠BrdU(1∶200),4℃过夜;滴加II抗山羊抗小鼠IgG,37℃孵育20 min,PBS冲洗。采用DAB显色,显微镜下观察移植细胞的存活及分布。每个样本切片选取5个高倍视野(×400)计数阳性细胞数,取其平均值为阳性细胞数。
2.8 Western blotting测定心肌特异性蛋白表达 干预4周后,处死动物后立即开胸,取出心脏,PBS液冲洗,准确称取左心室一定量的心肌组织,按照1 mg组织加入10 μL细胞裂解液比例制备组织匀浆,并以10000 r/min、4℃离心10 min。取组织上清备用。采用Westren blotting方法测定组织样品心肌特异性蛋白的表达:I抗分别为 cTnI(1∶300稀释);Cx43(1∶300 稀释);GATA-4(1∶200 稀释)。
2.9 Masson染色 干预4周后,取左心室心肌组织,按标准的病理技术行甲醛固定、石蜡包埋、切片,行Masson染色。
3 统计学处理
结 果
1 动物存活情况
40只大鼠进行造模,其中4只无症状突然死亡,2只出现大量腹水而死亡,共死亡6只,存活34只。对大鼠造模前后行超声心动图测定,结果为造模后LVDD和LVSD较造模前有显著差异 [(6.52±0.76)mm vs(4.18±0.21)mm,(3.81±0.76)mm vs(1.10±0.15)mm,P <0.05],造模前LVEF和LVFS与造模后相比有显著差异[(75.34±8.45)%vs(94.51±2.61)%,(41.28±1.93)%vs(73.68±1.87)%,P<0.05]。以LVEF和LVFS较正常参考值下降20%~30%作为心衰模型建立的标准,有5只大鼠的心室腔无明显扩大,LVEF降低不明显,故排除。最后达心衰标准的有29只模型鼠,且这29只模型鼠在整个实验过程中全部存活,见图1。
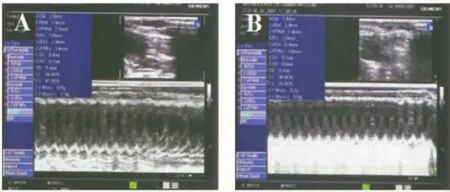
Figure 1.M-mode echocardiography.A:normal rats;B:heart failure rats.图1 造模前和造模成功后大鼠心脏超声M型图
2 干预4周后心功能比较
HF组的心脏超声结果为典型的心肌病心衰表现,LVSD及LVDD显著增大,LVFS及LVEF显著降低,表明左心功能明显降低。与HF组相比,LVSD、LVDD、LVEF和LVFS在BMSCs组、BMSCs+MCA组和MCA组均有显著差异(P<0.05),说明这3组的左心功能较HF组均有改善。其中BMSCs+MCA组在改善收缩功能方面最佳,与MSC组和MCA组相比均有显著差异(P<0.05);BMSCs组与MCA组相比差异无统计学意义(P>0.05),见表1。
表1 心脏超声显示干预4周后心衰大鼠的心功能变化Table 1.Cardiac functions of rats with heart failure analyzed by echocardiography 4 weeks after injection()

表1 心脏超声显示干预4周后心衰大鼠的心功能变化Table 1.Cardiac functions of rats with heart failure analyzed by echocardiography 4 weeks after injection()
△P<0.05 vs normal group;*P<0.05 vs HF group;#P<0.05 vs MCA gruop;▲P<0.05 vs BMSCs group.
Group n LVDD(mm) LVSD(mm) LVEF(%) LVFS(%)Normal 6 4.21±0.11 1.05±0.24 72.12±1.25 42.14±1.64 HF 6 6.95±0.44△ 4.19±0.15△ 47.45±7.34△ 20.19±1.03△BMSCs 8 5.67±0.74* 2.25±0.96*# 57.67±2.54*# 26.25±1.96*#BMSCs+MCA 8 5.34 ±0.84*# 2.12 ±0.09*# 64.34 ±4.34*#▲ 29.12 ±1.09*#▲MCA 7 6.19±0.62 3.34±0.42 56.67±3.22*24.34±1.42
3 干预4周后血流动力学情况
干预4周后血流动力学相关指标在各组间比较,均 P<0.05,差异显著。其中 MCA组、BMSCs组、BMSCs+MCA组与HF组相比,LVSP、±dp/dtmax明显升高,LVDP明显降低(P<0.01),提示心脏功能有改善。但与正常组相比还有差距(P<0.05)。其中BMSCs+MCA组±dp/dtmax较其它组明显好转(P<0.05);BMSCs组与MCA组相比差异无统计学意义(P >0.05),见表2。
表2 干预4周后心衰大鼠的血流动力学变化Table 2.Hemodynamic data of rats with heart failure 4 weeks after injection()
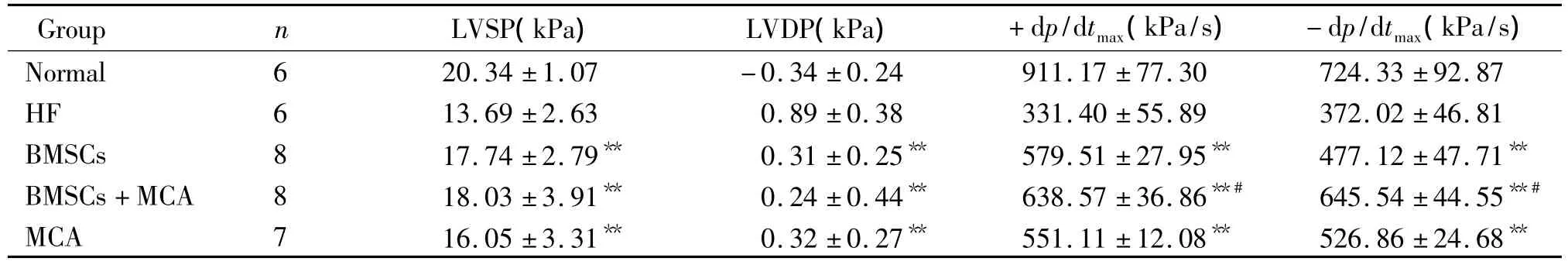
表2 干预4周后心衰大鼠的血流动力学变化Table 2.Hemodynamic data of rats with heart failure 4 weeks after injection()
**P <0.01 vs HF group or normal group;#P <0.05 vs MCA group or BMSCs group.
Group n LVSP(kPa) LVDP(kPa) +dp/dtmax(kPa/s) -dp/dtmax(kPa/s)Normal 6 20.34±1.07 -0.34±0.24 911.17±77.30724.33±92.87 HF 6 13.69±2.63 0.89±0.38 331.40±55.89 372.02±46.81 BMSCs 8 17.74 ±2.79** 0.31 ±0.25** 579.51 ±27.95** 477.12 ±47.71**BMSCs+MCA 8 18.03 ±3.91** 0.24 ±0.44** 638.57 ±36.86**# 645.54 ±44.55**#MCA 7 16.05±3.31** 0.32 ±0.27** 551.11 ±12.08** 526.86±24.68**
4 血清BNP水平变化
干预前各组BNP水平较正常组相比均有明显升高,均差异显著。在BMSCs组和MCA组和BMSCs+MCA组,干预后BNP水平与干预前比较明显下降(P<0.05);与HF组相比明显降低(P<0.05),与正常组相比仍有显著差异(P<0.05)。干预后BMSCs+MCA组BNP水平与BMSCs组和MCA组相比明显降低(P<0.05)。干预后BMSCs组BNP水平与MCA组相比无显著差异(P>0.05),见表4。
表3 干预前后各组血清BNP浓度变化Table 3.Serum BNP level 4 weeks after injection(ng/L.)
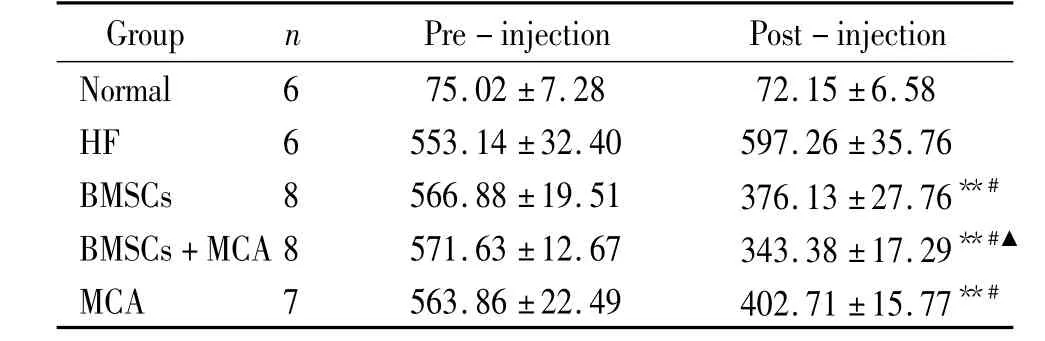
表3 干预前后各组血清BNP浓度变化Table 3.Serum BNP level 4 weeks after injection(ng/L.)
**P<0.01 vs HF group;#P <0.05 vs pre-injection;▲P <0.05 vs BMSCs group or MCA group.
Normal 6 75.02±7.28 72.15±6.58 HF 6 553.14±32.40 597.26±35.76 BMSCs 8 566.88 ±19.51 376.13 ±27.76**#BMSCs+MCA 8 571.63 ±12.67 343.38 ±17.29**#▲MCA 7 563.86 ±22.49 402.71 ±15.77**#
5 BMSCs在心肌组织的存活
干预4周后进行免疫组化染色观察BMSCs在心肌组织的存活,在2个行BMSCs移植的组皆可见BrdU阳性的细胞存在,多呈散在分布。对各组阳性细胞进行计数分析:BMSCs+MCA组的阳性细胞数多于 BMSCs组(P <0.05),见图2、表4。
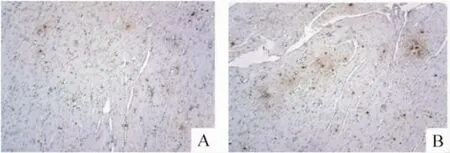
Figure 2.Immunohistochemical staining of BrdU-labeled cells 4 weeks after injection(×100).A:BMSCs group;B:BMSCs+MCA group.图2 干预4周后BrdU阳性细胞的免疫组化染色
表4 BrdU标记的阳性细胞数Table 4.The numbers of BrdU-labeled positive cells(.n=8)

表4 BrdU标记的阳性细胞数Table 4.The numbers of BrdU-labeled positive cells(.n=8)
**P <0.01 vs BMSCs group.
**BMSCs 13.50±5.15 BMSCs+MCA 29.75±7.67
6 心肌组织特异性蛋白表达情况
干预4周后测定心肌组织特异性蛋白表达可见,BMSCs组、BMSCs+MCA组与HF组、MCA组相比,GATA-4、cTnI和 Cx43蛋白表达量有所增加(P<0.05);与 BMSCs组相比,BMSCs+MCA组的GATA-4、Cx43和 cTnI的蛋白表达量较多(P<0.05);BMSCs组GATA-4表达量多于MCA组(P<0.05),见图3、表5。
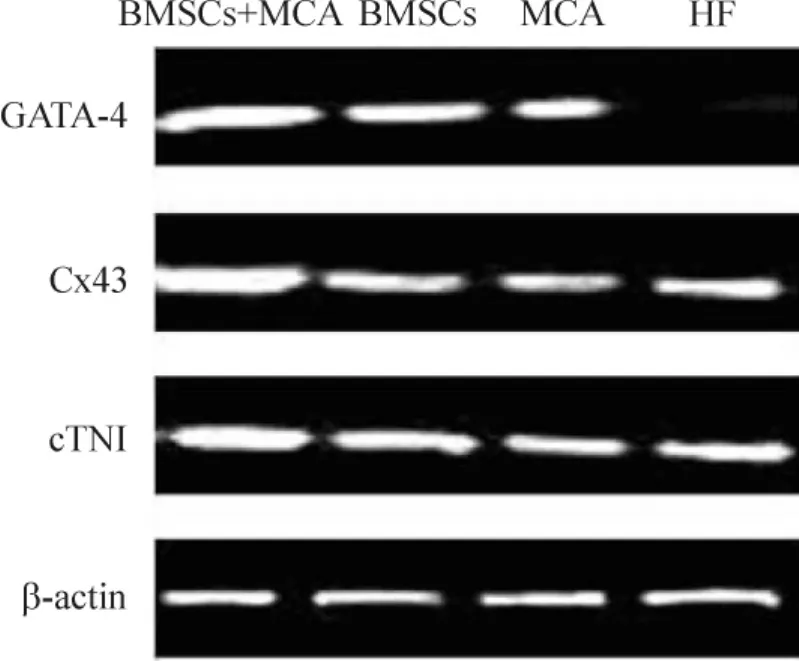
Figure 3.GATA-4,Cx43 and cTnI protein expression in rats detected by Western blotting.图3 各组心肌特异性蛋白的表达
表5 各组心肌特异性蛋白的相对表达量Table 5.Expression of GATA-4,Cx43 and cTNI proteins in rats 4 weeks after injection(.n=6)
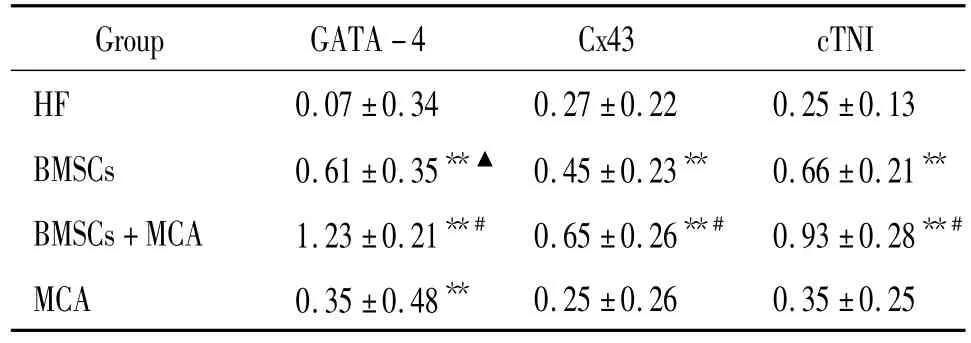
表5 各组心肌特异性蛋白的相对表达量Table 5.Expression of GATA-4,Cx43 and cTNI proteins in rats 4 weeks after injection(.n=6)
**P<0.01 vs HF group;#P <0.05 vs BMSCs group or MCA group;▲P <0.05 vs MCA group.
Group GATA-4 Cx43 cTNI 0.25±0.26 0.35±0.25 HF 0.07±0.34 0.27±0.22 0.25±0.13 BMSCs 0.61±0.35**▲ 0.45±0.23** 0.66±0.21**BMSCs+MCA 1.23 ±0.21**# 0.65 ±0.26**# 0.93 ±0.28**#MCA 0.35 ±0.48**
7 Masson结果
Masson染色后胶原纤维呈蓝色线状,心肌细胞呈红色,细胞核深蓝色。正常组可见少量间质纤维化;HF组可见间质纤维程度加重。各治疗组都还有纤维化存在,但较HF组有所减轻。各治疗组组间相比,BMSCs+MCA组纤维化程度最轻,BMSCs组纤维化程度较接近居中,MCA组纤维化程度最重,见图4。
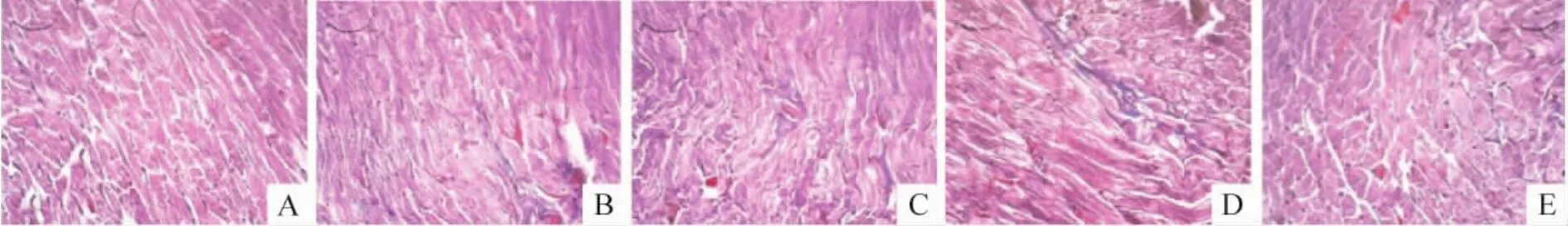
Figure 4.Myocardial fibrosis was measured by Masson staining(×100).A:normal group;B:HF group;C:MCA group;D:BMSCs group;E:BMSCs+MCA group.图4 各组心肌组织纤维化程度
讨 论
心肌细胞是心脏最基本的结构和功能单位,不论是什么类型的心脏疾病,它所引起的心脏功能的变化,从本质上说,都是心肌细胞的变性坏死造成的。针对心力衰竭传统的药物治疗只能缓解但并不能从根本上阻止病程的发展;而晚期心力衰竭的病人,心脏移植由于供体来源有限以及移植后产生较强免疫排斥反应的问题,并不能作为有效的治疗手段。进行细胞移植,用功能性心肌组织替代宿主受损心肌组织,恢复心脏功能是具有广泛应用前景的治疗策略。因此以挽救、修复和替代心肌细胞为目标的干细胞研究已成为心血管领域的研究热点[5]。大量研究表明移植细胞在心肌组织的低分布、低存活和低分化影响了治疗效果,尤其是长期疗效[6],因此研究者试图通过各种方法如提高细胞因子水平和改善微环境等方法提高移植效果[7]。
cAMP是体内重要的第二信使,参与细胞的代谢、生长、分化和凋亡等[8]。经典的cAMP主要是通过蛋白激酶A(protein kinase A,PKA)信号通路发挥作用。研究已证实cAMP/PKA信号转导通路有促进与心肌分化和建立功能相关的基因如GATA-4、Cx43等表达的作用。MCA为临床治疗心力衰竭的药物,是一种环磷酸腺苷类似物,通过与葡甲胺的结合,增强了cAMP的脂溶性,使其易于透过细胞膜,从而增加细胞内cAMP的浓度。我们选取LVEF下降大于20%~30%的大鼠为观察对象,以超声心动图、血流动力学和血清BNP作为心功能评价指标,结果表明BMSCs移植对心功能有所改善,但改善程度较低,与MCA药物治疗心力衰竭相比对心功能的影响没有差异,这种结果与国内外学者的研究结果一致[9-10]。而给予BMSCs移植联合MCA共同干预较单独移植细胞对心功能改善较为明显。研究表明在细胞移植的早期BMSCs主要分布于肺、肝等血流丰富的器官,随移植时间延长逐渐归巢到骨髓定居,2周时达到高峰,此后逐渐向损伤器官如骨骼肌、心肌等定向迁移,并且随时间延长分布增加[11]。本研究中采用免疫组织化学染色证实,BMSCs可在心肌组织存活,但数量较少。这与移植细胞的数量和观察时间短仅4周有关系。联合给予MCA后,可见BrdU阳性细胞有所增多。因此我们推测移植同时给予MCA能提高BMSCs在心肌组织的存活,这是BMSCs移植联合MCA较单独移植细胞能更好改善心功能的原因之一。
植入细胞能否再生为心肌细胞,是细胞移植研究中备受争议的问题。新近荟萃分析表明[12]:骨髓细胞移植治疗能使心肌梗死和心衰患者的心功能有改善作用,但硬性终点事件并未改善,远期疗效也有争议。目前虽然少数研究提示骨髓细胞有向心肌细胞分化的可能,但现在达成的共识是细胞移植的心功能获益可能来自于通过旁分泌机制促进血管生成、抗心肌凋亡等发挥作用,而不是通过分化为心肌细胞[13]。本研究观察到移植BMSCs后心肌组织能表达与心肌细胞分化密切相关的转录因子GATA-4,还观察到给予MCA处理的心衰大鼠也能少量表达GATA-4,这可能与心肌损伤后激活心脏自身干细胞并开始分裂有关。而BMSCs移植联合MCA二者共同干预后 GATA-4表达量明显高于单独BMSCs或MCA处理组,同时还发现Cx43、cTNI的表达量也明显高于其它各组。
以上这些研究结果是与MCA促进BMSCs向心肌细胞分化有关,还是与MCA促进BMSCs在心肌组织的存活从而使其发挥旁分泌作用有关需要进一步的研究。另外BMSCs和MCA联合作用的发挥是简单的1+1等于2的作用,还是1+1>2的作用也值得我们深入研究。
[1]Hatzistergos KE,Quevedo H,Oskouei BN,et al.Bone marrow mesenchymal stem cells stimulate cardiac stem cell proliferation and differentiation[J].Circ Res,2010,107(7):913-922.
[2]Tremblay JJ,Viger RS.Transcription factor GATA-4 is activated by phosphorylation of serine 261 via the cAMP/protein kinase A signaling pathway in gonadal cells[J].J Biol Chem,2003,278(24):22128-22135.
[3]周 荣,姚 巍,李彦红,等.环磷酸腺苷葡甲胺诱导骨髓间充质干细胞向心肌细胞分化的实验研究[J].中国病理生理杂志,2011,27(10):2040-2044.
[4]Siveski-lliskovic N,Hill M,Chow DA,et al.Probucol protects against adriamycin cardiomyopathy without interfering with its antitumor effect[J].Circulation,1995,91(1):10-15.
[5]Mummery CL,Davis RP,Kriegar JE.Challenges in using stem cells for cardiac repair[J].Sci Transl Med,2010,2(27):27ps17.
[6]Psaltis PJ,Zannettino AC,Worthley SG,et al.Concise review:mesenchymal stromal cells:potential for cardiovascular repair[J].Stem Cells,2008,26(9):2201-2210.
[7]曾 彬,林国生,张 艳,等.血红素氧合酶-1修饰的骨髓间充质干细胞心肌移植对梗死后心肌细胞凋亡及左心室功能的影响[J].中国病理生理杂志,2009,25(9):1681-1685.
[8]Propper DJ,Saunders MP,Salisbury AJ,et al.Phase I study of the novel cyclic AMP(cAMP)analogue 8-chloroc AMP in patients with cancer:toxicity,hormonal,and immunological effects[J].Clin Cancer Res,1999,5(7):1682-1689.
[9]林茂海,苏津自,许昌声.肾上腺髓质素基因转染增强骨髓间充质干细胞移植对心肌梗死大鼠心室重构及心功能的影响[J].中国病理生理杂志,2009,25(9):1692-1699.
[10]Nagaya N,Kangawa K,Itoh T,et al.Transplantation of mesenchymal stem cells improves cardiac function in a rat model of dilated cardiomyopathy[J].Circulation,2005,112(8):1128-1135.
[11]卢锡林,姚晓黎,冯善伟,等.骨髓间充质干细胞移植后在mdx鼠体内的分布研究[J].中国病理生理杂志,2008,24(4):763-766.
[12]Assmus B,Rolf A,Erbs S,et al.Clinical outcome 2 years after intracoronary administration of bone marrowderived progenitor cells in acute myocardial infarction[J].Circ Heart Fail,2010,3(1):89-96.
[13]Schäfer R,Northoff H.Cardioprotection and cardiac regeneration by mesenchymal stem cells[J].Panminerva Med,2008,50(1):31-39.

