ACE/ACE2在AGT-REN双转基因高血压小鼠肾组织的表达变化及意义*
刘英超,王银环,耿 菲,王建军,王建辉,张 伟,杨秀红,△,秦 川
(河北联合大学基础医学院1生理教研室,2机能实验室,河北 唐山 063000;3中国医学科学院实验动物研究所,北京 100021)
目前多数学者认为高血压是一种多基因遗传性疾病,严重时可伴有肾损伤。研究发现,肾素-血管紧张素系统(renin-angiotensin system,RAS)在高血压的发生发展过程中发挥着重要作用[1]。传统观点认为,由血管紧张素Ⅰ(angiotensinⅠ,AngⅠ)、血管紧张素转化酶(angiotensin-converting enzyme,ACE)、血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)以及血管紧张素II 1型受体(AT1R)组成的缩血管通路是RAS的主要组成成分。ACE可分解AngⅠ生成AngⅡ,AngⅡ与AT1R结合,具有促进细胞增殖、增加水钠潴留、强烈收缩血管等作用。ACE催化的缩血管、通路过度激活参与了高血压的发生发展,然而ACE抑制剂对高血压的治疗效果文献报道不一[2]。近年来,随着血管紧张素转化酶2(angiotensin-converting enzyme 2,ACE2)的发现及深入研究[3-4],人们认识到RAS中还存在着另外一条舒血管通路,即AngⅡ-ACE2-Ang(1-7)-Mas受体这一通路。ACE2分解AngⅡ,生成 Ang(1-7),Ang(1-7)与 Mas受体结合,具有抗增殖、调节水电解质平衡、舒张血管、降低血压等作用。有文献报道称,高血压的发生发展也与ACE2催化的舒血管通路活性降低有关[5]。本文研究了ACE/ACE2在血管紧张素原(angiotensinogen,AGT)-肾素(renin,REN)双转基因高血压小鼠肾组织中的表达变化,进而探讨RAS稳态失衡在高血压发病和肾组织损伤中的意义。
材料和方法
1 材料
1.1 动物 实验分为4组,随机选取野生型(wild type,WT)小鼠、AGT转基因小鼠、REN转基因小鼠以及AGT-REN双转基因小鼠各6只,均为雄性C57小鼠,10月龄。其中AGT转基因小鼠和REN转基因小鼠由中国医学科学院实验动物研究所提供。2种转基因小鼠分别是利用人AGT基因和REN基因启动子构建重组质粒,经酶切、纯化获得目的基因,通过显微注射方法建立的人AGT转基因小鼠和人REN转基因小鼠。AGT-REN双转基因小鼠由AGT、REN转基因小鼠交配繁殖所得。所有动物均在河北联合大学实验动物中心清洁级动物房饲养繁殖。
1.2 主要仪器 BL-420系统(成都泰盟科技有限公司);酶标仪(Model 680,Bio-Rad);电泳仪(ECP3000,北京六一仪器厂);BI2000医学图像分析系统(成都泰盟科技有限公司);光学显微镜(Olympus)。
1.3 主要试剂 β-Actin和 ACE2抗体购自Abcam,ACE抗体购自Santa Cruz;免疫组化II抗购自北京中杉金桥生物技术公司;RIPA蛋白裂解液、BCA蛋白浓度测定试剂盒、Western封闭液、Western抗兔Ⅱ抗、ECL发光剂以及显影定影剂均购于上海碧云天生物技术研究所。其余试剂均为国产分析纯。
2 方法
2.1 颈总动脉插管测血压 10%水合氯醛按3 mL/kg腹腔注射麻醉小鼠后,将其固定在鼠板上,切开颈部皮肤,分离组织,找到并分离颈总动脉,进行插管。插管成功后,开启BL-420系统,进行血压监测1 h。
2.2 HE染色观察肾组织病理改变 成功监测血压后,颈动脉放血处死小鼠,迅速取出左侧肾脏置于10%甲醛中固定。之后常规方法脱水、包埋、切片、HE染色,显微镜下观察。
2.3 免疫组化观察肾组织ACE/ACE2表达 将肾组织石蜡切片常规二甲苯脱蜡、梯度乙醇水化后,3%过氧化氢室温下孵育10 min,枸橼酸缓冲液中高温修复2~3 min,自然冷却至室温。滴加Ⅰ抗,37℃孵育1.5 h,PBS冲洗5 min×3次,加入Ⅱ抗试剂Ⅰ37℃孵育15 min,PBS冲洗5 min×3次,加入Ⅱ抗试剂Ⅱ37℃孵育15 min,PBS冲洗5 min×3次,DAB显色,脱水、透明、封片,显微镜下观察。利用 BI2000医学图像分析系统进行分析,测定吸光度值,进行统计分析。
2.4 Western blotting观察肾组织ACE/ACE2表达右侧肾脏取出后,称取100 mg放入装有RIPA裂解液的玻璃匀浆器中研磨,离心后取上清测定蛋白浓度。SDS-PAGE电泳分离蛋白后,转至NC膜上。Western封闭液封闭2 h后分别加入兔抗ACE2、βactinⅠ抗(Abcam,1∶1000 稀释)以及ACEⅠ抗(Santa Cruz,1∶200),4 ℃孵育过夜。TBST 清洗后,加入羊抗兔Ⅱ抗(碧云天公司,1∶5000稀释),室温孵育30 min。TBST清洗后,滴加ECL发光剂,进入暗室曝光、显影、定影。实验结果采集之后,利用ImageJ图像处理软件对条带进行分析,测定灰度值,以各组蛋白所得灰度值与β-actin灰度值的比值作为最终结果,进行统计分析。
3 统计学处理
采用SPSS 13.0软件分析实验数据。数据以均数±标准差()表示。组间比较应用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 血压检测结果
观察小鼠动脉插管后20 min、40 min、60 min平均动脉压(mean arterial pressure,MAP)及脉压差(pulse pressure,PP)值。结果显示:AGT转基因小鼠与野生小鼠相比,MAP无明显差异(P>0.05);REN转基因小鼠与野生小鼠相比,MAP降低约15 mmHg(P<0.05);AGT-REN双转基因小鼠与其它3组比较,MAP明显升高约 30 mmHg(P <0.05)。AGT、REN转基因以及AGT-REN双转基因小鼠PP值与野生小鼠相比均明显升高(P<0.05),见表1。
表1 不同基因型小鼠血压测定结果Table 1.The results of blood pressure in different transgenic mice(mmHg..n=6)

表1 不同基因型小鼠血压测定结果Table 1.The results of blood pressure in different transgenic mice(mmHg..n=6)
*P <0.05 vs other groups;△P <0.05 vs WT mice.
WT 73.81 ±9.68 3.19 ±0.56 77.03 ±9.30 2.91 ±0.30 73.14 ±8.38 3.24 ±0.56 AGT 72.00 ±8.65 7.96 ±2.73△ 70.66 ±9.24 8.32 ±3.23△ 70.15 ±9.25 8.43 ±2.75△REN 61.63 ±7.53△ 6.91 ±2.91△ 57.51 ±10.76△ 7.45 ±2.23△ 56.07 ±9.56△ 7.65 ±3.04△AGT -REN 112.05 ±9.29* 9.20 ±2.64△ 106.66 ±10.24* 8.81 ±3.14△ 104.38 ±10.77* 8.97 ±1.68△
2 HE染色结果
HE染色结果显示:与野生小鼠相比,AGT和REN转基因小鼠肾组织均未见明显病理改变(因与野生小鼠相比无显著差异,图片未提供);而AGTREN双转基因小鼠肾组织可见肾小动脉呈增生性内膜炎改变,内膜显著增厚,管腔狭窄,管壁增厚,纤维素样坏死,肾小球纤维化、玻璃样变,肾小管代偿性扩张,可见大量透明管型。肾组织出现了典型的恶性高血压肾损伤病理表现,见图1。

Figure 1.The pathological changes of the kidneys(HE staining,×100).A:WT mice;B:AGT -REN mice.图1 肾脏HE染色结果
3 免疫组化染色结果
免疫组化染色结果显示,ACE主要表达于肾小管上皮细胞胞浆中,ACE2主要表达于肾组织近端肾小管上皮细胞的管腔膜。图像分析结果显示,与野生小鼠相比较,AGT和REN转基因鼠肾组织ACE和ACE2表达无明显变化(P>0.05);AGT-REN双转基因高血压小鼠肾组织中ACE的表达显著升高,ACE2表达明显降低(P <0.05),见图2~4。
4 Western blotting结果
Western blotting结果显示,与野生小鼠相比,AGT转基因鼠肾组织ACE和ACE2表达变化无明显差异;REN转基因鼠肾组织ACE表达变化差异不显著,ACE2表达降低(P<0.05);AGT-REN双转基因鼠ACE表达明显升高,ACE2表达显著降低,见图5A。与野生小鼠相比,AGT-REN双转基因鼠肾组织ACE/ACE2比值明显升高,表达失衡(P<0.01),见图5B。

Figure 2.The results of immunohistochemical staining for ACE in kidneys(×200).A:WT mice;B:AGT mice;C:REN mice;D:AGT -REN mice.图2 ACE免疫组化染色结果

Figure 3.The results of immunohistochemical staining for ACE2 in kidneys(×100).A:WT mice;B:AGT mice;C:REN mice;D:AGT-REN mice.图3 ACE2免疫组化染色结果
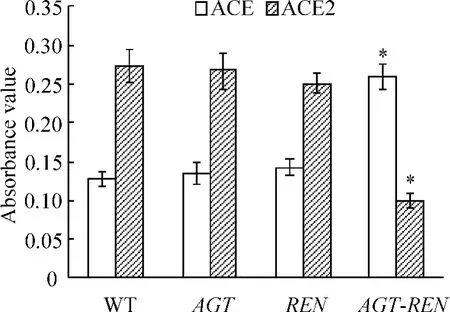
Figure 4.The results of mean absorbance values(by immunohistochemistry)of ACE and ACE2.*P < 0.05 vs WT mice.图4 ACE和ACE2免疫组化吸光度值分析结果
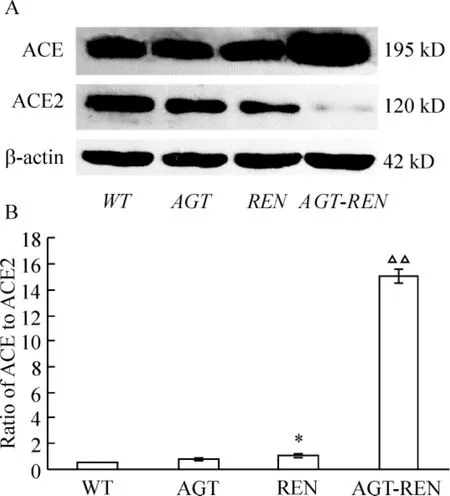
Figure 5.Western blotting analysis of ACE and ACE2 protein expression in kidney tissues of different mice.A:the expression of ACE and ACE2 in kidneys;B:the ratio of ACE to ACE2 calculated by ImageJ.*P < 0.05 vs WT and AGT mice;△△P <0.01 vs other groups.图5 Western blotting检测ACE和ACE2蛋白表达结果
讨 论
基础和临床研究均表明,原发性高血压是一种多基因遗传性疾病,其中RAS的基因与高血压的发生关系最为密切,它们在正常血压的调控和高血压的发病中发挥非常重要的作用。ACE和ACE2是RAS中重要的组成成分,以往人们只是认为ACE在血压调节中发挥了重要作用,但随着ACE2的发现和深入研究,人们认识到ACE2不仅对血压调节发挥了重要的作用,而且对高血压造成的靶器官损害具有保护作用[6]。
本实验中AGT和REN单转基因小鼠并未见血压升高,而AGT-REN双转基因小鼠可见血压明显升高,其原因可能为人血管紧张素原或肾素不能与小鼠内源性的RAS系统发生酶促反应,即人的肾素不能水解小鼠的血管紧张素原,小鼠的肾素不能水解人的血管紧张素原,而肾素催化血管紧张素原的反应是整个 RAS系统中酶促反应的限速步骤[7]。AGT-REN双转基因小鼠体内同时含有人AGT和REN基因,使其血浆及组织中AngⅡ水平显著升高[8-9],引起严重的高血压。有文献报道,AngⅡ水平升高可上调ACE的表达,并且下调ACE2的表达[10],本实验免疫组化结果和Western blotting均显示AGT-REN双转基因小鼠肾组织中ACE表达升高,ACE2表达明显降低,ACE/ACE2表达显著失衡。ACE具有强烈的缩血管以及促进细胞增殖的作用,双转基因小鼠肾组织中其高表达,可能与肾组织内膜增生、管壁增厚、管腔狭窄等病理改变的形成密切相关;而具有抗增殖作用的ACE2肾组织内低表达,也从另一方面促进了ACE的增殖作用。简言之,AGT-REN双转基因小鼠肾组织内ACE/ACE2表达失衡可能是造成其出现典型高血压病理改变的主要原因。本实验中另外有趣的发现是REN转基因小鼠血压不但没有升高,反而下降,推测可能是人REN基因的随机插入影响了血压调控位点所致;单转基因和双转基因小鼠的脉压差均高于野生型小鼠,可能由于血管弹性降低所致,其机制有待进一步研究。
RAS中,ACE/ACE2两条通路参与了血压的调节。ACE-AngⅡ-AT1R通路收缩血管升高血压,造成组织损伤,其机制可能为:(1)强烈的缩血管作用;(2)增加水钠潴留;(3)增强心肌收缩力,引起心肌纤维化和心肌肥厚;(4)促进细胞增殖,造成组织损伤。ACE2-Ang(1-7)-Mas通路舒张血管降低血压,在对抗高血压疾病的发生发展过程中发挥着关键作用[11]。目前认为,ACE2调节血压的作用机制主要有以下几个方面:(1)分解AngⅡ减弱其升压作用,并且还可竞争ACE的底物AngⅠ,减少AngⅡ生成;(2)促进Ang(1-7)生成,舒张血管降低血压;(3)增加一氧化氮(NO)的释放[NO是强烈的舒血管物质,AngⅡ减少可降低NO消耗,Ang(1-7)增多可以促进NO的生成[12]];(4)调节其它血管活性多肽系统。ACE2不仅在血压调节过程中发挥着重要作用,而且对高血压造成的靶器官损伤也起着保护作用。Huentelman等[13]研究发现,ACE2的主要产物Ang(1-7)能够拮抗AngⅡ的作用,抑制心肌重构,防止心肌纤维化,对心肌损伤起到保护作用。关于ACE2对高血压肾损伤起到保护作用的文献尚未见报道,但高血压肾损伤的产生可能是由于AngⅡ大量生成,ACE2水平降低造成的,提高ACE2的活性或者促进ACE2的生成,肾脏损伤情况应有所改善。
目前,ACE 抑制剂(ACE inhibitors,ACEI)类药物已广泛用于临床并取得良好效果。Ferrario等[14]研究发现,给予高血压大鼠ACEI类药物后,在血压下降的同时,心肌ACE2 mRNA水平升高,心肌损伤程度减轻。这提示降低ACE活性,提升ACE2表达水平,促进ACE/ACE2平衡调节,可能是ACEI类药物治疗高血压的作用机制之一。另一方面,体外给予高血压患者ACE2类药物或者促进ACE2体内合成,进而调节ACE/ACE2表达平衡,也能起到降低血压的效果。Wysocki等[15]也已研究证明,体外给予AngⅡ升高造成的高血压鼠人重组ACE2蛋白后,可显著降低血清AngⅡ水平,起到降低血压的效果。由此可见,ACE2作为抑制高血压和对靶器官损伤发挥保护作用的重要物质,将会为防治高血压和其它相关疾病带来新的希望。
[1]Unger T.The role of the renin-angiotensin system in the development of cardiovascular disease[J].Am J Cardiol,2002,89(2A):3A-9A.
[2]吴素芳,杨少辉,于晓静.血管紧张素转化酶抑制剂的应用与评价[J].中国医刊,2007,42(1):65-67.
[3]Donoghue M,Hsieh F,Baronas E,et al.A novel angiotensin-coverting enzyme related carboxypeptidase(ACE2)converts angiotensin I to angiotensin 1 - 9[J].Circ Res,2000,87(5):E1-E9.
[4]Tipnis SR,Hooper NM,Hyde R,et al.A human homolog of angiotensin converting- enzyme.Cloning and functional expression as a captopril-insensitive carboxypeptidase[J].J Biol Chem,2000,275(43):33238-33243.
[5]李兰芳,李 峰,朱炳阳,等.双肾双夹易卒中型肾血管性高血压大鼠重要靶器官ACE2表达研究[J].中国病理生理杂志,2007,23(5):904-907.
[6]Díez- Freire C,Vázquez J,Correa de Adjounian MF,et al.ACE2 gene transfer attenuates hypertension-linked pathophysiological changes in the SHR[J].Physiol Genomics,2006,27(1):12 -19.
[7]Fukamizu A,Sugimura K,Takimoto E,et al.Chimeric RENin-angiotensin system demonstrates sustained increase in blood pressure of transgenic mice carrying both human renin and angiotensinogen genes[J].J Biol Chem,1993,268(16):11617-11621.
[8]Inaba S,Iwai M,Tomono Y,et al.Exaggeration of focal cerebral ischemia in transgenic mice carrying human renin and human angiotensinogen genes[J].Stroke,2009,40(2):597-603.
[9]Kai T,Shimada S,Kurooka A,et al.Tissue angiotensin II concentration in the heart and kidneys in transgenic Tsukuba hypertensive mice[J].Blood Press,1998,7(1):61-63.
[10]Koka V,Huang XR,Chung AC,et al.Angiotensin II up-regulates angiotensin I-converting enzyme(ACE),but down-regulates ACE2 via the AT1-ERK/p38 MAP kinase pathway[J].Am J Pathol,2008,172(5):1174 -1183.
[11]Yagil Y,Yagil C.Hypothesis:ACE2 modulates blood pressure in the mammalian organism[J].Hypertension,2003,41(4):871-873.
[12]Zhong JC,Huang DY,Yang YM,et al.Upregulation of angiotensin-converting enzyme 2 by all-trans retinoic acid in spontaneously hypertensive rats[J].Hypertension,2004,44(6):907-912.
[13]Huentelman MJ,Grobe JL,Vazquez J,et al.Protection from angiotensin II-induced cardiac hypertrophy and fibrosis by systemic lentiviral delivery of ACE2 in rats[J].Exp Physiol,2005,90(5):783 -790.
[14]Ferrario CM,Jessup J,Chappell MC,et al.Effect of angiotensin-converting enzyme inhibition and angiotensin II receptor blockers on cardiac angiotensin-converting enzyme 2[J].Circulation,2005,111(20):2605 -2610.
[15]Wysocki J,Ye M,Rodriguez E,et al.Targeting the degradation of angiotensin II with recombinant angiotensinconverting enzyme 2:prevention of angiotensin II-dependent hypertension[J].Hypertension,2010,55(1):90-98.

