非肌肉肌球蛋白Ⅱ研究进展
张洪峰,彭 军
(中南大学药学院药理学系,湖南长沙 410078)
肌球蛋白是一超家族蛋白质,目前至少发现了25种,它们的结构和功能各不相同。研究最多的是肌球蛋白Ⅱ,它和肌动蛋白一起构成了心肌、骨骼肌和平滑肌的主要收缩蛋白。非肌肉细胞中也存在肌球蛋白 Ⅱ,称为非肌肉肌球蛋白Ⅱ(non-muscle myosinⅡ,NMⅡ)。作为一种分子马达(molecular motor),NMⅡ通过与ATP水解偶联,为细胞中各种成分的运动及分子间的相互作用提供动力。近年研究表明,NMⅡ除了为细胞内分子运动提供动力外,也参与了细胞的各种生理活动,如细胞迁移、黏附、胞质分裂、囊泡转移、细胞吞饮和基因转录等。
1 NMⅡ的生物学特性
1.1 NMⅡ结构与功能 像肌肉中肌球蛋白一样,NMⅡ是由3对多肽组成:两条分子量为230 ku的重链(NMHC),两条20 ku的调节轻链(MLC20)和两条17 ku的必需轻链(MLC17)。根据NMHC不同可将NM Ⅱ分为NM Ⅱ-A、B、C 3个亚型。在人类它们分别被3个不同的基因——肌球蛋白重链(MYH)9、MYH 10和 MYH 14编码[2]。用胰蛋白酶处理肌球蛋白分子,可产生带有两个头部和足够长度杆部的区段称为重酶解肌球蛋白(HMM)。HMM经木瓜蛋白酶处理,形成肌球蛋白头部(S1)和杆部(Fig 1)。NMⅡ具有多种功能:在氨基端的2个球状马达区域能与肌动蛋白结合并水解MgATP;杆状螺旋区域对肌动蛋白丝的组装有重要作用;在非螺旋尾部(non-helical tail,NHT),不同NM Ⅱ亚型中氨基酸序列也不同,包含很多可被PKC和酪氨酸激酶磷酸化位点。
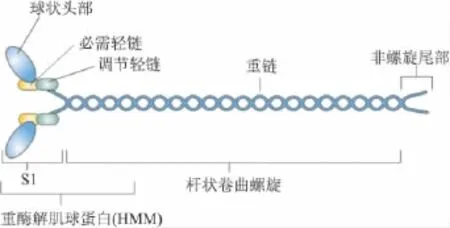
Fig 1 Schematic diagram for the structure of non-muscle myosinⅡ
1.2 NMⅡ的活性调节 NMⅡ有两个磷酸化区域:MLC20和NMHC。激活NMⅡ过程中重要的一步就是MLC20位点Ser19的磷酸化,Ser19的磷酸化影响MgATPase的活性和肌动蛋白丝的组装,MLC20位点Thr18磷酸化水平升高会进一步增强MgATPase的活性。去磷酸化的NMⅡ会通过分子头部和尾部的相互作用折叠成紧凑的结构,阻断肌球蛋白丝的组装。许多激酶如肌球蛋白轻链激酶(MLCK)、Rho激酶(ROCK)、Zipper相互作用蛋白激酶(ZIPK)等可通过磷酸化激活MLC20。在NMHC的羧基端的螺旋区段和非螺旋的尾部也存在磷酸化位点,这些位点可被CKⅡ、TRPM7和PKC等激酶磷酸化。CKⅡ能作用NMHC非螺旋尾部的Ser1943位点,而TRPM7则能磷酸化NMⅡB和NMⅡC螺旋区域和非螺旋尾部的位点[3-4]。
2 NMⅡ与细胞迁移
NMⅡ对黏着斑的生长分布、细胞伪足的形成和微管的稳定性有重要作用。分别用低浓度的NMⅡATP酶抑制剂blebbistatin和NMⅡ激活剂calyculin A处理细胞,发现这些处理并不改变NMⅡ的分布,而是影响NMⅡ的活动。被blebbistatin处理过的细胞比正常细胞形成更小的、致密度低的黏着斑,而被calyculin A处理的细胞却发现更大的、更致密的黏着斑,提示增加NMⅡ的收缩能力可以促进黏着斑的生长和分布[5]。有NMⅡ-A缺陷的细胞会阻碍黏着斑的形成、细胞收缩、应力纤维组织和细胞尾部的回缩。这种缺陷细胞的无定向迁移速度增加了2~3倍,呈现异常大的板状伪足,伴随广泛无极性的细胞起皱,这是由于NMⅡ-A的缺失增强了微管在细胞边缘伪足中的聚集,使膜广泛起皱和移动速度增加,说明NMⅡ-A能调节细胞收缩并维持微管和肌动球蛋白间的平衡,负性调节膜起皱和细胞的移动[6]。对细胞迁移能力和突起伸展的负性调节现象同样也存在NMⅡ-B 缺失的细胞[7]。
NMⅡ在肿瘤细胞浸润、转移中发挥重要作用。溶血磷脂酸(LPA)与肿瘤的生长、浸润和转移密切相关。Kim等[8]证实LPA可激活LPA1受体,该受体可促进MLC20磷酸化导致肿瘤细胞的迁移。LPA诱导的肿瘤细胞的迁移可被blebbistatin或沉默NMⅡ的表达所抑制,增加NMⅡ的表达则恢复细胞的迁移能力。P-钙黏蛋白在黑色素瘤的转移中发挥重要作用,抑制NMⅡ-B活性也可促进P-钙黏蛋白对黑色素瘤的转移的抑制作用[9]。
3 NMⅡ与细胞黏附
NMⅡ可通过调节钙黏素参与上皮细胞黏附、细胞连接等。NMⅡ对钙黏素定位和聚集必需的。Shewan等[10]在Mcf7乳腺癌细胞和中国仓鼠卵巢细胞证明NMⅡ和钙黏素存在相互作用,这种作用被NMⅡ活性抑制剂减弱,在有E-钙黏素的细胞连接里发现存在NMⅡ,它的募集需要E-钙黏素的活性。用blebbistatin或ML-7抑制NMⅡ的活性,会很快削弱细胞连接处聚集E-钙黏素的能力,伴有细胞黏附能力下降。Conti等[11]将小鼠胚胎干细胞中的NMⅡ-A剔除后,发现细胞间黏附缺失,小鼠在E6.5之前不能发育成正常内脏内胚层,并在E7.5死亡,这可能是由于E-钙黏素和β-连环蛋白不能够募集到细胞黏附位点引起的。
Miyake等[12]发现ROCK和NM Ⅱ ATPase抑制剂阻断细胞黏着连接组分的聚集。剔除NMⅡ-B的基因会导致胚胎发育中神经上皮细胞黏附缺陷,有趣的是,这种缺陷可部分被马达蛋白受损的NMⅡ-B蛋白修复,提示NMⅡ-B在调控AJC的形成时主要起到结构性的作用[13]。新近发现幽门螺旋杆菌导致的胃黏膜屏障减弱与胃上皮细胞的NMⅡ活性有关,幽门螺旋杆菌感染可提高MLCK活性和促进MLC的磷酸化,使胃黏膜上皮细胞的紧密连接调节异常[14]。
4 NMⅡ与胞质分裂
NMⅡ影响纺锤丝的组装、定位。Blebbistatin或 Y-27362处理后,NMⅡ活性受到抑制,细胞染色体的分离被阻断,且纺锤体组装和定位受到干扰[15]。Matson等[16]首次证实在减数分裂的细胞中,MLCK抑制剂ML-7通过阻止纺锤体的旋转和收缩环的形成呈剂量依赖的抑制第二极体的形成。NMⅡ可影响胞质分裂时分裂沟的收缩。Blebbistatin可抑制分裂沟的收缩而不影响细胞分裂和收缩环的组装[17]。磷酸化的MLC20可促进NM Ⅱ的ATPase活性和NMⅡ的组装,MLC20去磷酸化后,HeLa细胞分裂减缓,这种现象可以被MLC20磷酸化逆转。在参与胞质分裂的调节中,NMⅡ各个亚型的作用不同。缺乏NMⅡ-B的心肌细胞许多呈现多核,提示它们有细胞分裂缺陷,补充NMⅡ-A并不能改变这一现象。在人肺癌细胞系A549,用特异性siRNA干扰NMⅡ-C1的表达会使细胞数量急剧减少、分裂明显延迟,而抑制NMⅡ-B却不影响细胞的增殖,这种抑制作用可通过补充NMⅡ-C1(而非NM Ⅱ-B或Ⅱ-A)来挽救。Wu等[18]首次证明癌细胞的胞质分裂缺陷是由于MLC磷酸化障碍造成的,降低MLC磷酸化水平会导致癌细胞胞质分裂缺陷,而增加MLC磷酸化水平则可逆转这一现象。
5 NMⅡ其它功能
NMⅡ对囊泡的转移和释放、细胞吞饮、病毒入侵等方面有重要作用。Seabrooke等[19]发现在突触前膜和突触后膜存在NMⅡ,当用ML-9抑制NMⅡ的活性时,囊泡的移动能力呈剂量依赖性递减,提示NMⅡ参与了囊泡移动。当用blebbistatin或ML-7处理嗜铬细胞时,细胞膜附近的嗜铬粒的移动和释放频率都降低,说明NMⅡ参与嗜铬粒释放儿茶酚胺[20-21]。同样,NM Ⅱ活性受到抑制时,自然杀伤(NK)细胞的裂解性颗粒释放减弱,不能与靶细胞膜融合[22]。除了调节突触囊泡与突触后膜的融合外,NMⅡ还可调节囊泡与后膜“kiss-and-run”的接触过程,通过融合孔和后膜连接来释放递质。当神经内分泌细胞过表达正常的NMⅡ的调节轻链时,与对照比较,融合孔的开放时间延长,神经递质释放增多,推测NMⅡ可通过调节融合孔开放时间来控制神经递质的释放量[23]。Megalin是肾小球滤过过程中蛋白重吸收受体,最近发现NM-ⅡA参与megalin介导的蛋白内吞作用[24]。NMⅡ还在细胞自噬中扮演重要角色,MLC磷酸化可促进细胞的自噬作用,敲除或抑制NMⅡ可使饥饿下细胞自噬小体的形成受阻[25]。NM-ⅡA通过与膜糖蛋白B(gB)相互作用来充当单纯性疱疹病毒(HSV-1)侵入细胞的受体。针对NM-ⅡA的抗体或NM-ⅡA基因敲除可阻断HSV-1对宿主细胞的的感染和细胞融合。而且在HSV-1入侵的初始阶段,宿主细胞表面的 NM-ⅡA被显著和快速地诱导表达[26]。在结肠平滑肌细胞中,核肌球蛋白Ⅱ能识别ICAM-1核心启动子区域的AGCTCC序列,MLC20的去磷酸化能促进ICAM-1的转录,反之则下调ICAM-1的转录。而且在结肠炎症发生时,核MLCK受抑制,使核MLC20的去磷酸化水平提高,导致ICAM-1转录的增强[27]。以上都提示核肌球蛋白Ⅱ是一个关键转录因子。
6 结语
目前对NMⅡ的细胞迁移、黏附、胞质分裂等方面的研究较透彻,但NMⅡ的其它功能的研究较少。如在介导囊泡转移和释放方面,主要集中在对神经突触传递、嗜铬细胞和NK细胞等的研究,NMⅡ在其它分泌细胞和吞噬细胞(如垂体、肾上腺、巨噬细胞等)中的作用尚不清楚,囊泡释放的作用机制亦无定论[20]。肌球蛋白不仅存在胞质,也发现存在细胞核中,已证实核肌球蛋白Ⅱ在特定组织中具有调节细胞间黏附因子-1(ICAM-1)转录功能[27],但核肌球蛋白Ⅱ在其它细胞或组织调节的基因转录尚未阐明。此外,对NMⅡ-B和NMⅡ-C的前mRNA选择性剪接形成的各种单体的分布和功能也值得我们深入研究。
[1] Vicente-Manzanares M,Ma X,Adelstein R S,et al.Non-muscle myosin Ⅱ takes centre stage in cell adhesion and migration[J].Nat Rev Mol Cell Biol,2009,10(11):778 -90.
[2] Golomb E,Ma X,Jana S S,et al.Identification and characterization of nonmuscle myosinⅡ-C,a new member of the myosinⅡfamily[J].J Biol Chem,2004,279(4):2800 -8.
[3] Dulyaninova N G,Malashkevich V N,Almo S C,Bresnick A R.Regulation of myosin-ⅡA assembly and Mts1 binding by heavy chain phosphorylation[J].Biochemistry,2005,44(18):6867 -76.
[4] Clark K,Middelbeek J,Dorovkov M V,et al.The alpha-kinases TRPM6 and TRPM7,but not eEF-2 kinase,phosphorylate the assembly domain of myosin ⅡA,ⅡB and ⅡC[J].Febs Lett,2008,582(20):2993-7.
[5] Gupton S L,Waterman-Storer C M.Spatiotemporal feedback between actomyosin and focal-adhesion systems optimizes rapid cell migration[J].Cell,2006,125(7):1361 - 74.
[6] Even-Ram S,Doyle A D,Conti M A,et al.Myosin ⅡA regulates cell motility and actomyosin-microtubule crosstalk[J].Nat Cell Biol,2007,9(3):299 -309.
[7] Betapudi V,Licate L S,Egelhoff T T.Distinct roles of nonmuscle myosinⅡisoforms in the regulation of MDA-MB-231 breast cancer cell spreading and migration[J].Cancer Res,2006,66(9):4725-33.
[8] Kim J H,Adelstein R S.LPA(1)-induced migration requires nonmuscle myosinⅡlight chain phosphorylation in breast cancer cells[J].J Cell Physiol,2011,226(11):2881 -93.
[9] Jacobs K,Van Gele M,Forsyth R,et al.P-cadherin counteracts myosin Ⅱ-B function:implications in melanoma progression[J].Mol Cancer,2010,9:255.
[10]Shewan A M,Maddugoda M,Kraemer A,et al.Myosin 2 is a key Rho kinase target necessary for the local concentration of E-cadherin at cell-cell contacts[J].Mol Biol Cell,2005,16(10):4531 -42.
[11]Conti M A,Even-Ram S,Liu C,et al.Defects in cell adhesion and the visceral endoderm following ablation of nonmuscle myosin heavy chain Ⅱ-A in mice[J].J Biol Chem,2004,279(40):41263-66.
[12]Miyake Y,Inoue N,Nishimura K,et al.Actomyosin tension is required for correct recruitment of adherens junction components and zonula occludens formation[J].Exp Cell Res,2006,312(9):1637-50.
[13]Ma X,Bao J,Adelstein R S.Loss of cell adhesion causes hydrocephalus in nonmuscle myosinⅡ-B-ablated and mutated mice[J].Mol Biol Cell,2007,18(6):2305 -12.
[14]Wroblewski L E,Shen L,Ogden S,et al.Helicobacter pylori dysregulation of gastric epithelial tight junctions by urease-mediated myosin Ⅱ activation[J].Gastroenterology,2009,136(1):236 -46.
[15]Rosenblatt J,Cramer L P,Baum B,et al.Myosin Ⅱ-dependent cortical movement is required for centrosome separation and positioning during mitotic spindle assembly[J].Cell,2004,117(3):361-72.
[16]Matson S,Markoulaki S,Ducibella T.Antagonists of myosin light chain kinase and of myosinⅡinhibit specific events of egg activation in fertilized mouse eggs[J].Biol Reprod,2006,74(1):169 -76.
[17]Straight A F,Cheung A,Limouze J,et al.Dissecting temporal and spatial control of cytokinesis with a myosin Ⅱ Inhibitor[J].Science,2003,299(5613):1743 -7.
[18]Wu Q,Sahasrabudhe R M,Luo L Z,et al.Deficiency in myosin light-chain phosphorylation causes cytokinesis failure and multipolarity in cancer cells[J].Oncogene,2010,29(29):4183 -93.
[19]Seabrooke S,Qiu X,Stewart B A.Nonmuscle myosin Ⅱ helps regulate synaptic vesicle mobility at the Drosophila neuromuscular junction[J].BMC Neurosci,2010,11:37.
[20]Berberian K,Torres A J,Fang Q,et al.F-actin and myosin Ⅱ accelerate catecholamine release from chromaffin granules[J].J Neurosci,2009,29(3):863 - 70.
[21]Doreian B W,Fulop T G,Smith C B.MyosinⅡ activation and actin reorganization regulate the mode of quantal exocytosis in mouse adrenal chromaffin cells[J].J Neurosci,2008,28(17):4470 -78.
[22]Andzelm M M,Chen X,Krzewski K,et al.Myosin ⅡA is required for cytolytic granule exocytosis in human NK cells[J].J Exp Med,2007,204(10):2285 -91.
[23]Aoki R,Kitaguchi T,Oya M,et al.Duration of fusion pore opening and the amount of hormone released are regulated by myosinⅡduring kiss-and-run exocytosis[J].Biochem J,2010,429(3):497-504.
[24]Hosaka K,Takeda T,Iino N,et al.Megalin and nonmuscle myosin heavy chainⅡA interact with the adaptor protein Disabled-2 in proximal tubule cells[J].Kidney Int,2009,75(12):1308 - 15.
[25]Tang H W,Wang Y B,Wang S L,et al.Atg1-mediated myosin Ⅱactivation regulates autophagosome formation during starvation-induced autophagy[J].Embo J,2011,30(4):636 -51.
[26]Arii J,Goto H,Suenaga T,et al.Non-muscle myosin ⅡA is a functional entry receptor for herpes simplex virus-1[J].Nature,2010,467(7317):859-62.
[27]Li Q,Sarna S K.Nuclear myosin Ⅱ regulates the assembly of preinitiation complex for ICAM-1 gene transcription[J].Gastroenterology,2009,137(3):1051 -60.

