芹菜素对人鼻咽癌CNE-2Z细胞化疗敏感性的增强作用
李明勇,黄培春
(广东医学院病理生理学教研室,广东湛江 524023)
芹菜素(apigenin,AP)是一种广泛存在于植物中的黄酮类化合物,具有多方面的药理作用,如抗炎[1]、抗氧化[2]和抗肿瘤等作用。其中,以抗肿瘤作用最为突出。实验证明芹菜素有抑制肺癌A549细胞[3]、多发性骨髓瘤细胞[4]、结肠癌 HT-29 细胞[5]和前列腺癌 PC-3 细胞[6]等的增殖、诱导凋亡、抑制肿瘤细胞转移和侵袭以及放化疗增敏的作用,且具有低毒、无诱变性等特点[7-8]。本实验拟观察AP、顺铂(DDP)单用和合用对体外培养的人鼻咽癌CNE-2Z细胞生长的抑制作用,并用中效原理分析两种药物的协同效应,初步探讨其促进凋亡及抑制增殖的机制。
1 材料与方法
1.1 细胞培养 人鼻咽癌CNE-2Z细胞由广东医学院病生教研室提供。在5%CO2,37℃条件下,用含10%小牛血清、青霉素1×105U·L-1,链霉素100 mg·L-1的RMPI1640培养液传代培养,实验用细胞均处于对数生长期。
1.2 主要试剂与药物 RPMI 1640培养基为Gibco公司产品;小牛血清为四季青公司产品;MTT和DMSO均为AMRESCO公司产品;PI/Hoechst33258为Sigma公司产品;TaKaRa逆转录试剂盒及PCR试剂盒(宝生物工程大连有限公司);其余试剂均为分析纯。芹菜素(AP)为Sigma公司产品,实验前用DMSO溶解,培养液稀释,DMSO终浓度为 0.1%(实验证明该浓度对细胞无影响 );DDP为南京制药厂有限公司产品(批号:20110102)。
1.3 方法
1.3.1 采用MTT法分别检测AP和DDP两药单用和合用的效应 将生长良好的CNE-2Z细胞以1×104个/孔180 μl接种于96孔培养板培养24 h。实验设空白对照组、AP单用组、DDP单用组和AP与DDP合用组,每种情况设3个平行孔,重复3次,取其平均值。将两种单药的5个不同浓度分别加在96 孔板内,每孔加药量 20 μl,AP 终浓度为 10、20、40、80、160 μmol·L-1,DDP 终浓度为 5、10、20、40、80 μmol·L-1;两药合用比例为1 ∶1,每孔加药总量仍为20 μl(每种单药剂量浓缩至1/2,各加10 μl);空白对照组以RPMI 1640培养液补足,每孔总体系200 μl。培养48 h 后每孔加入20 μl MTT,继续培养4 h后弃上清,每孔加DMSO 200 μl置摇床低速混匀15 min,自动酶标读数仪比色波长570 nm测出吸光度值(A值),并计算药物对CNE-2Z细胞的增殖抑制率(fa),计算公式为细胞增殖抑制率(fa)/%=(1-实验组A值均数/对照组A值均数)×100%。
结果判定方法:参考文献[9],两药单用及合用的中效浓度(IC50)通过Chou-Talalay联合指数法计算,中效方程式为:fa/fu=(D/Dm)m求得(式中fa为效应,fu=1-fa,D为药物浓度,Dm为中效浓度,m为中效曲线斜率)。
两药合用在不同效应的联合指数(CI)的计算公式为:CI=(D1/Dx1)+(D2/Dx2)+α(D1D2/Dx1Dx2)。Dx1、Dx2为两药单用时产生x效应的各自所需浓度,两药合用时产生x效应所需浓度为Dx(1,2),均可由中效方程式:fa/fu=(D/Dm)m求得。D1、D2为合用时产生x效应时两药各自所需浓度,可由公式D1+D2=Dx(1,2)求出。两种作用机制不同的药物联用时α=0,作用机制相同的药物联用时α=1。若CI<1,认为两药协同,CI=1为相加,CI>1为拮抗。由于芹菜素和顺铂是两种作用机制不同的药物,故α=0。
1.3.2 流式细胞仪检测细胞凋亡 取对数生长期细胞以4×105个/孔接种于6孔板内培养24 h。实验分空白对照组、AP(中效浓度)单用组、DDP(中效浓度)单用组和AP与DDP联合用药组(为各单用组药物剂量的1/2)。培养48 h后收集细胞,离心后用70%冷乙醇固定,4℃过夜,检测前用PBS洗去固定液,再加入0.6 ml PI染液,置4℃冰箱中染色30 min。尼龙网过滤后用流式细胞仪测定各组细胞的细胞凋亡率,每组均重复3次。
1.3.3 荧光双染法检测细胞凋亡情况 取对数生长期细胞以4×105个/孔加至放有盖玻片的6孔板内培养24 h。实验分组同“1.3.2”项,对照组及各药物组细胞培养48 h后取出盖玻片,用冷PBS洗2次,将混匀的PI/Hoechst33258荧光染料混合液滴加于长有细胞的盖玻片表面并使它均匀覆盖,避光、室温反应5 min,将盖玻片倒置于载玻片上,于荧光显微镜下观察细胞形态及颜色改变以区分出活的、凋亡及坏死细胞并照相。在荧光显微镜下,活细胞呈弥漫均匀的蓝色荧光,出现细胞凋亡时,细胞核或细胞质内可见多个浓染致密的颗粒块状强蓝色荧光,如细胞核为均匀的红色荧光时为坏死细胞。
1.3.4 RT-PCR 检测 bax、bcl-2 mRNA 的表达 按以上实验分组处理细胞48 h后,参照文献[10]略改动,按TRIzol试剂盒说明一步法提取总RNA,紫外分光光度法测定RNA纯度和浓度。逆转录反应合成第一链cDNA,进行PCR反应。bax上游引物5'-GGG TCT GTT TGC TTT AGG-3',下游引物5'-GGC TGC TCC AAG GTCA-3',扩增片断329 bp;bcl-2上游引物5'-TGG CGT CCC AGG TAG AT-3',下游引物5'-CGC AGA GGC TGT CAC TT-3',扩增片断 235 bp;GAPDH上游引物5'-GGT GAA GGT CGG TGT CAA CG-3',下游引物 5'-GAG CCC TTC CAC GAT GCC AA-3'。PCR产物用2%琼脂糖凝胶电泳,恒压100 V,电泳约50 min,紫外透射仪观察结果并拍照。
2 结果
2.1 两药单用及合用时不同浓度的增殖抑制效应AP、DDP单用及合用时随着药物浓度增加其增殖抑制效应也增加,并呈剂量依赖性(Fig 1),两药合用时对CNE-2Z细胞的增殖抑制效应明显强于各单用给药组,组间比较差异有统计学意义 (P<0.01)。按中效方程式计算出两药单用时AP的IC50为 48.21 μmol·L-1,DDP 的 IC50为 16.34 μmol·L-1,合用时 IC50为21.58 μmol·L-1(其中两药各自需要的浓度 AP 为14.39 μmol·L-1,DDP 为7.19 μmol·L-1)。

Fig 1 Inhibitory effects of AP,DDP and AP combined DDP with different concentrations on CNE-2Z cells
2.2 AP、DDP合用时相互作用分析 利用中效原理判定两药合用的效果。Fig 2结果显示,当fa>20%时(即所需两药物浓度逐渐增大时)两药合用指数CI<1,为协同效应。在20% <fa<50%范围时,随着两药物浓度的增大其协同作用加大,当fa>50%时,随着两药物浓度的增大其协同作用逐渐减弱。
2.3 流式细胞术检测细胞凋亡 AP、DDP单用及合用作用CNE-2Z细胞48 h后,单用药组及合用药组均可诱导CNE-2Z细胞凋亡,其中合用组诱导的细胞凋亡率明显高于单独用药和对照组,组间比较差别有显著性(P<0.05),见Fig 3。
2.4 荧光双染法观察细胞形态学改变 AP、DDP单用及合用作用 CNE-2Z细胞 48 h,经 Hoechst33258/PI双重染色后,荧光显微镜下发现联合用药组染成强蓝色,核呈固缩状或圆珠状的凋亡细胞和染成红色的坏死细胞(Fig 4 D)的现象较AP或DDP单用组(Fig 4 B,C)明显增多;而空白对照组以活细胞(细胞核染色质呈均匀分布的蓝色,Fig 4 A)为主,未见凋亡细胞。
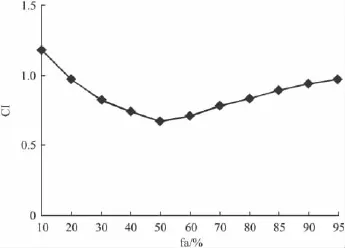
Fig 2 The relationship of the fa with the combination index when AP combined with DDP
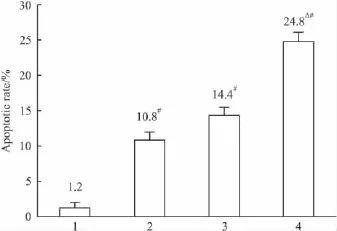
Fig 3 Apoptotic rate of CNE-2Z cells by different treatment after 48 h
2.5 对CNE-2Z细胞bax、bcl-2 mRNA表达的影响 如Fig 5所示,AP、DDP单用及合用作用CNE-2Z细胞48 h后,均可上调bax和下调bcl-2 mRNA表达,但联合用药组上调bax和下调bcl-2 mRNA表达更加明显,通过软件对它们光密度积分值分析,组间比较差别有统计学意义(P<0.05)。
3 讨论
近年来,随着诊疗技术的进步,早期局部肿瘤的治愈率大大提高。但是对于侵袭、转移性的晚期肿瘤,化疗仍然是主要的治疗手段。虽然化疗能延长晚期肿瘤患者的生存期和提高他们的生活质量,但化疗过程中化疗药物对机体的损害,以及肿瘤细胞对化疗药物产生耐药性,最终导致肿瘤的复发和治疗的失败。因此,寻找既具有抗肿瘤作用又能增强肿瘤细胞对化疗药物敏感性且无明显毒副作用的天然药物,是目前肿瘤防治研究的必然趋势。

Fig 4 Apoptosis detected by Hoechst33258/PI fluorescent staining(×200)

Fig 5 Expression of bax and bcl-2 mRNA in CNE-2Z cells by different treatment after 48h
近年来,AP作为一种新型高效低毒的抗肿瘤药物已成为肿瘤研究领域的热点之一。但有关AP抗鼻咽癌作用的实验研究尚未见报道。因此,利用AP抗鼻咽癌的实验值得深入研究。本实验MTT等结果提示AP具有抗鼻咽癌CNE-2Z细胞增殖的作用,且呈明显的剂量依赖关系,其主要的作用机制可能与直接抑制细胞生长,并诱导细胞凋亡等有关。
联合用药是目前化疗的主要手段,当多种药物联合作用时,如何确定药物配伍的最佳浓度及作用时间以减少药物的毒副作用和提高药物杀肿瘤细胞作用,国内外大多数学者通常引入中效原理和联合指数来进行评价[10]。本实验利用中效原理分析AP和DDP两种药物之间的相互关系,发现它们联合应用时各自的IC50浓度均比单用时各自的IC50浓度要小,且在中高浓度范围时呈协同效应;此外,低浓度的AP与DDP联合用药,取得了单药AP或DDP高浓度时才能得到的疗效,提示AP能提高CNE-2Z细胞对DDP的敏感性。
目前研究认为,大多数化疗药物是通过诱导肿瘤细胞凋亡而发挥作用,而肿瘤细胞由于遗传因素或化疗药物等外源因素的诱导,引起凋亡通路中的抗凋亡蛋白过量表达,促凋亡因子低表达或失活以及存活信号通路活性增强,这些异常改变单独或共同作用,使得肿瘤细胞凋亡缺陷,对多种化疗药物诱导的凋亡不敏感[11]。因此,通过调整紊乱的凋亡通路是提高肿瘤细胞对化疗药物敏感性的策略。最近研究发现,AP的放、化疗增敏作用可能与其通过调整肿瘤细胞的凋亡通路有关,如Watanabe等[12]研究发现AP可提高X线照射条件下肺癌SQ25细胞内p21/WAFl的表达,降低Bcl-2蛋白表达,从而增加肺癌细胞对放疗的敏感性,促进细胞凋亡;Choi等[13]发现AP能下调ErbB2的表达和降低Akt活性,增加乳腺癌MDA-MB-453细胞对5-氟脲嘧啶的敏感性,促使细胞凋亡;胡太平等[14]发现低浓度的AP降低HL-60细胞对化疗药物诱导凋亡的抗性,与下调NF-κB和Bcl-2的表达有关。
bcl-2基因家族在细胞凋亡过程中起着重要作用,其基因家族蛋白之间的比例影响着细胞对各种凋亡刺激分子的敏感性,决定caspases活化与否,从而决定细胞是否发生凋亡[15],其中Bcl-2/Bax比值决定了接受凋亡刺激后,细胞发生凋亡的易感性。Bcl-2过剩,细胞存活,而当Bax过剩,形成Bax同源二聚体,细胞将易发生凋亡。本实验结果显示:低浓度的AP联合DDP诱导的细胞凋亡率、上调bax和下调bcl-2 mRNA的表达明显高于单独用药和对照组,提示低浓度的AP可通过促凋亡作用和降低细胞对化疗药物诱导凋亡的抗性,增强CNE-2Z细胞对DDP的敏感性。
综上所述,AP作为一种植物提取的活性成分,结合其不良反应小等特点,渴望其能成为一种理想的化疗增敏剂。
[1] Jeong G S,Lee S H,Jeong S N,et al.Anti-inflammatory effects of apigenin on nicotine-and lipopolysaccharide-stimulated human periodontal ligament cells via heme oxygenase-1[J].Int Immunopharmacol,2009,9(12):1374 - 80.
[2] Al Shaal L,Shegokar R,Müller R H.Production and characterization of antioxidant apigenin nanocrystals as a novel UV skin protective formulation[J].Int J Pharm,2011,420(1):133 -40.
[3] Lu H F,Chie Y J,Yang M S,et al.Apigenin induces caspase-dependent apoptosis in human lung cancer A549 cells through Baxand Bcl-2-triggered mitochondrial pathway[J].Int J Oncol,2010,36(6):1477-84.
[4] Zhao M,Ma J,Zhu H Y,et al.Apigenin inhibits proliferation and induces apoptosis in human multiple myeloma cells through targeting the trinity of CK2,Cdc37 and Hsp90[J].Mol Cancer,2011,10:104.
[5] Turktekin M,Konac E,Onen H I,et al.Evaluation of the effects of the flavonoid apigenin on apoptotic pathway gene expression on the colon cancer cell line(HT29)[J].J Med Food,2011,14(10):1107-17.
[6] Kaur P,Shukla S,Gupta S.Plant flavonoid apigenin inactivates Akt to trigger apoptosis in human prostate cancer:an in vitro and in vivo study[J].Carcinogenesis,2008,29(11):2210 -7.
[7] Clere N,Faure S,Martinez M C,et al.Anticancer properties of flavonoids:roles in various stages of carcinogenesis[J].Cardiovasc Hematol Agents Med Chem,2011,9(2):62 -77.
[8] Bokulic A,Garaj-Vrhovac V,Brajsa K,et al.The effect of apigenin on cyclophosphamide and doxorubicin genotoxicity in vitro and in vivo[J].J Environ Sci Health A Tox Hazard Subst Environ Eng,2011,46(5):526 -33.
[9] Chou T C,Talalay P.Quantitative analysis of dose-effects relationships:the combined effect of multiple drugs on enzyme inhibitors[J].Adv Enzyme Regul,1984,22(1):27 -55.
[10] Hennessey V G,Rosner G L,Bast RC Jr,Chen M Y.A Bayesian approach to dose-response assessment and synergy and its application to in vitro dose-response studies[J].Biometrics,2010,66(4):1275-83.
[11]刘小东,孙 华,刘耕陶.基于调控细胞凋亡的肿瘤化疗增敏策略[J].中国药理学通报,2009,25(10):1261 -4.
[11] Liu X D,Sun H,Liu G T.Tumor chemosensitization strategies based on apoptosis manipulations[J].Chin Pharmacol Bull,2009,25(10):1261-4.
[12] Watanabe N,Hirayama R,Kubota N.The chemopreventive flavonoid apigenin confers radiosensitizing effect in human tumor cells grown as monolayers and spheroids[J].J Radiat Res(Tokyo),2007,48(1):45 -50.
[13] Choi E J,Kim G H.5-Fluorouracil combined with apigenin enhances anticancer activity through induction of apoptosis in human breast cancer MDA-MB-453 cells[J].Oncol Rep,2009,22:1533-7.
[14]胡太平,陈伟强,曹建国.芹菜素对人急性髓性白血病细胞化疗敏感性的增强作用[J].郑州大学学报(医学版),2007,42(3):515-7.
[14] Hu T P,Chen W Q,Cao J G.Chemosensitization effects of apigenin on cisplatin in human acute myeloid leukaemia HL-60 cells[J].J Zhengzhou Univ(Med Sci),2007,42(3):515 -7.
[15] Wong W W,Puthalakath H.Bcl-2 family proteins:the sentinels of the mitochondrial apoptosis pathway[J].IUBMB Life,2008,60(6):390-7.

