TGF-β1-Samd3信号转导在星形胶质细胞增殖中的作用
余传勇,桂 韦,黄 琳,王 玉
(安徽医科大学第一附属医院神经内科,安徽合肥 230022)
在脑损伤、癫痫等多种中枢神经系统(CNS)疾病的病理生理过程中,星形胶质细胞激活并过度增生形成胶质瘢痕[1]。激活的星形胶质细胞一方面可以分泌和合成大量的细胞外基质(ECM)抑制神经轴突的生长[2],另一方面胶质瘢痕形成机械性屏障阻碍轴索再生长,从而影响神经功能的修复[3]。此外,星形胶质细胞的增殖及胶质疤痕形成还是某些脑病,如癫痫的脑功能紊乱的病理基础[4-5],因此对CNS胶质疤痕的深入研究具有重要意义。研究发现在脑血管疾病、癫痫等脑损伤疾病中,转化生长因子β1(TGF-β1)含量由正常生理情况下的微量表达转而明显增加[6]。本文作者 Wang 等[7]发现TGF-β1的下游转导因子Samd3基因敲除小鼠脑损伤后胶质疤痕形成明显被抑制,然而,目前尚无证据表明Samd3对胶质疤痕形成的影响系经由TGF-β1-Samd3信号转导来完成的,因为Smad3同样转导来自TGF-β家族中其它细胞因子的信号。本文通过SiRNA干扰技术,探讨TGF-β1-Smad3信号转导通路在星形胶质细胞增殖中的作用,以期从星形胶质细胞分裂增殖的角度研究CNS胶质疤痕形成的细胞内信号转导机制,为脑损伤后中枢神经系统胶质疤痕形成的干预治疗提供实验基础。
1 材料与方法
1.1 主要试剂 胶质纤维酸性蛋白(GFAP)抗体购自Doka公司,胰酶和胎牛血清均购自Hyclone公司,多聚赖氨酸和Lipofectamine2000均为Sigma公司产品,DMEM培养基购自Gibco公司,5-溴脱氧尿嘧啶核苷(BrdU)抗体购自Abcam公司。
1.2 方法
1.2.1 小鼠星形胶质细胞的培养与鉴定[8]取出生后3 d内的ICR小鼠(安徽省实验动物中心),无菌条件下断头取出大脑皮质部分,投入HBSS中,仔细剔除中脑、嗅球、海马、脑膜及毛细血管等结构,进行星形胶质细胞的原代培养。在含体积分数为10%胎牛血清DMEM培养液中,单层细胞培养,37℃5%CO2孵箱中培养1周后传代。使用兔抗GFAP对星形胶质细胞进行染色,予以鉴定,GFAP阳性细胞率超过95%。
1.2.2 实验分组及药物处理 将纯化培养的第2代星形胶质细胞用0.25%的胰酶消化成单细胞悬液,以1×104/孔接种于96孔培养板中,培养48 h,观察细胞完全贴壁。将实验分4组,每组15个孔,分别加入浓度为1、5、10 μg·L-1的 TGF-β1,并设对照组,同时加入 BrdU抗原(终浓度20 μmol·L-1)培养48 h,观察TGF-β1对星形胶质细胞增殖的影响;经过同样的培养过程,将实验分4组,Smad3-SiRNA-1,Smad3-SiRNA-2,Smad3-SiRNA-3 及对照组,每组15孔,同时加入 BrdU抗原(终浓度20 μmol·L-1),观察Smad3基因沉默对星形胶质细胞增殖的影响;经过同样的培养过程,将实验分5组,每组12个孔,分别加入浓度为10 μg·L-1的TGF-β1以及 Smad3-SiRNA-1,Smad3-SiRNA-2及 Smad3-SiRNA-3,并设 10 μg·L-1的 TGF-β1 对照以及空白对照,同时加入 BrdU抗原(终浓度20 μmol·L-1)培养48 h,观察Smad3基因沉默对TGF-β1促进星形胶质细胞增殖影响的干扰作用。
1.2.3 免疫细胞荧光直接观察细胞增殖情况 取来经TGF-β1及BrdU处理48 h后的星形胶质细胞,弃去培养液,PBS洗涤5 min,4%多聚甲醛固定30 min,2 mol·L-1盐酸暴露 BrdU 标记部位 30 min,0.3%TritonX-100通透45 min,5%羊血清封闭1 h,分别加入兔抗GFAP+大鼠抗BrdU抗体,常温孵育1 h后放入4℃冰箱孵育过夜,PBS洗涤3次,充分洗去一抗,加入荧光标记二抗:羊抗大鼠FITC+羊抗兔CY3,室温避光孵育3 h,PBS洗涤3次后,DAPI染核20 min,PBS洗涤3次,在荧光显微镜(Olympus IX71)下分别观察GFAP、BrdU和DAPI的标记情况,在荧光显微镜下,对已行GFAP、BrdU和DAPI三染的96孔板,每孔取互不重叠的4个视野,进行拍照,然后计算BrdU阳性细胞数占星形胶质细胞总数的百分比进行计数统计。增殖率计算为BrdU+GFAP+DAPI三染细胞数与GFAP+DAPI双染细胞数比值,数据以±s%表示。
1.2.4 SiRNA 沉默技术
1.2.4.1 SiRNA合成 我们根据小鼠Smad3基因编号序列特征,依照SiRNA的设计原则,由广州市锐博生物科技有限公司合成3对Smad3-SiRNA:Smad3-SiRNA-1正义链:5'CAGUUCUACCUCCAGUGUU dTdT 3',反义链:3'dTdT GUCAAGAUGGAGGUCACAA 5';Smad3-SiRNA2正义链:5'CCAUGACAGUAGAUGGCUU dTdT 3',反义链:3'dTdTGGUACUGUCAUCUACCGAA 5';Smad3-SiRNA-3正义链:5'CGCAGAACGUGAACACCAA dTdT 3',反义链:3'dTdTGCGUCUUGCACUUGUGGUU 5',对相应基因进行沉默。
1.2.4.2 Smad3-SiRNA转染入细胞 星形胶质细胞体外培养1周后,传代至6孔板及96孔板中,培养3天,细胞融合率约达到70% ~75%时进行转染,用Lipofectamine2000作载体转染Smad3-SiRNA,转染过程按转染试剂说明书进行。转染6 h后更换新鲜DMEM培养基,培养2 d后,对细胞进行固定染色并在显微镜下观察,转染效率用RT-PCR进行检测。
1.2.4.3 应用 RT-PCR技术验证基因沉默 取2代星形胶质细胞,传入6孔板,分5组,Smad3-SiRNA-1,Smad3-SiRNA-2,Smad3-SiRNA-3,TGF-β1 及对照组。用TRIzol液裂解细胞,提取mRNA,按Fermentas逆转录试剂盒操作步骤,逆转录mRNA为cDNA,再进行PCR扩增,Smad3引物序列:上游:5'-ACAAGGTCCTCACCCAGATG3',下游:5'-TGGCGATACACCACCTGTTA 3';β-actin引物序列:上游:5'-CAGTAACAGTCCGCCTAGAA-3',下 游:5'-GATTACTGCTCTGGCTCCTA-3';PCR体系:TaqLA酶0.5 μl,10 × buffer 2.5 μl,dNTP 4 μl,上下游引物各 1 μl,cDNA 1 μl,无酶水 15 μl,共 25 μl,反应条件:94℃ 5 min,94℃ 1 min,60℃ 1 min,72℃ 1 min 45 s,72℃ 7 min,共35个循环,通过凝胶成像系统进行拍照,记录结果。
2 结果
2.1 TGFβ1促进星形胶质细胞的增殖 不同浓度的 TGF-β1(1、5、10 μg·L-1)对星形胶质细胞增殖均有促进作用。BrdU+DAPI+GFAP共染为增殖细胞数,DAPI+GFAP共染为细胞总数,增殖率=增殖细胞数/细胞总数,计算增殖率。1 μg·L-1TGF-β1组增殖率为(48.19 ± 3.49)%,5 μg·L-1TGF-β1组增殖率(50.92 ±4.71)%,10 μg·L-1TGF-β1 组增殖率为(62.39±4.14)%,与对照组(34.73±1.74)%相比,明显增高,并呈现一定的剂量依赖性,即 10 μg·L-1与 1 μg·L-1比较 P < 0.05,而 5 μg·L-1与 1 μg·L-1以及 10 μg·L-1相比,差异均无统计学意义(Tab 1)。
Tab 1 Effect of TGF-β1 on astrocyte proliferation(±s,n=6)
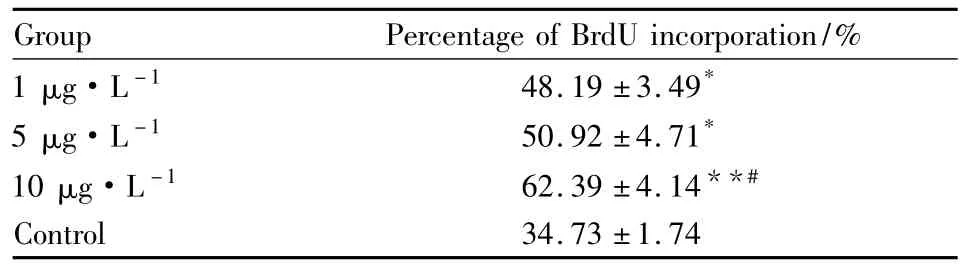
Tab 1 Effect of TGF-β1 on astrocyte proliferation(±s,n=6)
*P <0.05,**P <0.01 vs control;#P <0.05 vs 1 μg·L-1group
Group Percentage of BrdU incorporation/%1 μg·L -1 48.19 ±3.49*5 μg·L -1 50.92 ±4.71*10 μg·L -1 62.39 ±4.14**#Control 34.73 ±1.74
2.2 Smad3-SiRNA成功沉默Samd3基因的表达PCR产物琼脂糖凝胶电泳结果(Fig1 A)显示,TGF-β1为阳性组,可见清晰条带;沉默组 Smad3-SiRNA-1以及Smad3-SiRNA-3的mRNA水平明显低于对照组,而Smad3-SiRNA-2与对照组相比mRNA水平无差别(Fig1 B),表明Smad3-SiRNA-2没有沉默相关基因,而 Smad3-SiRNA-1和Smad3-SiRNA-3成功转染入细胞,并成功沉默相关基因。
2.3 Smad3-SiRNA抑制星形胶质细胞的增殖Smad3-SiRNA沉默Smad3基因后明显降低了星形胶质细胞增殖率,星形胶质细胞数量也明显减少(Fig 2)。

Fig 1 Levels of Smad3 mRNA in astrocytes exposed to various types of Smad3-SiRNA or TGF-β1
Smad3-SiRNA-1组增殖率(17.33±1.83)%、Smad3-SiRNA-3组增殖率(15.83±2.10)%与对照组增殖率(35.50±3.17)%相比,明显减低,差异有统计学意义,而Smad3-SiRNA-2组增殖率(32.00±1.73)%与对照组相比,无统计学意义(Tab 2)。
Tab 2 Effect of Smad3-SiRNA on astrocyte proliferation(±s,n=6)
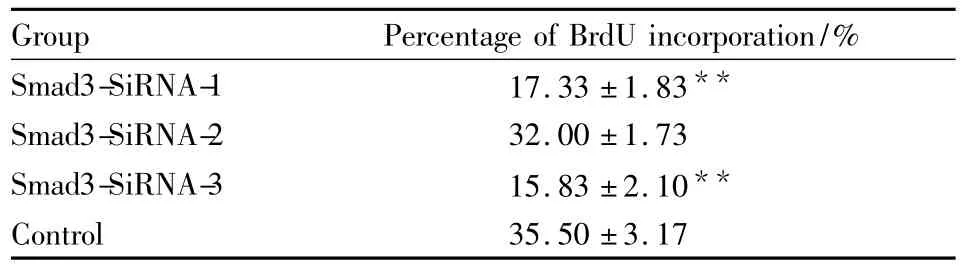
Tab 2 Effect of Smad3-SiRNA on astrocyte proliferation(±s,n=6)
**P<0.01 vs control
Group Percentage of BrdU incorporation/%Smad3-SiRNA-1 17.33 ±1.83**Smad3-SiRNA-2 32.00 ±1.73 Smad3-SiRNA-3 15.83 ±2.10**Control 35.50 ±3.17
2.4 Smad3-SiRNA阻断TGF-β1对星形胶质细胞增殖的促进作用 Smad3基因被成功沉默后,TGF-β1+Smad3-SiRNA-1组增殖率(24.55±2.33)%、TGF-β1+Smad3-SiRNA-3 组 增 殖 率 (27.83 ±2.39)%与对照组增殖率(40.40±3.16)% 及10 μg·L-1TGF-β1组增殖率(58.64±5.32)%相比明显减低,结果差异有统计学意义;而TGF-β1+Smad3-SiRNA-2组增殖率(46.70±3.83)%与10 ng·ml-1TGF-β1组相比,结果差异无统计学意义,但与对照组相比增殖率明显增高,结果有统计学差异(Tab 3)。

Arrows indicate the cells co-labeled with GFAP,BrdU and DAPI.(Bars=100 μm)
Tab 3 Effect of Smad3-SiRNA+TGF-β1 on astrocyte proliferation(±s,n=6)
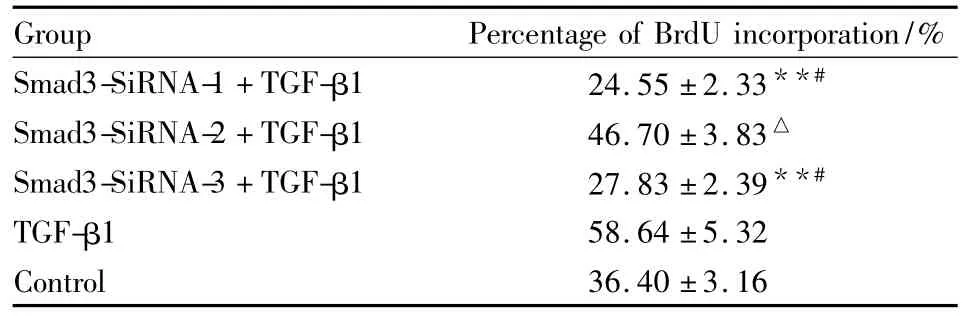
Tab 3 Effect of Smad3-SiRNA+TGF-β1 on astrocyte proliferation(±s,n=6)
**P <0.01 vs TGF-β1;#P <0.05 vs control;△P <0.05 vs control
Group Percentage of BrdU incorporation/%Smad3-SiRNA-1+TGF-β1 24.55 ±2.33**#Smad3-SiRNA-2+TGF-β1 46.70 ±3.83△Smad3-SiRNA-3+TGF-β1 27.83 ±2.39**#TGF-β1 58.64 ±5.32 Control 36.40 ±3.16
3 讨论
TGF-β参与细胞的生长、分化及组织炎症、损伤修复等多种生物学作用,具有多重生物学功能[9],它是一种多效的多肽细胞因子,包括TGF-β1、TGF-β2和TGF-β3,其中TGF-β1是细胞和组织中含量最丰富的,在大多数脑损伤的疾病中都会检测到TGF-β1 含量的明显增高[10]。TGF-β1 激活的信号通路主要有以下几种,Smads通路、MAPK(mitogen-activated protein kinase)通路、NF-κB 通路、P B kinase/AKT 通路等[11]。近年来研究表明 TGF-β1-Smad3信号转导途径是其重要的转导路径,此信号路径主要成员包括TGF-β1、相应受体、胞质蛋白 Smads、早期应答转录因子等[12]。此通路在肺纤维化、肝纤维化以及皮肤瘢痕形成中的研究已较明确,可促进成纤维细胞的过度增生、分化,促进细胞外基质的过度聚集而引起病变[11],而其在中枢神经系统胶质细胞改变中的作用国内外尚未见报道。
本实验通过给予不同浓度的 TGF-β1(1、5、10 μg·L-1)加入体外培养的星形胶质细胞中,发现TGF-β1能明显促进星形胶质细胞增殖(P<0.05),并出现一定程度的浓度依赖效应。这一结果与以往的报道一致[13],但其下游机制目前尚不明确。为了进一步研究TGF-β1是如何促进星形胶质细胞增殖,通过何种机制介导,我们应用目前在基因功能研究中重要的研究手段RNA干扰技术,RNA干扰技术有直接转染双链SiRNA和载体表达发夹RNA两种[14],我们采用前者。成功沉默Smad3基因,干扰TGF-β1-Smad3信号转导通路后,星形胶质细胞增殖明显受到抑制。同时,我们还发现,成功沉默Smad3基因能阻断TGF-β1对星形胶质细胞增殖的促进作用,这些结果说明TGF-β1促进星形胶质细胞的增殖系通过Smad3完成信号转导的。
综上所述,本文通过沉默Smad3基因,以及加大TGF-β1的剂量,正反两方面证实TGF-β1-Smad3信号转导通路在星形胶质细胞增殖中起重要作用。由于胶质疤痕中的主体构架系由星形胶质细胞组成,由此我们可以推断该通路在胶质疤痕形成中可能起重要作用。中枢神经系统损伤后,星形胶质细胞激活,一方面由损伤周围向损伤中心部位移行增殖,另一方面星形胶质细胞经由分裂而增加细胞数,在损伤中心部位形成胶质疤痕[15],构成机械屏障从而机械性的阻碍神经元再生[3]。所以在CNS损伤后,我们可以通过对该通路进行干扰,从而阻止胶质疤痕的产生,抑制了机械屏障的形成,从而促进神经元的再生,为神经再生的基因治疗提供了理论依据。
在我们的后续工作中,我们将在体内探讨TGF-β1-Smad3信号转导通路对胶质疤痕形成的调节机制,以及进一步研究TGF-β1-Smad3信号转导通路的下游机制,为脑损伤后基因治疗减少胶质疤痕形成、促进神经再生提供理论和实践依据。
[1] Ridet J L,Malhotra S K,Privat A,et al.Reactive astrocytes:cellular and molecular cues to biological function[J].Trends Neurosci,1997,20(12):570 -7.
[2] Devies J E,Tang X,Denning J W,et al.Decorin suppresses neurocan,brevican,phosphacan and NG2 expression and promotes axon growth across adult rat spinal cord jnjuries[J].Eur J Neurosci,2004,19(5):1226 -42.
[3] Fitch M T,Silver J.CNS injury,glial scars,and inflammation:Inhibitory extracellular matrices and regeneration failure[J].Exp Neurol,2007,209(2):294 -301.
[4] Vessal M,Dugani C B,Solomon D A,et al.Might astrocytes play a role in maintaining the seizure-prone state[J].Brain Res,2005,1044(2):190-6.
[5] Hoeppner T J,Morrell F.Control of scar formation in experimentally induced epilepsy[J].Exp Neurol,1986,94(3):519 - 36.
[6] Buss A,Pech K,Brook G A,et al.TGF-beta 1 and TGF-beta 2 expression after traumatic human spinal cord injury[J].Spinal Cord,2008,46(5):364 -71.
[7] Wang Y,Moges H,Symes A,et al.Smad3 null mice display more rapid wound closure and reduced scar formation after a stab wound to the cerebral cortex[J].Exp Neurol,2007,203(1):168-84.
[8] Yin Z,Milatovic D,Aschner J L,et al.Methylmercury induces oxidative injury,alterations in permeability and glutamine transport in cultured astrocytes[J].Brain Res,2007,1131(1):1 -10.
[9] 张敬军.星形胶质细胞的研究[J].中国药理学通报,2006,22(7):788-91.
[9] Zhang J J.Advances in astrocytes[J].Chin Pharmacol Bull,2006,22(7):788-91.
[10] Huang R Q,Cheng H C,Zhao X D,et al.Preliminary study on the effect of trauma-induced secondary cellular hypoxia in brain injury[J].Neurosci Lett,2010,473(1):22 -7.
[11]杨雅茹,黄 艳,李 俊.TGF-β1介导的 Smads与 ERK通路在肺纤维化中的作用及相互关系[J].中国药理学通报,2010,26(5):561-3.
[11] Yang Y R,Huang Y,Li J.The relationship between TGF-β1 mediated Smads and ERK in the progression of pulmonary fibrosis[J].Chin Pharmacol Bull,2010,26(5):561 - 3.
[12] Cook T,Urrutia R.TIEG proteins join the Smads as TGF-betaregulated transcription factors that control pancreatic cell growth[J].Am J Physiol Gastrointest Liver Physiol,2000,278(4):513 -21.
[13] Schluesener H J,Meyermann R.TGF-beta 1,beta 2,beta 1.2 and the bone morphogenetic protein BMP2:members of the transforming growth factor type beta supergene family with different morphogenetic effects on rat astrocyte cultures[J].Autoimmunity,1991,9(1):77 -81.
[14] Yu J Y,DeRuiter S L,Turner D L.RNA interference by expression of short-interfering RNAs and hairpin RNAs in mammalian cells[J].Proc Natl Acad Sci USA,2002,99(9):6047 -52.
[15] James W F,Richard A A.The glial scar and central nervous system repair[J].Brain Res Bull,1999,49(6):377 - 91.

