吡格列酮对脂多糖刺激的星形胶质细胞白介素-1β的抑制作用及机制
刘 卓,隋海娟,闫恩志,刘婉珠,金 英
(辽宁医学院1.药理学教研室,2.机能实验中心,辽宁 锦州 121001)
星形胶质细胞(astrocyte,AC)是哺乳动物中枢神经系统内分布最广泛的胶质细胞,能合成分泌多种神经递质、激素及神经营养因子,维持着神经元内外环境、免疫调节和信号转导等功能[1]。AC在致炎因素的刺激下被激活对神经元即有保护作用,也能分泌细胞毒因子、炎症因子和补体蛋白,其中一些炎症介质反过来诱导更多的小胶质细胞趋活化,另一些则导致局部的组织损伤,从而损害神经元[2-3]。现在越来越多的证据表明激活的AC引起的炎症反应、氧化应激是如阿尔采末病(Alzheimer's disease,AD)的重要病理机制[4]。IL-1β是激活的AC分泌的作用最强的炎症介质之一,不仅能导致神经元淀粉样蛋白前体(amyloid precursor protein,APP)明显表达,而且也可以加速神经纤维缠结形成。因为IL-1β可以促使tau蛋白病变的形成和发展,推测IL-1β可能是AD发展和演进的早期病理因子[5-6]。
吡格列酮 (pioglitazone,Pio)是噻唑烷二酮类药物(thiazolidinedione drugs,TZDs)中的一种,可通过激活过氧化物酶增殖物激活受体γ(peroxisome proliferator-activated receotor-γ,PPARγ)对神经细胞有直接的保护作用[7],还能抑制神经胶质细胞的激活及中枢炎症介质的分泌[8]。本研究采用LPS损伤模型,观察Pio对培养的大鼠乳鼠皮质星形胶质细胞产生IL-1β的影响,并进一步探讨其可能作用机制。
1 材料与方法
1.1 药品和试剂 Pio由日本TaKeDa公司提供(批号:060901,纯度>99%),临用时用二甲基亚砜(dimethyl sulfoxide,DMSO)溶 解。DMSO、LPS、DMEM、胰蛋白酶(trypsin,1 ∶250)和 L-多聚赖氨酸(poly-L-lysine)均购自Sigma公司;SP600125购于厦门励远有限公司;新生胎牛血清、HEPES、马血清购于北京华美转导科技有限公司;磷酸化JNK1/2(Thr183/Tyr185,#9251)、磷酸化 c-Jun(Ser63,#9261),购于Cell Signaling公司。IL-1β的ELISA试剂盒为武汉博士德生物科技有限公司产品。
1.2 大脑皮层星形胶质细胞的培养 取出生1~2 d的Sprague-Dawley(SD)大鼠乳鼠,无菌条件下取出大脑皮层,剔除血管和软脑膜,剪碎后加入0.125%胰蛋白酶37℃消化。待细胞分散后,终止消化。200目筛网过滤、离心,用完全培养基制成细胞悬液,调整细胞密度为1×108~109L-1,接种在75 cm2培养瓶中,置于37℃、5%CO2培养箱中培养。以后每3天换液1次,第9天将培养的星形胶质细胞置于水浴恒温振荡器上,37℃、260 r·min-1、18 h,舍弃含脱落细胞的细胞悬液,以去除少突胶质和小胶质细胞,仍贴壁的细胞大部分为星形胶质细胞。用0.25%胰蛋白酶溶液消化后离心,完全培养基重悬,接种于两个75 cm2培养瓶中,以传代。细胞传2~3代后进行实验。
1.3 实验分组及给药方法 取培养第2~3代星形胶质细胞接种于培养瓶或培养板,置于培养箱中培养3 d,待细胞增殖融合成单层,按加入药物不同分为① 对照组:加入0.1%的DMSO;② LPS组:LPS用培养基新鲜配置,终浓度为10 mg·L-1,作用24 h;③ Pio组:加入不同浓度的 Pio(0.1、1.0、10.0 μmol·L-1)作用1 h后再加入LPS继续作用24 h;④ SP600125 组:加入 SP600125(10.0 μmol·L-1)作用1 h后再加入LPS共同作用24 h或单独加SP600125作用24 h。
1.4 ELISA法测定星形胶质细胞上清液中IL-1β含量 星形胶质细胞传2~3代后进行分组,药物处理24 h后,收集细胞培养上清液。上清液离心,分装,-80℃冻存。根据ELISA法测定培养液中IL-1β的含量。
1.5 免疫荧光染色法检测星形胶质细胞IL-1β的表达 星形胶质细胞经药物处理后,移去培养基,用冷的PBS漂洗2次。4%多聚甲醛室温固定30 min,PBS漂洗3次,每次10 min。0.3%TritonX-100作用30 min,PBS漂洗3次,每次10 min。3%山羊血清封闭30 min;加入IL-1β抗体(1∶100)4℃过夜,PBS漂洗后,加入TRITC标记的二抗作用2 h,PBS漂洗。荧光倒置显微镜下观察,拍照。
1.6 Western blot法检测磷酸化JNK、c-Jun蛋白表达水平 细胞经实验因素处理后,离心收集。放入预冷的裂解缓冲液中,4℃超声粉碎后,12 000×g离心30 min,取上清,用BCA蛋白定量试剂盒进行蛋白定量。用10% ~12%的SDS-PAGE分离蛋白质,电泳后将PAGE凝胶中的蛋白质电转移至PVDF膜上,取出后将膜放入3%BSA封闭液中,封闭60 min,再用TBST洗膜3次,每次10 min。将膜放入一抗中(1∶500),4℃孵育过夜。TTBS冲洗后,将膜放入相应二抗(1∶1 000)中,室温孵育1~2 h,漂洗3次。将膜在SuperSignal West Pico底物工作液中孵育5 min,吸干多余试剂,放置化学发光凝胶系统分析仪中进行ECL化学发光,分析结果。
2 结果
2.1 Pio对LPS激活的星形胶质细胞IL-1β释放的影响 应用ELISA方法测定了星形胶质细胞上清液中IL-1β含量,结果表明LPS(10 mg·L-1)刺激后星形胶质细胞培养液中IL-1β含量明显增加,Pio(0.1,1.0 μmol·L-1和 10.0 μmol·L-1)可明显抑制LPS引起的星形胶质细胞IL-1β的产生,且随着浓度的增加,抑制作用越来越明显。SP600125可对抗LPS引起的星形胶质细胞IL-1β产生增加(P<0.01),说明LPS引起的IL-1β产生增加与激活JNK信号转导通路有关,单独应用SP600125对正常IL-1β无明显作用(Tab 1)。
Tab 1 Effects of pioglitazone and SP600125 on LPS-induced production of IL-1β in cultured medium of astrocytes(±s,n=6)

Tab 1 Effects of pioglitazone and SP600125 on LPS-induced production of IL-1β in cultured medium of astrocytes(±s,n=6)
**P<0.01 vs control group;#P<0.05,##P<0.01 vs LPS group
Group Dose/μmol·L -1 IL-1β/ng·L -1 Control - 7.43 ±1.62 LPS - 181.52 ±25.28**LPS+Pio1 0.1 158.98 ±22.56#LPS+Pio2 1 125.98 ±16.85##LPS+Pio3 10 106.25 ±14.62##LPS+SP600125 10 76.40 ±14.88##SP600125 10 6.49 ±2.18
2.2 免疫荧光观察Pio对LPS引起的星形胶质细胞IL-1β表达水平的影响 为了更进一步证明Pio对LPS引起的星形胶质细胞IL-1β表达水平的影响,本实验采用免疫荧光的方法进行了深入的研究。正常情况下星形胶质细胞IL-1β几乎不表达(Fig 1A),LPS刺激后星形胶质细胞IL-1β表达水平明显增加(Fig 1B),Pio(1.0 μmol·L-1)能明显抑制 LPS的作用,使IL-1β表达水平明显降低(Fig 1C)。
2.3 Pio对星形胶质细胞磷酸化JNK1、c-Jun蛋白水平的影响 结果显示,LPS作用于星形胶质细胞后,磷酸化 JNK1、c-Jun蛋白水平明显增加 (P<0.01),Pio(0.1,1.0 μmol· L-1和 10.0 μmol·L-1)可明显对抗LPS导致星形胶质细胞的磷酸化JNK1、c-Jun蛋白水平增加(P <0.05,P <0.01);但总量 JNK1(Total-JNK1,T-JNK1)、总量 c-Jun(Totalc-Jun,T-c-Jun)蛋白表达几乎没有改变(Fig 2,3)。
3 讨论
AD患者的脑内发现有明显的胶质细胞反应,老年斑周围有大量的活化的AC包裹[8]。活化的AC可分泌细胞炎症介质如 IL-1β、IL-6、TNF-α 及NO等,这些物质对神经元有毒性作用,使神经元凋亡并坏死[9-11]。其中IL-1β是细胞内和体液中发挥重要作用的炎症因子,可以通过多个环节参与神经元的损伤,包括诱导黏附分子、增加白细胞的浸润、促进NOS的合成增加,诱导氨基酸和自由基的产生,以及启动多种细胞因子级联反应[12]。在AD脑中IL-1β的大量分泌造成的炎症损伤与老年斑和神经纤维缠结的形成、营养不良性轴突的产生以及神经元胆碱能受体过度表达直接相关。
JNK信号传导通路是细胞凋亡的重要信号传导途径,常常被环境应激如紫外线和热休克以及炎症因子如IL-1β和TNF-α等激活[13-14]。JNK1是JNK信号转导通路中重要的酶,激活后能引起大量与凋亡有关的基因表达及炎症介质的释放。JNK激活后可磷酸化其下游c-Jun,c-Jun是细胞内的一个重要转录因子,可通过诱导同源或异源二聚体形成,形成活化蛋白-1(activator protein-1,AP-1)复合物,而上调促凋亡相关蛋白的表达发挥作用[15]。本研究用LPS刺激星形胶质细胞大量分泌IL-1β,特异性JNK阻断剂SP600125能明显抑制星形胶质细胞分泌IL-1β,表明JNK信号转导通路的激活参与了LPS诱导的星形胶质细胞分泌IL-1β增加。反过来IL-1β诱导也能激活JNK信号传导通路,促进更多的炎症因子释放,形成恶性循环反应造成炎症损伤升级,从而对神经元造成严重损伤[16]。
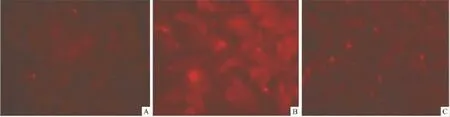
Fig 1 Effects of pioglitazone on LPS-induced expression of IL-1β in cultured cortical astrocytes in rats
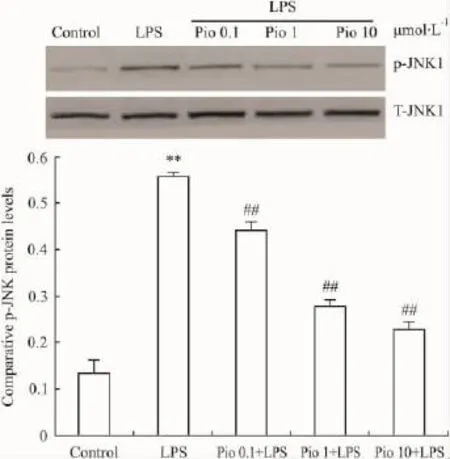
Fig 2 Effects of pioglitazone on LPS-induced phospho-JNK1 level in astrocytes in rats(±s)
Pio是TZDs类药物,广泛用于治疗2型糖尿病,研究发现其可通过激活PPAR-γ信号转导途径发挥抗炎作用,在治疗炎症性疾病方面有很大的应用前景[17-18]。本实验表明Pio能有效降低星形胶质细胞分泌IL-1β水平,来达到对星形胶质细胞炎症损伤的保护作用,且一定范围内呈剂量依赖性。对Pio抗炎症机制的进一步探索显示,Pio能部分下调LPS引起的磷酸化JNK1、c-Jun蛋白的水平,则表明了Pio的抑制星形胶质细胞分泌IL-1β的作用与其下调JNK信号转导通路有关,而其具体的抗炎机制还有待于进一步研究。
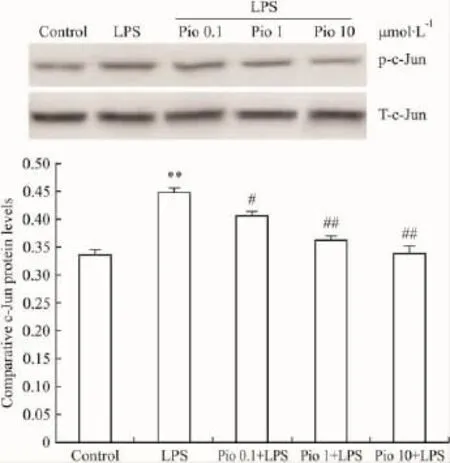
Fig 3 Effects of pioglitazone on LPS-induced phospho-c-Jun level in astrocytes in rats(±s)
[1] Verkhratsky A,Olabarria M,Noristani H N,et al.Astrocytes in Alzheimer's disease[J].Neurotherapeutics,2010,7(4):399 -412.
[2] Dong Y,Benveniste E N.Immune function of astrocytes[J].Glia,2001,36:180 -90.
[3] Lee J W,Lee Y K,Yuk D Y,et al.Neuro-inflammation induced by lipopolysaccharide causes cognitive impairment through enhance-ment of beta-amyloid generation[J].J Neuroinflammation,2008,29(5):37.
[4] Fuller S,Steele M,Münch G.Activated astroglia during chronic inflammation in Alzheimer's disease-do they neglect their neurosupportive roles[J].Mutat Res,2010,690(1 -2):40 -9.
[5] Bellucci A,Westwood A J,Ingram E,et al.Induction of inflammatory mediators and microglial activation in mice transgenic for mutant human P301S tau protein[J].Am J Pathol,2004,165(5):1643-52.
[6] Kitazawa M,Oddo S,Yamasaki T R,et al.Lipopolysaccharide-induced inflammation exacerbates tau pathology by a cyclin-dependent kinase 5-mediated pathway in a transgenic model of Alzheimer's disease[J].J Neurosci,2005,28;25(39):8843 - 53.
[7] 隋海娟,金 英,潘月星,等.吡格列酮对脂多糖引起大鼠大脑皮质神经元损伤的抑制作用[J].中国药理学与毒理学,2009,23(6):423-30.
[7] Sui H J,Jin Y,Pan Y X,et al.Protective effects of pioglitazone on lipopolysaccharide-induced neurotoxicity in the cultured cortical neurons[J].Chin J Pharmacol Toxicol,2009,23(6):423 -30.
[8] Bradt B M,Kolb W P,Cooper N R.Complement-dependent proinflammatory properties of the Alzheimer's disease beta-peptide[J].J Exp Med,1998,3;188(3):431 -8.
[9] Kim E J,Kwon K J,Park J Y,et al.Effects of peroxisome proliferator-activated recep-tor agonists on LPS-induced neuronal death in mixed cortical neurons:associated with iNOS and COX22[J].Brain Res,2002,941(1 -2):1 -10.
[10]隋海娟,金 英,潘月星,等.吡格列酮对脂多糖诱导的星形胶质细胞炎性细胞因子释放的影响[J].中国药理学通报,2010,26(9):1226-30.
[10] Sui H J,Jin Y,Pan Y X,et al.Effects of pioglitazone on the cultured cortical astrocytes induced by lipopolysaccharide expressions of inflammatory cytokines[J].Chin Pharmacol Bull,2010,26(9):1226-30.
[11]刘 卓,金 英,隋海娟,等.知母皂苷对Aβ25-35引起的巨噬细胞炎症介质释放的抑制作用及信号转导机制[J].中国药理学通报,2011,27(5):695 -700.
[11] Liu Z,Jin Y,Sui H J,et al.Effect and signaling mechanism of SAaB on the Aβ25-35-induced the release of inflammatory mediators in cultured macrophages[J].Chin Pharmacol Bull,2011,27(5):695-700.
[12]刘 卓,金 英,刘婉珠,等.知母皂苷对脂多糖引起的大鼠学习记忆障碍和炎症反应的影响[J].中国药理学通报,2010,26(10):1362-6.
[12] Liu Z,Jin Y,Liu W Z,et al.Effects of SAaB on LPS-induced learning and memory disorders and inflammatory reaction in rat hippocampus[J].Chin Pharmacol Bull,2010,26(10):1362 -6.
[13] Liu Z,Jin Y,Yao S Y,et al.Saponins from Anemarrhena asphodeloides Bge protect neurons from amyloid β-protein fragment 25-35-induced apoptosis[J].Chin J Pharmacol Toxicol,2006,20(4):295-304.
[14] Akhtar N,Haqqi T M.Epigallocatechin-3-gallate suppresses the global interleukin-1beta-induced inflammatory response in human chondrocytes[J].Arthritis Res Ther,2011,17;13(3):R93.
[15] Cui Y,Wu J,Jung S C,et al.Anti-neuroinflammatory activity of nobiletin on suppression of microglial activation[J].Biol Pharm Bull,2010,33(11):1814 -21.
[16] Blanco A M,Vallés S L,Pascual M,et al.Involvement of TLR4/type I IL-1 receptor signaling in the induction of inflammatory mediators and cell death induced by ethanol in cultured astrocytes[J].J Immunol,2005,15;175(10):6893 -9.
[17] Sato T,Hanyu H,Hirao K,et al.Efficacy of PPAR-γ agonist pioglitazone in mild Alzheimer disease[J].Neurobiol Aging,2011,32(9):1626-33.
[18] Heneka M T,Sastre M,Dumitrescu-Ozimek L,et al.Acute treatment with the PPARgamma agonist pioglitazone and ibuprofen reduces glial inflammation and Abeta1-42 levels in APPV717I transgenic mice[J].Brain,2005,128(Pt 6):1442 -53.

