PI3K/mTOR抑制剂BEZ235抑制HepG2细胞增殖及与阿霉素的协同效应
张显忠,郭爱军,廉立慧,姜红霞,史仁玖
(1.泰山医学院生物科学学院,山东泰安 271016;2.泰安市中心医院放射科,山东泰安 271000)
肝细胞癌是我国常见的恶性肿瘤之一,死亡率较高,发生发展受细胞内多条信号传导通路的精密调控[1-2]。磷脂酰肌醇 3-激酶(phosphatidylinositol-3-kinases,PI3K)信号通路参与细胞的增殖、凋亡和分化等过程,在肿瘤的发生发展中起着重要的作用[3-4]。BEZ235是磷酸肌醇 3 激酶(PI3K)和其下游因子哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)的双重靶向抑制剂,表现出良好的抑制多种实体瘤活性[5-7]。本研究以肝癌细胞
HepG2为实验材料,检测BEZ235的体外抗癌活性及与阿霉素(doxorubicin hydrochloride,DOX,adriamycin,ADM)协同抑癌作用,为肝细胞癌的临床治疗提供实验基础。
1 材料和方法
1.1 主要试剂 BEZ购自 Selleck Chemicals(Houston,TX,USA);RPMI 1640 培养基购自 Gibco(BRL,USA);胎牛血清购自 Lanzhou National Hy-Clone(Lan zhou,China);MTT购自 Genview(Houston,TX,USA);propidium iodine(PI)购自 Sigma;Annexin V-FITC购自南京凯基生物有限公司;ECL试剂盒购自 Thermo Scientific Pierce(Rockford,IL,USA)。Akt抗体、p-Akt抗体和 β-catenin抗体购自Cell Signaling;β-actin抗体购自Sigma;cyclinB1抗体和cyclinD1抗体购自Santa cruz;二抗均购自北京中杉金桥;DOX购自深圳万乐药业。
1.2 细胞株 人肝癌细胞株HepG2购自上海中科院细胞库。HepG2细胞于37℃和5%CO2条件下用RPMI 1640培养基培养,含有10%胎牛血清(兰州民海)、100 U·L-1青霉素和 100 μg·L-1硫酸链霉素。
1.3 MTT法测定细胞活力 胰酶消化HepG2细胞后接种于96孔板中,加入不同剂量的BEZ235继续培养,对照组加入PBS;终止培养前4 h加20 μl(5 g·L-1)的MTT于各个孔中,然后吸去培养液,加入150 μl的DMSO后室温振荡10 min;490 nm波长下测定各孔的A值,以同样的方法测6个平行孔,对结果进行统计分析。
1.4 流式细胞术检测细胞周期与凋亡 细胞用BEZ235处理后,胰酶消化并制备细胞悬液;加入75%的冷无水乙醇4℃固定18 h后用PBS洗2次,加入终浓度为50 mg·L-1的 RNase A,37℃ 30 min,加入终浓度为 50 mg·L-1的 PI,4℃闭光染色 20 min后上机检测。用Cell Quest软件分析各组细胞的周期分布,分析G0/G1期、S期和G2/M期细胞所占比例。同时按照试剂盒说明进行 AnnexinⅤ-FITC/PI法测定细胞凋亡,根据AnnexinⅤ和PI的荧光强度计算凋亡百分率。实验重复3次。
1.5 免疫印迹分析 预冷PBS洗细胞2次后加细胞裂解液(10 mmol·L-1Tris-HCl pH 8.0,1 mmol·L-1EDTA,150 mmol·L-1NaCl,1%NP-40,1 mmol· L-1PMSF,0.5% SDS,protease inhibitor cock-tails),冰上放置20 min,4℃ 13 000×g离心20 min,收集上清定量分析。取40 μg总蛋白进行 SDSPAGE实验,电转移至PVDF膜上,5%脱脂奶粉封闭过夜,分别加入抗 Akt、p-Akt、β-actin、cyclinB1、cyclinD1、β-catenin、p-ERK 和 p-P38一抗;室温孵育3 h后加入对应的二抗室温孵育1 h,PBST洗膜,ECL显色试剂盒于暗室曝光显影。实验重复3次。
1.6 统计学分析 SPSS软件t检验分析实验结果,实验数据以±s表示。
2 结果
2.1 BEZ235抑制HepG2细胞内Akt的磷酸化
由于BEZ235是PI3K/Akt通路的抑制剂,因此本实验首先采用免疫印迹法检测了BEZ235对HepG2细胞中PI3K下游底物Akt磷酸化水平的影响。如Fig 1所示,BEZ235降低了HepG2细胞中Akt的磷酸化水平,且抑制作用呈剂量依赖性。
2.2 BEZ235抑制HepG2肝癌细胞的增殖 用BEZ235处理HepG2细胞72 h,MTT法每隔24 h检测细胞活力,结果见Fig 2,BEZ235具有抑制肝癌细胞增殖的活性,且呈时间和剂量依赖性。
流式细胞术检测BEZ235对细胞周期的影响,如图所示(Fig 3),HepG2细胞经BEZ235处理后,诱导细胞阻滞于G1期。但Annexin V-FITC/PI双标法检测BEZ235对HepG2细胞凋亡的影响。HepG2细胞经BEZ235作用24 h后,发现HepG2细胞的凋亡无明显变化(Fig 4)。
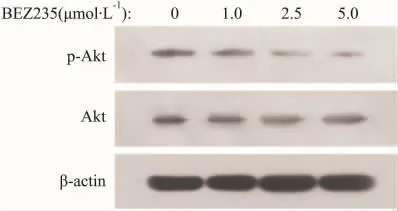
Fig 1 Akt phosphorylation in HepG2 cells inhibited by BEZ235
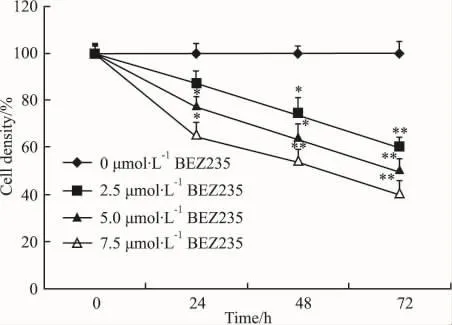
Fig 2 Effects of BEZ235 on HepG2 cell viability detected by MTT
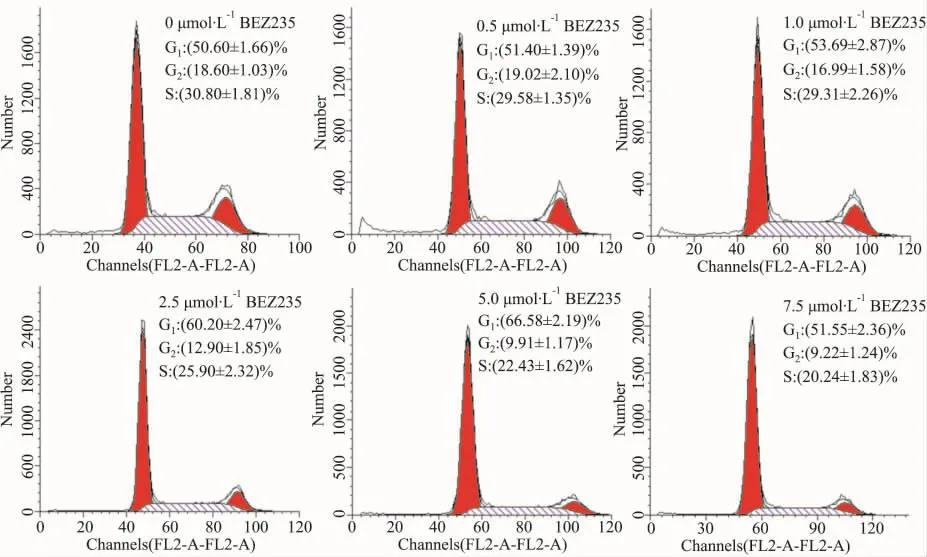
Fig 3 Effects of BEZ235 on HepG2 cell cycle detected by flow cytometry
2.3 BEZ235调节细胞内 cyclinB1和 cyclinD1蛋白表达水平 为了阐明BEZ235阻滞细胞周期的可能机制,采用免疫印迹法分析了细胞内cyclinB1和cyclinD1的蛋白水平,发现BEZ235对细胞周期的调控与cyclinD1相关,而对cyclinB1的表达无影响(Fig 5)。

Fig 4 Effects of BEZ235 on cell apoptosis detected by Annexin V/PI double staining

Fig 5 Effects of BEZ235 on expression level of cyclin B,and cyclinD,in HepG2 cells detected by western blot
2.4 BEZ235对 DOX抑癌活性的协同作用BEZ235与 DOX联合应用后,从抑制曲线上看,BEZ235明显提高了DOX对HepG2细胞的抑制作用,根据CDI计算方法[8],除了低剂量组外(BEZ235=0.5 μmol·L-1DOX=0.5 mg·L-1),其他两组联合用药的CDI均小于1,提示BEZ235联合应用DOX具有协同效应。
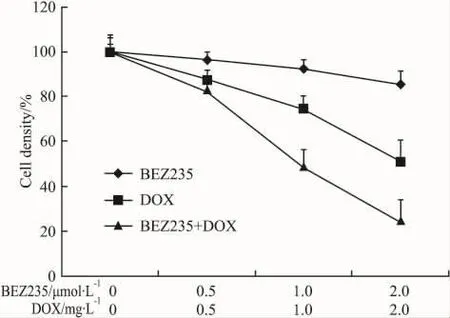
Fig 6 Synergistic effects of BEZ235 combined with DOX on HepG2 cells
2.5 BEZ235与DOX的联合应用抑制细胞内βcatenin表达 为了进一步探讨BEZ235与DOX协同抑癌效应的分子机制,采用免疫印迹实验检测了HepG2细胞内β-catenin和MAPK通路因子p-ERK、p-p38的表达水平变化,发现BEZ235与DOX的联合应用明显抑制细胞内β-catenin的表达,ERK和p38的磷酸化水平未见明显变化。
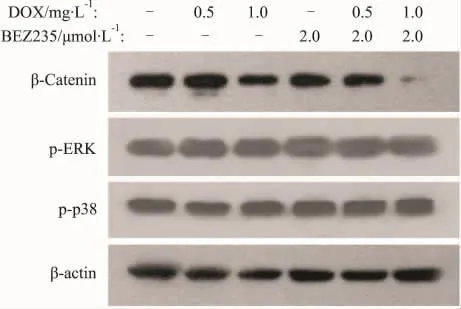
Fig 7 Inhibition of β-catenin expression in HepG2 cells by BEZ235 combined with Dox
3 讨论
研究发现,PI3K/Akt/mTOR信号通路不仅参与调节细胞的增殖、凋亡和代谢等生命过程,该途径的过度活化还与肿瘤的耐药性有着密切的联系,可降低肿瘤细胞对化疗药物的敏感性[9-11]。因此,研究PI3K/Akt/mTOR信号通路的特异性抑制剂对癌症的临床治疗具有重要的意义。以PI3K的p110催化亚基为靶点的LY294002和wortmannin与化疗药物联合使用能够有效地增加化疗药物的作用并降低毒性[12],表明PI3K抑制剂与传统化疗药物的联用为肿瘤患者的耐药现象提供了更好的选择。
本研究首先检测PI3K/Akt抑制剂BEZ235对HepG2细胞中Akt磷酸化水平的影响,发现BEZ235具有抑制S473p-Akt的活性,同时抑制了肝癌细胞的增殖,且抑制作用具有时间和剂量依赖性。为了进一步阐明BEZ235抑制肝癌细胞增殖的分子机制,流式细胞术分析了BEZ235对细胞周期的影响,发现HepG2细胞经BEZ235处理后,细胞阻滞于G1期。免疫印迹实验表明BEZ235诱导肝癌细胞周期的阻滞与抑制cyclinD1的表达密切相关。磷脂酰丝氨酸外翻分析法结果表明检测BEZ235对HepG2细胞无明显凋亡诱导活性,意味着BEZ235的抗肿瘤活性主要表现在其抑制肿瘤细胞的增殖。
DOX是临床上常用的蒽醌类化疗药物,本研究首次将BEZ235与DOX联合应用处理肝癌细胞,发现BEZ235能够促进DOX的抑癌活性,其机制涉及抑制β-catenin表达。β-catenin是由781个氨基酸组成的单链蛋白质,是Wnt通路的关键因子,可通过Wnt/Frizzled受体通路促进原癌基因的激活,并诱导细胞癌变和肿瘤发生。本研究发现BEZ235与DOX的联合应用抑制β-catenin的表达水平,提示BEZ235与DOX的协同作用可能与调控HepG2细胞内的β-catenin通路相关。另外,β-catenin的高表达与肿瘤的转移和耐药性也相关。因而提示,BEZ235与DOX联合,除产生协同相应外,还可能防治肿瘤转移和耐药发生。
总之,BEZ235能够抑制HepG2肝癌细胞中Akt的磷酸化水平,并抑制细胞的增殖,其机制与调节细胞周期相关蛋白cyclinD1的表达水平有关;BEZ235和DOX的联用对人肝癌细胞株HepG2细胞的生长抑制具有协同作用,其机制与抑制细胞中β-catenin的表达相关。
[1]Villanueva A,Llovet J M.Targeted therapies for hepatocellular carcinoma[J].Gastroenterology,2011,140(5):1410-26.
[2]Rahbari N N,Mehrabi A,Mollberg N M,et al.Hepatocellular carcinoma:current management and perspectives for the future[J].Ann Surg,2011,253(3):453-69.
[3]黄 成,李 俊,马陶陶.PI3K/Akt信号通路与肝纤维化[J].
中国药理学通报,2011,27(8):1037-41.
[3]Huang C,Li J,Ma T T.PI3K/Akt signaling pathway and liver fibrosis[J].Chin Pharmacol Bull,2011,27(8):1037- 41.
[4]Li L,Wei X H,Pan Y P,et al.LAPTM4B:a novel cancer- associated gene motivates multidrug resistance through efflux and activating PI3K/AKT signaling[J].Oncogene,2010,29(43):5785-95.
[5]Herrera V A,Zeindl-Eberhart E,Jung A,et al.The dual PI3K/mTOR inhibitor BEZ235 is effective in lung cancer cell lines[J].Anticancer Res,2011,31(3):849-54.
[6]Santiskulvong C,Konecny G E,Fekete M,et al.Dual targeting of phosphoinositide 3-kinase and mammalian target of rapamycin using NVP-BEZ235 as a novel therapeutic approach in human ovarian carcinoma[J].Clin Cancer Res,2011,17(8):2373-84.
[7]Liu T J,Koul D,LaFortune T,et al.NVP-BEZ235,a novel dual phosphatidylinositol 3-kinase/mammalian target of rapamycin inhibitor,elicits multifaceted antitumor activities in human gliomas[J].Mol Cancer Ther,2009,8(8):2204-10.
[8]Wang D,Wang Z,Tian B,et al.Two hour exposure to sodium butyrate sensitizes bladder cancer to anticancer drugs[J].Int J Urol,2008,5:435-41.
[9]Butt A J.Overcoming resistance:Targeting the PI3K/mTOR pathway in endocrine refractory breast cancer[J].Cancer Biol Ther,2011,11(11):947-9.
[10]Li L,Wei X H,Pan Y P,et al.LAPTM4B:a novel cancer-associated gene motivates multidrug resistance through efflux and activating PI3K/AKT signaling[J].Oncogene,2010,29(43):5785-95.
[11]熊 飞,詹 瑧,唐于平,等.PI3K/Akt信号转导通路在非小细胞肺癌中的作用[J].中国药理学通报,2010,26(10):1264-7.
[11]Xiong F,Zhan Z,Tang Y P,et al.The effect of PI3K/Akt signal transduction pathway in non- small cell lung cancer[J].Chin Pharmacol Bull,2010,26(10):1264-7.
[12]Wu D,Tao J,Xu B,et al.Phosphatidylinositol 3-kinase inhibitor LY294002 suppresses proliferation and sensitizes doxorubicin chemotherapy in bladder cancer cells[J].Urol Int,2011,86(3):346-54.

