晚期NSCLC患者外周血中EGFR突变检测预测靶向治疗的疗效观察
孙德弢 杜开齐 朱有才
武警浙江省总队医院胸心外科,浙江 嘉兴 314000
约70%的非小细胞肺癌 (non-small cell lung cancer,NSCLC)患者在确诊时已处于晚期。研究发现表皮生长因子受体(epidermal growth factor receptor,EGFR)酪氨酸激酶结构域发生突变的NSCLC对靶向药物的敏感性大为提高[1]。对具有EGFR突变的NSCLC患者,吉非替尼比起化疗,死亡风险降低了52%,而厄洛替尼也可使50%的具有EGFR突变晚期NSCLC患者生存2年以上。但临床上由于部分患者获取病理标本有难度,所以传统EGFR突变检测方法具有局限性。外周血取材方便,通过血清检测EGFR突变,如能达到与组织检测相近的结果,那么则更有临床实际意义。2008年1月~2012年3月笔者应用高分辨溶解曲线分析 (high-resolution melting analysis,HRM)技术,探讨检测外周血EGFR突变与晚期NSCLC一线口服吉非替尼治疗的疗效之间的关系。
1 资料与方法
1.1 一般资料
本组64例患者,其中男21例,女43例,年龄42~76岁,平均61.3岁。所有患者均为初治,经胸腹部CT、头颅核磁共振、全身骨ECT等检查,确定临床分期为Ⅲ~Ⅳ期NSCLC患者。病理学分型:鳞癌12例,腺癌49例,非小细胞低分化癌3例。
1.2 方法
1.2.1 血浆循环DNA提取与HRM检测 经前臂静脉采集外周血液5 mL,置洁净抗凝离心管,4℃离心10 min,吸取上清液转移至1.5 mL离心管中,于4℃下离心10 min,分装后置-80℃冰箱中保存。解冻后,按高通量血液DNA提取试剂盒操作说明提取DNA,溶于50 μL灭菌水中。经微量紫外可见分光光度计测定DNA纯度及含量,提取的DNA放置-20℃冰箱储存。设计上下游引物。PCR反应条件为96℃ 2 min,96℃5 s,60℃ 5 s,72℃ 25 s,45 个循环。PCR 扩增完后,扩增产物进行HRM 分析。HRM 分析条件:95℃ 5 min,40℃ 2 min,60℃1 min,然后以0.1℃/s的速度从65℃升温至95℃收集溶解曲线数据,进行实时数据分析。
1.2.2 治疗方法 对检测出存在EGFR基因突变的患者(A组)口服吉非替尼250 mg/d,服药时间最短2个月,最长32个月。对检测不存在EGFR基因突变的患者(B组)给予多烯紫杉醇加顺铂化疗,疗程4~6个。在初始治疗期间不采用其他的抗肿瘤治疗,直到肿瘤进展或患者不能耐受药物不良反应而终止治疗。对于脑转移及孤立的骨转移灶行放疗。
1.3 疗效评价标准
疗效分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、稳定(stable disease,SD)和进展(progressive disease,PD),CR和PR要在距离首次评价至少 4周后再次确认,计算有效率(response rate,RR)和疾病控制率(disease control rate,DCR)。定期复查胸腹部CT、头颅增强MRI及全身同位素骨扫描,进行疗效判定。无进展生存期(Progressive-free survival,PFS)为患者开始治疗直至PD的时间。 RR=(CR+PR)/总数×100%。
1.4 统计学方法
采用统计软件SPSS 20.0对实验数据进行分析,计数资料以率表示,采用χ2检验,采用Kaplan-Meier法分析两组患者的生存率差异,以P<0.05为差异有统计学意义。
2 结果
64例患者中,有24例(37.5%)可检测出外周血EGFR突变,5例患者因各种原因未进行吉非替尼治疗,其余19例患者治疗后CR+PR为13例,RR为68.4%,DCR为73.7%,中位PFS为12.0个月;在未检出突变的40例患者中,8例患者因各种原因未进行化疗,其余32例患者化疗后CR+PR为12例,RR为37.5%,DCR为43.8%,中位PFS为7.3个月。A组的RR与B组比较,差异有统计学意义 (χ2=4.561,P=0.033),A组的 DCR与 B组比较差异有统计学意义 (χ2=4.314,P=0.038)。 经 log-rank 检验,Kaplan-Meier生存曲线分析显示,A组的生存率高于 B组 (图 1)(χ2=7.406,P=0.006)。
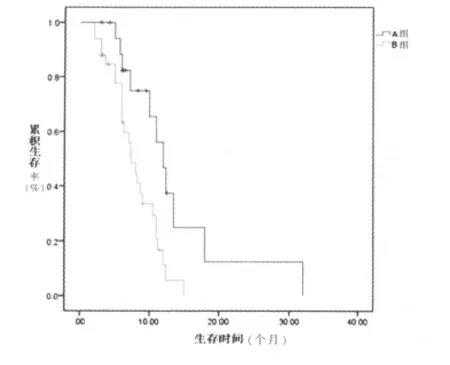
图1 两组PFS的Kaplan-Meier生存曲线
3 讨论
2008年被美国临床肿瘤学会列为肺癌主要进展的血清检测EGFR突变研究,成功拓展了组织取材范围,使得EGFR检测的临床实用性更强。本研究所采用的HRM检测技术原理是在一定的温度范围内将PCR扩增的产物进行变性,期间实时检测体系内荧光信号。荧光值随着温度变化,可绘制溶解曲线。每一段DNA都有其独特的序列,因而也就有了独特的溶解曲线形状,如同DNA指纹图谱一样,具有很高的特异性、稳定性和重复性。国内学者[2-3]应用HRM法检测肺癌患者血浆EGFR基因突变,经基因测序法验证,结果具有高度相关性。本组中有24例(37.5%)可检测出外周血EGFR突变,可能与腺癌、女性比例较高有关。
肺癌传统的化疗由于缺乏特异性,取得疗效的同时也往往给患者带来较大的毒副作用,其有效率仅为30%~40%。因此,选择肺癌细胞特异的分子靶点进行治疗,在取得明显疗效的同时,又可以避免对正常细胞的损害。晚期NSCLC的个体化治疗将成为肺癌临床治疗的新模式。Wu等[4]研究表明EGFR突变亚组吉非替尼的无进展生存时间明显优于紫杉醇加卡铂。Sirera等[5]的研究中对EGFR敏感突变(19和21外显子突变)的患者,均给予厄洛替尼治疗,总体生存率较化疗延长了2~3倍,客观有效率远远高于常规化疗。本研究结果也表明A组的RR和DCR与B组比较差异均具有统计学意义(均P<0.05)。Kaplan-Meier生存曲线显示,A组的生存率高于B组(P<0.05)。检测EGFR基因突变对于实现个体化治疗具有重要意义,对EGFR突变状态不明的患者盲目使用这类靶向药物,会增加EGFR野生型患者的疾病进展风险。一线靶向药物选择的关键是如何更准确、方便、有效地筛选出EGFR突变患者,这是一线靶向治疗获益的基本保证。然而,临床上晚期患者病理标本获取率较低,制约了一线靶向治疗的应用。周小昀等[6]认为外周血EGFR突变检测结果与临床评估分子靶向治疗疗效较为符合。本研究结果也表明对不能够获得足够病理标本的患者通过血清检测EGFR突变状态,在治疗上具有一定的指导意义。
[1]Paez JG,Janne PA,Lee JC,et al.EGFR mutations in lung cancer:correlation with clinical response to gefitinib therapy [J].Science,2004,304(5676):1497-1500.
[2]高菲,师建国,魏金花,等.HRM法检测肺癌EGFR基因突变[J].现代肿瘤医学,2011,19(6):1089-1092.
[3]赵瑾,彭群新,杨炳华,等.应用HRM法检测肺癌患者循环DNA中表皮生长因子受体基因突变[J].中华医学杂志,2011,19(10):674-678.
[4]Wu YL,Chu DT,Han B,et al.Phase Ⅲ,randomized,open-label,firstline study in Asia of gefitinib versus carboplatin/paclitaxel in clinically selected patients with advanced non-small-cell lung cancer:evaluation of patients recruited from mainland China [J].Asia Pac J Clin Oncol,2012,8(3):232-243.
[5]Sirera R,Gil M,Blasco A,et al.Retrospective analysis of the prognostic role of p16 protein inactivation in plasma in patients with locally advanced non-small cell lung cancer [J].Lung Cancer,2008 ,61(1):104-108.
[6]周小昀,李龙芸,崔巍,等.检测肺癌患者血清游离DNA的EGFR基因点突变与 EGFR-TKI疗效的相关性分析[J].癌症进展,2011,9(1):13-18.

