围术期抗血小板药物对外周动脉手术出血的影响
张国伟 郁正亚
首都医科大学附属北京同仁医院普外科,北京 100730
外周动脉疾病(peripheral arterial disease,PAD)是全身动脉粥样硬化的局部表现,常累及颈动脉及下肢动脉。此类患者多同时合并心脑血管疾病,抗血小板为其基本治疗方法之一。随着社会经济发展与人口老龄化,PAD在60岁以上人群中的发病率逐年上升。近年来,冠状动脉支架技术广泛应用于临床。据统计,约90%接受经皮冠脉介入治疗(percutaneous coronary intervention,PCI)的急性冠脉综合征患者需要放置支架,据统计约有5%患者在支架植入1年内将经历非心脏手术治疗[1],而约10%的PAD患者在发病5年内需接受术治疗[2]。围术期抗血小板药物的使用可能对麻醉和围术期出血带来一定的风险,而过早停用抗血小板药物又可能引起支架内血栓形成。本研究拟对PAD手术患者围术期如何安全使用抗血小板药物进行探讨。
1 资料与方法
1.1 一般资料
选择我院2006~2010年择期接受外周动脉手术的患者81例进行回顾性研究,其中男43例,年龄37~72岁,平均(56±9)岁;女 38 例,年龄 35~67 岁,平均(52±7)岁。根据手术时是否服用抗血小板药物分为未用药物组29例,阿司匹林组27例及阿司匹林联合氯吡格雷组25例,三组患者年龄、性别及手术类型等一般资料差异均无统计学意义(均P>0.05),见表1、2。同时排除以下条件的患者:①急性动脉栓塞;②免疫或凝血系统异常。所有服药患者围术期均不停药,术中患者均静脉肝素化(100 U/kg),所有患者均由同组手术医师主刀实施手术治疗。本研究已经医院伦理委员会通过,患者均已经知情同意。
1.2 观察指标
比较三组患者术前及术后第2天的部分凝血活酶活化时间(APTT)、国际标准化比值(INR)、血小板计数(PLT)、血红蛋白(HB)、血细胞比容(HCT)、同时记录手术时间、术中出血量、术中是否输血以及术后血肿发生率。
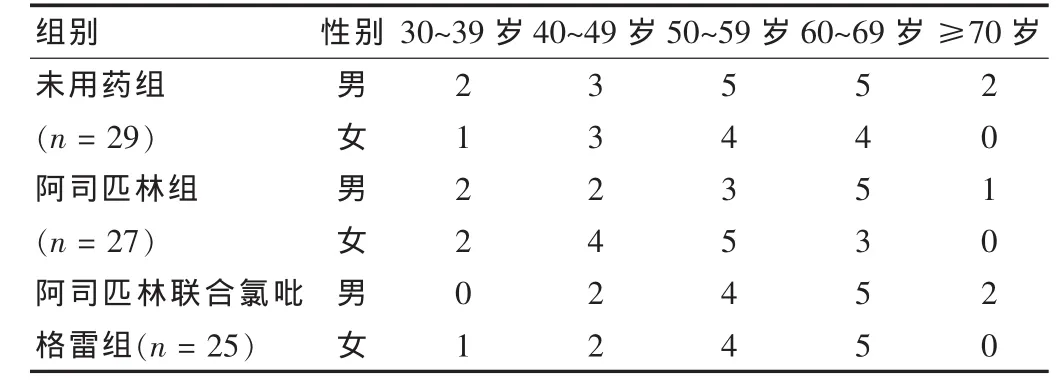
表1 患者基本情况(例)

表2 三组患者手术类型(例)
1.3 统计学方法
采用统计软件SPSS 13.0对实验数据进行分析,计量资料数据以均数±标准差()表示,组间比较采用方差分析,两两比较采用LSD-t检验。计数资料以率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 三组患者术前及术后第2天化验指标比较
三组患者术前及术后第2天APTT、INR、PLT、HCT均无明显变化(均P>0.05),术后HB较术前有所减少,但均在正常范围内。见表3。
表3 三组患者术前及术后第2天化验指标比较()
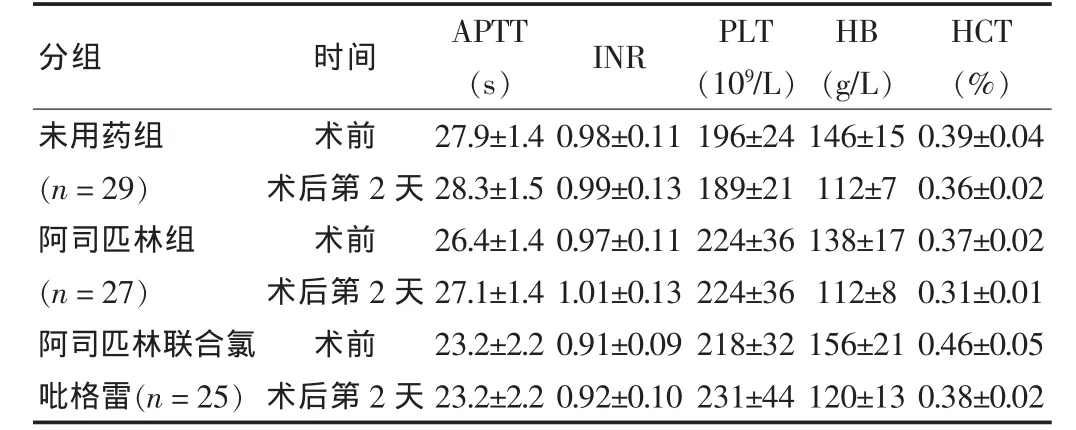
表3 三组患者术前及术后第2天化验指标比较()
2.2 三组患者手术指标比较
未服药组及阿司匹林组手术时间、术中出血量差异均无统计学意义(均P>0.05),阿司匹林联合氯吡格雷组术中出血量与前两组比较显著增多,手术时间较前两者有延长(均P<0.05)。三组所有患者均未输血,阿司匹林联合氯吡格雷组术后并发血肿较另两组有所增加(P<0.05),未服药组及阿司匹林组均未发生术后血肿,见表4。
3 讨论
血栓形成是指在一定条件下血液有形成分在血管或心脏内膜局部形成栓子的过程,依血栓组成成分可分为血小板血栓、红细胞血栓、纤维蛋白血栓及混合血栓等。血小板在动脉血栓形成过程中发挥关键作用,当血管内皮损伤时血小板在局部发生黏附,聚集并释放内源性二磷酸腺苷(ADP)、5-羟色胺(5-HT)、血小板因子 4(PF4)、β-血小板球蛋白(β-TG)及血小板α颗粒膜蛋白等活性物质,促进血小板聚集和血管收缩,同时血小板膜的花生四烯酸转化为血栓素(TX),进一步使血小板聚集、血管收缩形成附壁的血小板血栓,血栓在血流中经过反复冲刷、破坏和重新形成,并可逐渐增大,使受累血管腔变窄乃至闭塞。当Ⅱ型高脂蛋白血症、心绞痛、心肌梗死、脑梗死、糖尿病伴微血管病变时血小板黏附性、聚集性和释放产物增加,促使血栓形成。抗血小板药是一类能抑制血小板黏附、聚集和释放功能的药物,通过抑制血小板的聚集,在临床上主要用于防治血栓形成和发展。临床研究证实疗效确切的抗血小板类药物包括:①阿司匹林;②噻吩吡啶类药物;③血小板膜糖蛋白(GPⅡb/Ⅲa)受体拮抗剂;④选择性增加血小板内cAMP的药物;⑤非噻吩并吡啶P2Y12受体拮抗剂。阿司匹林阻断血小板合成TXA2而发挥抗血小板聚集作用,是抗血小板治疗的基础用药。氯吡格雷可抑制血小板相互聚集,能有效减少动脉血栓事件风险[3],目前阿司匹林和氯吡格雷的联合应用已成为抗血小板治疗的标准方法。
表4 三组患者手术指标比较()

表4 三组患者手术指标比较()
注:与未用药组和阿司匹林组比较,*P<0.05
分组 术中出血量(mL)手术时间(h)输血量(mL)术后血肿(%)未用药组(n=29)阿司匹林组(n=27)阿司匹林联合氯吡格雷(n=25)17±630±11190±32*1.7±0.12.2±0.33.5±0.4*0000012*
PAD是血栓性疾病之一,是心血管疾病发生和死亡率的一个危险标识,多长期应用抗血小板药物,不论患者是否具有间歇性跛行等典型临床症状,在长期服用阿司匹林后可使心肌梗死、脑血管意外及心源性死亡等严重的血管事件发生率降低23%(P=0.004)[4]。给予健康人群阿司匹林隔天325 mg可降低外周血管外科手术率46%[5]。阿司匹林是效果稳定且安全可靠的一线抗血小板药物,氯吡格雷作为替代药物同样具有强有力的抗血小板作用。研究证实两种药物单独应用均具有良好的预防心肌梗死、脑血管意外及心源性死亡作用,有效减少不良心血管事件的发生[6]。氯吡格雷更能有效地降低缺血性事件联合终点(缺血性卒中、心肌梗死、心血管性死亡)。约10%的PAD患者在发病5年内需接受手术治疗[2]。作为全身动脉粥样硬化的一部分,冠心病患者多同时伴有PAD。约有5%患者在支架植入1年内可能因其他疾病经历非心脏手术治疗,若此期间停用抗血小板药物,易导致支架内血栓形成,有诱发再次心肌梗死的风险,原因是球囊扩张以及支架的机械压迫使动脉内皮细胞表面暴露、损害动脉中层或刺入脂质核心,引起炎症反应和血小板活化,增加了支架内血栓形成的风险。术前暂停抗血小板药物且当手术或其他侵入性操作激活凝血系统时可能导致反弹的循环系统高凝状态,从而进一步增加血栓形成的风险[7]。因此对于高出血风险手术如颅内或脊柱等封闭空间手术、外周大动脉手术、矫形外科手术、大型肿瘤手术以及前列腺膀胱手术等[8],如同时合并心血管疾病且正进行抗血小板治疗者,其围术期出血仍然是外科医生和麻醉科医生十分关注的问题。
传统观点认为抗血小板药物可导致出血时间延长,使术中出血量增加,增加手术风险。阿司匹林和氯吡格雷虽抗血小板作用机制不同,但均能够不可逆地抑制血小板功能,延长出血时间,人类血小板的平均寿命周期为7~10 d,每24小时有10%~12%的血小板被更新,因此血小板的功能要在停用抗血小板药物7~10 d后才能够完全恢复。小剂量阿司匹林可增加出血并发症1.5倍。单用阿司匹林或氯吡格雷使手术出血风险增加约20%,而双联抗血小板治疗使手术出血风险增加约50%。围术期使用抗血小板药物无疑会增加岀血的风险。长期接受抗血小板治疗的患者因大出血导致死亡的发生率高达8%[9];另一方面,术后出血可能增加伤口感染、输血或再手术发生率,导致术后抗血小板治疗时间推迟,增加血栓风险。与单用阿司匹林相比较,阿司匹林和氯吡格雷的双重抗血小板治疗使严重出血的风险增加4%~6%。已有研究者总结了给予阿司匹林、噻吩吡啶和GPⅡb/Ⅲa抑制剂治疗后的手术出血风险[10]。接受非心脏手术(包括普外科、妇科、泌尿科和皮肤外科手术)患者因口服阿司匹林导致出血时间延长,故术中失血增加,但另一项研究未显示口服阿司匹林会造成患者接受急诊普外科手术时出血并发症风险增加[11],针对此问题该研究者得出结论,行择期非心脏手术时不必常规停用阿司匹林。Riddell等[12]回顾了关于比较停用小剂量阿司匹林的风险与出血风险方面的外科文献,发现大部分手术中小剂量阿司匹林可造成术中出血增加,但是严重出血并发症或出血并发症导致的围术期死亡率并没有增加。
血管外科手术创面和吻合口是容易发生出血的部位。本研究结果显示,三组患者术后HB较术前有减少,但均在正常范围,组间比较,未服药组及阿司匹林组手术时间、术中出血量差异无统计学意义(P<0.05),阿司匹林联合氯吡格雷组术中出血量比前两组显著增多(P<0.05),一定程度上增加了手术难度,术后血肿发生率较该两组有所增加 (P<0.05)。所有患者术中术后均未输血。结合本次研究结果,笔者认为PAD患者行手术治疗时不必常规停用阿司匹林,术后可以尽早恢复抗血小板治疗,对于急诊手术无需因口服阿司匹林推迟手术。阿司匹林和氯吡格雷的双重抗血小板治疗患者,术中出血量要多于未用药组及阿司匹林组,手术时间有所延长,术后血肿发生率较前两者有所增加,与Fax等[13]的研究结果近似。围术期双联抗血小板患者,建议在择期手术前5~7 d停用口服氯吡格雷,单一阿司匹林抗血小板治疗。若患者由于心脏冠脉放置DES支架且恰好在双联抗血小板治疗窗口内,应推迟传统PAD手术或对其进行血管腔内介入治疗。紧急情况必须手术且无法停药时,若发生围术期大出血,可考虑输注血小板。
Llau等[14]指出,对于进行抗血小板治疗的患者行手术治疗,术前麻醉医师、外科医师、心血管医师均应针对患者出血和血栓风险对患者进行评估,确定手术的风险级别。对于高出血风险患者的择期手术,如同时伴随中、高血栓形成风险,且需实施封闭空间内出血可能的手术(神经外科、脊柱外科、眼后节手术)则推迟择期手术。中等出血风险患者的择期手术(如需要输血的心脏、骨科或泌尿外科手术),如有高血栓风险,应推迟外科手术,若只有低血栓形成风险,可以继续使用阿司匹林,术前3~5 d停用氯吡格雷,若有中等血栓风险,可以继续使用阿司匹林直至手术前1 d,并在手术结束后24 h内给予首剂阿司匹林。对于低出血风险患者的择期手术(如不需要输血的小型整形/普通外科、骨科手术,活检、拔牙、眼前节手术),若血栓风险高,维持使用阿司匹林,如果患者使用噻氯吡啶类药物,建议术前10 d将其替换为阿司匹林并维持使用。如果必须双联使用则在术前1~5 d停用氯吡格雷。
外周血管手术应用抗血小板药物时必须权衡出血风险和血栓发生风险,注意抗血小板药物的个体化治疗,应综合考虑患者特殊疾病背景、所施行的不同手术方式等综合临床情况来制订合理的抗血小板治疗计划。由本研究可以看出,单用阿司匹林患者行择期外周动脉疾病手术不必常规停用阿司匹林,仅在出血风险明显高于动脉血栓形成事件风险时才能停用,应用阿司匹林联合氯吡格雷患者需权衡术中出血风险。
[1]Vicenzi MN,Meislitzer T,Heitzinger B,et al.Coronary artery stenting and non-cardiac surgery-a prospective outcome study[J].Br J Anaesth,2006,96(6):686-693.
[2]Diehm C,Schuster A,Allenberg JR,et al.High prevalence of peripheral arterial disease and co-morbidity in 6880 primary care patients:crosssectional study[J].Atherosclerosis,2004,172(1):95-105.
[3]Ishii H,Kumada Y,Toriyama T.Cilostazol improves long-term patency afterper-cutaneous transluminalangioplasty in hemodialysis patients with peripheralartery disease[J].Clin J Am Soc Nephrol,2008,3(4):1034-1040.
[4]Mohler ER.Combination antiplatelet therapy in patients with peripheral arterial disease:is the best therapy aspirin,clopidogrel,or both?[J].Catheter Cardiovasc Interv,2009,74(Suppl 1):S1-S6.
[5]Henke P.What is the optimum perioperative drug therapy following lower-extremity vein bypass surgery[J].Semin Vasc Surg,2009,22(4):245-251.
[6]Njaman W,Miyauchi K,Kasai T,et al.Impact of aspirin treatment on long-term outcome (over 10 years)after percutaneous coronary intervention[J].Int Heart J,2006,47(1):37-45.
[7]Cundiff DK.Clinical evidence for rebound hypercoagulability after discontinuing oral anticoagulants for venous thromboembolism [J].Medscape J Med,2008,10(11):258.
[8]Douketis JD,Berger PB,Dunn AS,et al.The perioperative management of antithrombotic therapy:American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition)[J].Chest,2008,133(Suppl 6):S299-S339.
[9]Linkins LA,Choi PT,Douketis JD.Clinical impact of bleeding in patients taking oral anticoagulant therapy for venous thromboembolism:a meta-analysis[J].Ann Intern Med,2003,139(11):893-900.
[10]Mirritt JC,Bhatt DL.The efficacy and safety of perioperative antiplatelet therapy[J].J Thromb Thrombolysis,2004,17(1):21-27.
[11]Burger W,Chemnitius JM,Kneissl GD,et al.Low-dose aspirin for secondary cardiovascular prevention-cardiovascular risks after its perioperative withdrawal versus bleeding risks with its continuation-review and meta-analysis[J].J Intern Med,2005,257(5):399-414.
[12]Riddell JW,Chiche L,Plaud B,et al.Coronary stents and noncardiac surgery[J].Circulation,2007,116(16):e378-e382.
[13]Fox KA,Mehta SR,Peters R,et al.Benefits and risks of the combination of clopidogrel and aspirin in patients undergoing surgical revascularization for non-ST-elevation acute coronary syndrome:the Clopidogrel in Unstable angina to prevent Recurrent ischemic Events (CURE)Trial[J].Circulation,2004,110(10):1202-1208.
[14]Llau JV,Lopez-Forte C,Sapena L,et al.Perioperative management of antiplatelet agents in noncardiac surgery[J].Eur J Anaesthesiol,2009,26(3):181-187.

