外源性甲状腺素对梗阻性黄疸大鼠肝脏纤维化的保护作用研究
周志伟 莫海山 黎民宇 董启超 樊津瑞 高 原
广东省珠海市人民医院,广东 珠海 519040
肝脏是体内激素代谢的主要场所,大部分激素在肝脏灭活,或者与肝脏合成的转运蛋白结合后执行生理功能,在肝脏功能损伤时,多伴有体内激素代谢异常,甲状腺激素是体内生理作用最为广泛的内分泌激素之一,其代谢及转运均需肝脏合成的蛋白参与,在肝硬化等严重肝病时,甲状腺激素的代谢多出现异常[1],梗阻性黄疸是临床常见的肝脏功能损伤原因,梗阻性黄疸不仅能够引起肝脏组织坏死等急性损伤,在梗阻持续存在时,能够引起肝脏胆汁性纤维化及硬化,引起肝脏的合成及储备能力下降,本文就梗阻性黄疸大鼠肝脏损伤时甲状腺激素代谢情况以及外源性甲状腺激素对肝脏功能及纤维化损伤的保护作用进行研究。
1 材料与方法
1.1 主要仪器及试剂
促甲状腺激素(thyroid stimulating hormone,TSH)、游离甲状腺素(FT3、FT4)放免试剂盒(天津原子能公司),层粘连蛋白(laminin,LA)、透明质酸酶(hyaluronidase,HA)、Ⅲ型前胶原(type Ⅲ procollagen,PC-Ⅲ)及Ⅳ型胶原(type Ⅳcollagen,Ⅳ-C)检测试剂盒(天津原子能公司),超氧化物歧化酶(super oxygen dehydrogenises,SOD)、丙二醛(methane dicarboxylic aldehyde,MDA)检测试剂盒(浙江碧云天生物试剂公司),大鼠甲状腺素(南京建成生物工程研究所)。放免计数仪(天津原子能公司),分光光度计(常州医用仪器厂)。
1.2 动物及分组与造模
32 只雄性 SD 大鼠,清洁级,6~8 周龄,体重(200±25)g,南方医科大学实验动物中心提供,大鼠室温饲养适应环境后随机数字表发分为四组,对照组、梗黄组、高剂组及低剂量组,梗黄组、高剂组及低剂量组大鼠采用胆总管结扎离断法建立梗阻性黄疸大鼠模型[2],对照组大鼠仅开腹翻动肝脏、游离胆总管后关腹。造模后各组大鼠分笼饲养,自由饮水,定量给食,间断光照,室温维持在20℃,高剂量组及低剂量组分别给予腹腔注射甲状腺素,高剂量组给予 1 mL/(kg·d)(20 μg/mL)低剂量组给予 1 mL/(kg·d)(10 μg/mL), 对照组及梗黄组每日腹腔注射生理盐水1 mL,连续给药4周。
1.3 标本采集
大鼠造模4周后,苯巴比妥麻醉后剪开心脏取血,分离血清后低温保存,摘取肝脏组织,肝中叶组织冰冻保存,其余肝脏组织10%甲醛固定后石蜡包埋。
1.4 肝组织匀浆制备
幼鼠处死后立即开腹采集肝脏标本,制备肝组织匀浆,冰盐水漂洗、剪碎,制备组织匀浆,匀浆介质(蒸馏水1000 mL,pH 7.4,EDTA-2Na 0.01 mol/L,Tris-HCl 0.1 mmol/L,0.8%NaCl溶液,蔗糖 0.01 mmol/L),组织匀浆后低温高速离心(4000 g),吸取上清液2 mL冰冻保存待测。
1.5 标本检测
血清标本及肝组织匀浆标本解溶后进行检测,TSH、FT3、FT4、LA、HA、PC-Ⅲ及Ⅳ-C检测采用放免法, 肝组织匀浆MDA及SOD检测采用比色法,检测过程严格按照试剂及仪器使用说明书进行。
1.6 病理标本观察
肝脏石蜡包面组织蜡块采用4 μm厚度连续切片,常规HE染色,200目光镜观察并摄片。
1.7 统计学方法
数据处理采用SPSS 17.0汉语版统计学软件,计量资料数据以均数±标准差()表示,采用方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血清甲状腺激素水平比较
造模4周后,高剂量组、低剂量组、梗黄组血清TSH、FT3及FT4水平较对照组明显降低(均P<0.05),高剂量组、低剂量FT3、FT4下降程度较小,并且呈现剂量相关性。见表1。
表1 三组大鼠甲状腺激素水平比较()

表1 三组大鼠甲状腺激素水平比较()
注:与对照组比较,▲P<0.05;与梗黄组比较,▼P<0.05;与高剂量组比较,■P<0.05
2.2 各组大鼠肝组织氧化还原酶系活力比较
造模4周后,高剂量组、低剂量组、梗黄组肝组织匀浆SOD水平较对照组均下降(均P<0.05),MDA水平上升(均P<0.05),高剂量组、低剂量组肝组织匀浆SOD水平高于梗黄组(均 P<0.05),MDA 水平低于梗黄组(均 P<0.05),高剂量MDA水平低于低剂量组,SOD水平高于低剂量组,高剂量组及低剂量组之间SOD及MDA水平存在明显差异(均P<0.05)。
表2 各组大鼠肝脏匀浆组织氧化指标比较(,nmol/mL)

表2 各组大鼠肝脏匀浆组织氧化指标比较(,nmol/mL)
注:与对照组比较,▲P<0.05;与梗黄组比较,▼P<0.05;与高剂量组比较,■P<0.05
表3 各组大鼠肝脏组织匀浆肝纤维化指标比较(,ng/mL)
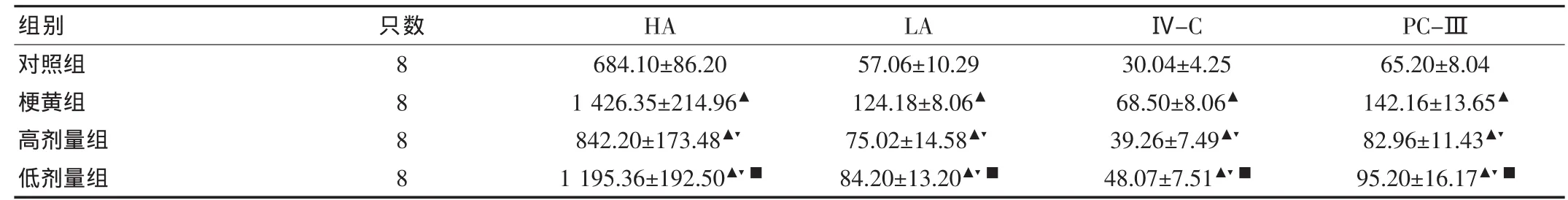
表3 各组大鼠肝脏组织匀浆肝纤维化指标比较(,ng/mL)
注:与对照组比较,▲P<0.05;与梗黄组比较,▼P<0.05;与高剂量组比较,■P<0.05
2.3 各组大鼠肝脏组织肝纤维化指标比较
造模4周后,高剂量组、低剂量组及梗黄组大鼠肝组织匀浆LA、HA、PC-Ⅲ及Ⅳ-C浓度较对照组均升高 (均P<0.05),高剂量组及低剂量组肝组织匀浆LA、HA、PC-Ⅲ及Ⅳ-C浓度低于梗黄组(均P<0.05),高剂量组肝组织匀浆LA、HA、PC-Ⅲ及Ⅳ-C浓度低于低剂量组(均P<0.05)。
2.4 各组大鼠肝脏组织结构比较
病理切片观察结果显示,对照组大鼠肝脏组织结构清晰,肝细胞排列规律;梗阻性黄疸组大鼠肝脏组织结构紊乱,纤维组织增多,肝脏小叶结构破坏,可见细胞变性坏死及炎细胞浸润;低剂量及高剂量组大鼠肝脏组织结构整齐,可见点状坏死及炎细胞浸润,低剂量组炎症细胞浸润较高剂量组略多。见图1~4。
3 讨论
梗阻性黄疸是临床常见疾病,梗阻性黄疸多由于胆总管的机械性梗阻引起的胆汁排泄障碍,伴随胆道压力的增高,胆汁发生反流,引起胆色素的代谢障碍,导致血液胆红素水平升高,胆色素具有细胞毒性,能够引起多器官系统的损伤。在梗阻性黄疸患者,多数都伴有明显的肝脏功能及结构的损伤,胆色素能够引起肝细胞蛋白激酶C介导的凋亡途径的激活,导致肝细胞凋亡[3]。同时能够引起肝脏内Toll样受体及Fas等凋亡相关基因的过度表达,引起细胞的凋亡[4],在梗阻性黄疸时,胆色素的毒性作用能够引起细胞的变性坏死,导致肝脏的结构损伤。在肝脏损伤时,胆道压力升高能够导致门静脉系统受压,引起肝脏组织的缺血[5],导致氧自由基多度生成,引起肝脏的氧化损伤及能量代谢障碍,氧化产物能够引起肝脏星状细胞增生及纤维组织的过度合成,导致肝纤维化及肝硬化[3-7],引起肝脏的不可逆损伤。肝脏是体内最大的合成及代谢器官,大部分激素均在肝脏代谢,严重的肝脏病变往往引起体内激素代谢异常,如胰岛素代谢紊乱、甲状腺激素水平异常等。近年来的研究结果显示[8-9],在肝硬化患者体内多伴有甲状腺激素的异常,其可能与肝病患者甲状腺球蛋白的过度合成及甲状腺激素转化过程中关键酶的灭活障碍有关[10],对肝病患者甲状腺激素水平的检测能够评估患者的病情及预后,近年来有学者将小剂量甲状腺素用于肝硬化腹水患者的治疗,并且取得了较为理想的效果。
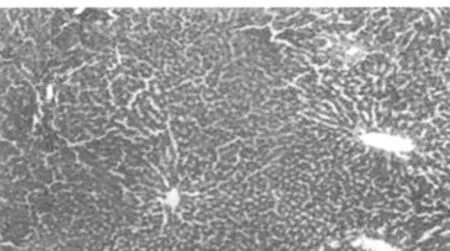
图1 对照组肝脏组织(HE,×200)
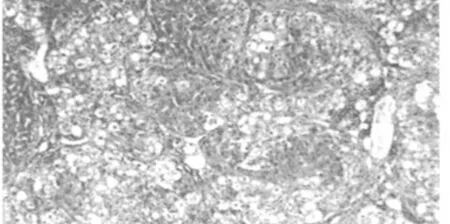
图2 梗黄组肝脏组织(HE,×200)
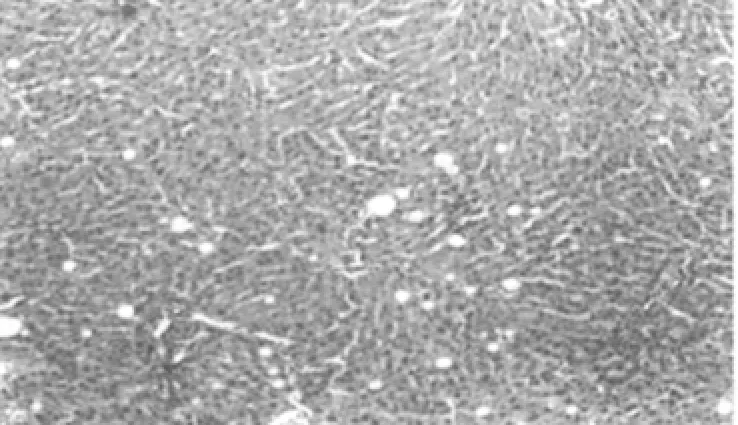
图3 低剂量组肝脏组织(HE,×200)
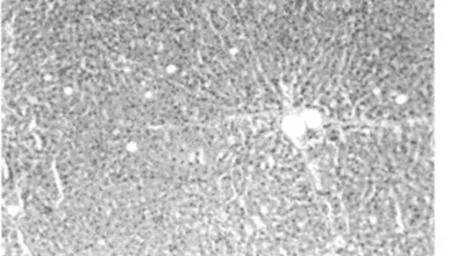
图4 高剂量组肝脏组织(HE,×200)
对梗阻性黄疸大鼠研究发现,在梗阻性黄疸大鼠体内存在甲状腺激素代谢异常的情况,在梗阻性黄疸大鼠体内FT3、FT4水平降低,TSH并未出现反馈性的增高,而是同步降低,说明在梗阻性黄疸大鼠体内甲状腺素的代谢及调节机制均出现异常,符合既往严重肝病患者正常甲状腺病态综合征的表现,在给予外源性甲状腺素后,大鼠体内的甲状腺素水平异常得到纠正,并且呈现剂量依赖性,在高度浓度干预组大鼠中表现出明显的差异,提示外源性甲状腺素能够改善梗阻性黄疸大鼠体内的甲状腺激素代谢异常,但是对于甲状腺素轴的反馈异常尚无明显的作用,大鼠体内TSH水平异常并未得到纠正。进一步的研究发现,给予甲状腺激素后,大鼠肝组织匀浆LA、HA、PC-Ⅲ及Ⅳ-C水平下降,肝脏纤维化得到改善,在病理结构的观察中也证实,甲状腺技术干预的梗阻性黄疸大鼠的肝脏结构损伤较轻,而未给予甲状腺素的大鼠,肝脏组织出现明显的变性、坏死及纤维化,肝脏的组织结构明显破坏。对肝组织匀浆的氧化还原酶系活力检测结果显示,梗阻性黄疸大鼠肝脏组织MDA浓度升高而SOD浓度降低,说明氧化应激是梗阻性黄疸大鼠肝脏损伤的原因之一[11-12],在给予甲状腺素以后,大鼠肝脏组织的MDA浓度下降,SOD浓度上升,梗阻性黄疸大鼠肝脏氧化损伤的主要原因是肝脏组织的血液循环障碍及能量代谢障碍,甲状腺激素能够上调细胞Na+-K+-ATP酶的活性,促进细胞的能量代谢,同时也是胆汁分泌的原动力之一,其对细胞能量代谢的调节作用可能是减轻梗阻性黄疸大鼠肝脏氧化损伤及继发的肝纤维的机制之一。本研究的结果显示,外源性甲状腺素能够改善梗阻性黄疸大鼠甲状腺激素代谢异常,减轻肝脏的氧化损伤,改善梗阻性黄疸大鼠肝脏纤维化,发挥对梗阻性黄疸肝脏损伤的保护作用。
[1]岳晓蓉,何秀丽.慢性乙型肝炎、乙肝肝硬化与患者血清甲状腺激素水平相关性分析[J].中国实验诊断学,2011,15(12):2111-2112.
[2]刘琛,赫长胜.巴戟天多糖对梗阻性黄疸大鼠T细胞免疫平衡影响研究[J].细胞与分子免疫学杂志,2011,27(6):678-679.
[3]Wang JM,Wang H,Xu LN,et al.Hepatic injury in rats with obstructive jaundice:roles of the protein kinase C signal pathway and cytoprotectionof fructose[J].Hepatobiliary Pancreat Dis Int,2005,4(4):577-558.
[4]Ogawa A,Tagawa T,Nishimura H,et al.Toll-like receptors 2 and 4 are differentially involved in Fas dependent apoptosis in Peyer's patch and the liver at an early stage after bile duct ligation in mice [J].Gut,2006,55(1):105-113.
[5]Kusaka K,Imamura H,Tomiya T,et al.Factors affecting liver regeneration after right portal vein embolization [J].Hepatogastroenterology,2004,51(56):532-535.
[6]Comert M,Tekin IO,Acikgoz S,et al.Experimental bile-duct ligation resulted in accumulation of oxidized low-density lipoproteins in BALB/c mice liver[J].J Gastroenterol Hepatol,2004,19(9):1052-1057.
[7]肖华,季爱民,李志梁,等.氧化低密度脂蛋白对大鼠心肌成纤维细胞胶原的影响[J].第三军医大学学报,2008,30(13):1252-1255.
[8]Bianco AC,Salvatore D,Gereben B,et al.Biochemistry,cellular and molecular biology,and physiological roles of the iodothyronine selenodeiodinases[J].Endocr Rev,2002,23(1):38.
[9]刘建国.肝硬化患者血清甲状腺素水平与肝纤维化指标的临床意义[J].实用中西医结合临床,2011,11(3):74-75.
[10]杨柳,高天舒,时杨.甲亢平对甲亢大鼠甲状腺功能及肝组织Na+-K+-ATP 酶的影响[J].吉林中医药,2009,29(3):262-263.
[11]田延锋,李勇,赵增仁,等.乌司他丁对梗阻性黄疸大鼠肠氧化应激的影响[J].郑州大学学报:医学版,2008,43(6):1186-1189.
[12]张欢,乔青,杨拔贤,等.乌司他丁对原位肝移植术患者围手术期促炎性细胞因子和氧自由自代谢的影响[J].中华麻醉学杂志,2003,23(5):32-35.

