曲古抑菌素A对细胞PANC-1株凋亡和肿瘤转移相关基因表达的影响
杨云秀,胡孙宽,叶星照,白永恒,王斯璐,刘 彪,王本泉,陈必成,陈宗静
(温州医学院附属第一医院1.肝胆胰外科;2.消化内科;3.外科实验室,浙江 温州 325000)
胰腺癌的临床治疗效果一直不理想,临床常用的化疗药物不能显著延长胰腺癌患者的生存率,其5年生存率仅为3%。近年研究显示,影响表观遗传的化学药物具有抗肿瘤作用,除DNA甲基化外,组蛋白乙酰化也是表观遗传修饰的重要内容[1]。组蛋白去乙酰化酶 (histone deacetylase,HDAC)催化的乙酰化反应在真核基因的表达调控中起重要作用,可通过对核心组蛋白的可逆修饰来调节组蛋白的乙酰化水平,从而调控转录的起始和延伸。HDAC抑制剂能够抑制HDAC的活性,改变组蛋白和非组蛋白的乙酰化水平,从而可以选择性地调控部分肿瘤相关基因[2]。研究表明,HDAC抑制剂可通过改变组蛋白的乙酰化状态调控肿瘤相关基因的表达、阻碍细胞周期、抑制肿瘤血管生成以及改变热激蛋白90的乙酰化状态等机制[3-6],在体外诱导多种肿瘤细胞的生长停滞、分化或凋亡。曲古抑菌素A(trichostatin A,TSA)是一种得到广泛关注的HDAC抑制剂,本研究主要通过TSA体外处理胰腺癌细胞,检测肿瘤增殖、凋亡和转移的相关基因表达,探讨TSA诱导胰腺癌PANC-1细胞凋亡机制。
1 材料与方法
1.1 主要试剂和仪器
TSA购自Sigma公司(美国),用二甲亚砜(DMSO,Sigma)溶解至 10 μmol·L-1,使用前用培养基稀释至工作浓度。DMEM培养基、胎牛血清、Trizol购自Gibco BRL公司,Hoechst 33258购自Sigma公司。逆转录试剂盒和SYBRGreenⅠ荧光定量试剂盒购自东洋纺(上海)生物科技有限公司,荧光PCR所用引物由周蒙滔教授馈赠(引物序列见表1)。Notch受体胞内区(Notch intracellular domain,NICD)兔抗人一抗以及辣根过氧化物酶标记山羊抗兔IgG二抗购于Abcam生物公司。胱天蛋白酶3活性检测试剂盒购自上海碧云天生物技术有限公司。酶标仪为ELX800(Bio-Tek)产品,荧光 PCR仪为 ABI7500(ABI)。

Tab.1 Sequence of primers used with real-time PCR
1.2 细胞培养
PANC-1培养在含10%胎牛血清、链霉素100 g·L-1、青霉素100 g·L-1的 DMEM 培养液里,于37℃,5%CO2培养箱中培养。取对数生长期的细胞处理后分组,TAS组加入 TAS 0.1,0.2,0.4 和0.6 μmol·L-1,正常对照组加入等量的培养液共同培养。
1.3 MTT法检测细胞存活
取对数生长期PANC-1细胞,用0.25%的胰酶消化,收集并调整细胞密度为5×107L-1,接种于96孔细胞培养板中,每孔100 μl,待细胞贴壁后弃去培养基,分别加入100 μl终浓度为 0.1,0.2,0.4 和0.6 μmol·L-1的 TSA,分别作用 0,12,24 和 48 h,正常对照组不加TSA,同时设置空白调零组〔不加细胞仅加入等量的磷酸盐缓冲液(PBS)〕。培养结束前4 h 每孔加入 20 μl MTT(5 g·L-1),继续培养4 h 后弃去上清液,每孔加入150 μl DMSO,震荡10 min左右,使结晶充分溶解后,立即于酶标仪490 nm处测定吸光度值(absorbance,A490nm)。计算肿瘤细胞增殖抑制率(inhibitory rate,IR),IR(%)=1-(实验组A490nm-空白组A490nm)/(正常对照组A490nm-空白组A490nm)×100%。每个浓度设6个平行孔。
1.4 Hoechst 33258荧光染色法观察细胞凋亡
TSA 0.4 μmol·L-1处理0,12,24,48 h 后,移去培养基,用冷PBS洗2次,4%甲醛液固定10 min,弃固定液,双蒸水冲洗2次,Hoechst 33258(5 mg·L-1)避光染色5 min,然后用双蒸水冲洗2次,室温下凉干后于荧光(激发波长360 nm,发射波长450 nm)显微镜下观察,并随机选取位置进行拍照。
1.5 胱天蛋白酶3活性的测定
将PANC-1细胞接种在 12孔板后,TSA 0.4 μmol·L-1处理细胞 0,4,8 和 12 h 后,按照胱天蛋白酶3活性测定试剂盒操作说明进行。实验重复3次,结果取平均值。
1.6 实时定量PCR方法检测靶基因表达
取 TSA 0.4 μmol·L-1处理 24 h 和正常对照组细胞,用Trizol试剂盒提取两组细胞的总RNA,每组吸取2 μg RNA样本在10 μl体系中进行逆转录反应,参照逆转录试剂盒说明书进行。取逆转录产物1 μl进行 PCR 扩增,PCR 扩增体系:5 μl 2 ×SYBR Green 荧光定量试剂、2 μl引物(上、下游各 1 μl,终浓度 200 nmol·L-1)、2 μl反应缓冲液、1 μl cDNA。检测靶基因包括:存活素、p53、c-myc、Bcl-2,Bax、金属蛋白酶1组织抑制剂(tissue inhibitor of metalloproteinase-1,TIMP-1)、基质金属蛋白酶(matrix metalloproteinase 1,MMP1)以及Notch通路关键分子Notch-1。扩增程序为:95℃ 10 min,95℃ 15 s,62℃ 10 s,40 个循环。得到的 Ct值用 2-△△Ct法计算mRNA表达。
1.7 细胞免疫化学检测NICD蛋白的表达
将细胞经胰酶消化收集后,分别以2×105个细胞接种于含载玻片的6孔板中,常规培养。培养细胞至 80% ~90%融合后,分别用 TSA 0,0.4和0.6 μmol·L-1处理 24 h,弃去培养基,PBS 清洗细胞3次,用4%多聚甲醛固定60 min。5% ~10%正常山羊血清(PBS稀释)封闭,在各细胞爬片上滴加一抗工作液抗NICD,37℃孵育l h,PBS冲洗3次,滴加生物素标记二抗工作液,37℃孵育30 min;PBS冲洗3次。二氨基联苯胺显色,细胞胞质和胞核呈棕黄色为阳性着色,苏木精复染后常规脱水、透明、封片。每组取3张片,每张片子取8个高倍视野(200×),运用Image Pro Plus软件分析NICD染色的平均吸光度值。
1.8 统计学分析
2 结果
2.1 TSA对PANC-1细胞存活的影响
图1结果显示,TSA对PANC-1细胞存活有显著的抑制作用,且抑制作用具有较好的量效(r=0.640,P=0.01)和时效(r=0.768,P=0.002)关系。作图法求出TSA的半数抑制浓度为12 h:IC50=0.42 μmol·L-1;24 h:IC50=0.32 μmol·L-1;48 h:IC50=0.19 μmol·L-1。
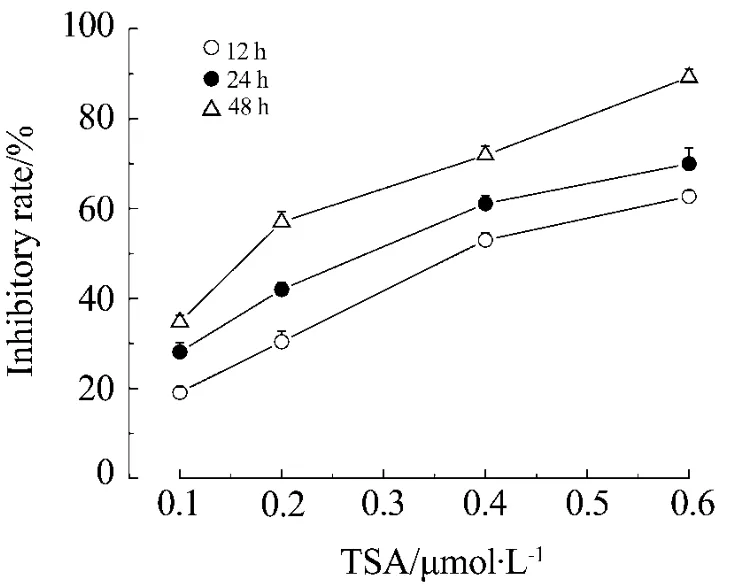
Fig.1 Effect of trichostatin A(TSA)on PANC-1 cell porliferation by MTT.,n=6.
2.2 TSA诱导PANC-1细胞凋亡
TSA 0.4 μmol·L-1分别处理 0,12,24 和 48 h,Hoechst 33258染色发现,未经TSA处理的正常细胞核染色较淡(图2A),早期凋亡细胞核由于染色体发生皱缩而染成亮蓝色容易与正常细胞区分。随着药物作用时间延长,细胞核亮蓝色染色比例明显增加,TSA作用48 h PANC-1细胞核染成亮蓝色数目最多(图2B,C,D)。
2.3 TSA对PANC-1细胞胱天蛋白酶3活性的影响
图3 结果示,TSA 0.4 μmol·L-1处理0,4,8 和12 h后,PANC-1细胞内激活的胱天蛋白酶3随时间的增加活性增强,分别为正常对照组的(1.62±0.12)倍,(2.68 ±0.17)倍和(3.92 ±0.23)倍(F=97.8,P <0.01)。

Fig.3 Effect of TSA on caspase 3 activity of PANC-1 cells.PANC-1 cells were cultured with TSA 0.4 μmol·L-1for 0,4,8 and 12 h.,n=3.*P<0.05,**P<0.01,compared with control(0 h)group.
2.4 TSA对PANC-1细胞凋亡和肿瘤转移相关基因表达的影响
表4结果显示,与正常对照组相比,TSA 0.4 μmol·L-1作用 PANC-1 细胞 24 h 后凋亡相关基因存活素,c-myc和p53 mRNA表达均明显下降,Bax表达明显上升,Bcl-2 mRNA未见明显变化,但Bcl-2/Bax值降低明显,仅为对照组的14%。肿瘤转移相关基因MMP1和TIMP1 mRNA的表达显著升高(F=39.2,P=0.003;F=9.5,P=0.039)。

Fig.2 Effect of TSA on PANC-1 cell apoptosis detected by Hoechst 33258 staining(× 200).A-D:TSA 0.4 μmol·L-1treated PANC-1 for 0,12,24 and 48 h,respectively.Arrows show apopotic cells.

Tab.4 Effect of TSA on apoptosis-related and metastasis-related gene expression in PCNA-1
2.5 TSA对PANC-1细胞Notch-1 mRNA及其活化分子NICD表达的影响
TSA 0.4 μmol·L-1处理 PANC-1 细胞 24 h 后,Notch-1 mRNA表达与正常对照组相比变化不明显,无统计学意义(F=6.87,P>0.05)。细胞免疫化学检测Notch-1的活化分子NICD发现,正常对照组仅显示苏木素蓝染的细胞核(图4A),而TSA 0.4和0.6 μmol·L-1作用24 h均有棕黄色 NICD 染色阳性细胞,并随药物浓度增加阳性细胞棕黄色逐渐加深(图4B,C)。Image Pro Plus软件定量分析结果显示,TSA 0.4 和0.6 μmol·L-1组 NICD 蛋白的相对表达分别为 0.143 ±0.009 和 0.264 ±0.013,与正常对照组0.072 ±0.009相比有明显差异(F=131.1,P <0.05)。
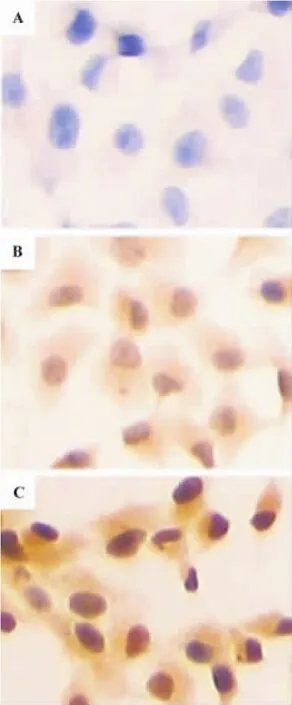
Fig.4 Effect of TSA on expression of Notch intracellular domain(NICD)in PANC-1 cells by immunocytochemistry(× 200).A:normal control;B:TSA 0.4 μmol·L-1for 24 h;C:TSA 0.6 μmol·L-1for 24 h.
3 讨论
组蛋白乙酰化是调节基因表达的表观遗传修饰的一种,调节组蛋白乙酰化程度主要有组蛋白乙酰化酶和HDAC的相互协调来完成。组蛋白乙酰化紊乱可能会导致染色体结构变化,调节细胞周期、分化以及凋亡的基因转录水平的失调,进而影响细胞的生长导致凋亡[7]。由于大多数肿瘤细胞中都呈高度乙酰化状态[8],因此具有抑制HDAC的活性的化疗药物成为抗癌治疗的研究热点。TSA是一种去乙酰化酶抑制剂,能够有效地抑制HDAC的活性,促进组蛋白和非组蛋白的乙酰化修饰,在转录和翻译水平调控肿瘤生长、增殖以及凋亡相关蛋白的表达和降解,活化凋亡信号通路[9]。本研究发现,TSA可以抑制PCNA-1的生长导致其凋亡,并通过MTT法、Hoechst 33258核染色和胱天蛋白酶3的激活情况得以证实。虽然TSA并不影响Notch-1的表达,但是NICD表达增加,提示Notch通路激活。并且TSA可上调凋亡基因的表达如Bax,下调抗凋亡基因c-myc,存活素和Bcl-2 mRNA的表达。在本实验中TSA诱导胰腺癌细胞出现了明显的凋亡特性,同时伴随着凋亡相关基因的改变。
研究发现,TSA能通过它的氧肟酸螯合HDAC活化位点上的锌离子而抑制Ⅰ型和Ⅱ型 HDAC的活性,达到调控基因表达的作用,从而改变肿瘤细胞内重要的生长通路促进其凋亡[10]。目前已有文献证明TSA可以诱导多种肿瘤细胞的凋亡,而细胞凋亡的启动和发展受到多种蛋白酶的控制,控制凋亡的途径主要有两条:死亡受体途径和线粒体途径。线粒体途径是细胞凋亡的经典途径,在凋亡的过程中胱天蛋白酶3被激活而发挥功能。实验结果表明,胱天蛋白酶3活性随着TSA作用时间的延长而增强,与Sato等[11]研究结果相一致,可见MTT方法检测到的细胞增殖抑制是通过TSA诱导PANC-1细胞凋亡的结果,在这一过程中大量胱天蛋白酶3被激活;同时Hoechst 33258荧光染色也证实了大量细胞发生了凋亡。
P53可调控凋亡途径中的多种蛋白如Bax和Apaf1,但 PANC-1 表达的可能为突变的 P53[12],TSA下调突变p53 mRNA的表达促进其凋亡。存活素作为凋亡抑制蛋白家族之一,在正常组织中不表达,而在肿瘤组织中有较高的表达,是目前为止发现的最强的凋亡抑制因子,可直接作用于细胞凋亡途径中胱天蛋白酶3,胱天蛋白酶7抑制细胞凋亡,其抑制凋亡的效果远远大于Bcl-2家族[13]。本实验结果表明,TSA处理细胞导致存活素mRNA表达明显下降,可通过减除对胱天蛋白酶3的抑制而促进细胞凋亡。Bcl-2家族蛋白调控细胞凋亡,其中促凋亡基因Bax、抑凋亡基因Bcl-2在细胞凋亡中发挥着重要的作用。尤其是Bcl-2/Bax蛋白比率的降低被认为是凋亡过程中一个重要因素。二者在线粒体膜上形成二聚体,调控着线粒体膜的通透性。当其比值降低时,线粒体膜通透性升高,细胞色素c大量释放,进而激活胱天蛋白酶3导致细胞凋亡。本实验结果显示,TSA对Bcl-2 mRNA表达无影响,但显著升高Bax mRNA表达,导致Bcl-2/Bax mRNA比率降低。表明线粒体通路参与了TSA诱导细胞凋亡的过程。
Notch通路在肿瘤细胞生长、增殖、分化过程中起重要作用,因而成为治疗肿瘤的重要靶点。但研究者对Notch通路激活影响细胞凋亡的意见却不尽一致,Wang等[14]发现通过抑制肿瘤细胞Notch通路可抑制胰腺癌细胞的生长并促进肿瘤细胞的凋亡,而Greenblat等[15]则发现在髓质型甲状腺癌中,Notch 通路的激活可以诱导癌细胞发生凋亡。由此可见可能是由于肿瘤性质不同,具体机制还需进一步研究。在本研究中,TSA并不影响Notch-1 mRNA表达,但对Notch通路有激活作用,活化分子NICD蛋白入核现象明显。同样MMP1和TIMP-1也具有一定的抗凋亡作用。在诱导凋亡的模型中,广谱MMP1抑制剂会增加胱天蛋白酶3活性和DNA片段出现的时间[16],推测MMP1具有抑制肿瘤细胞凋亡的作用。研究结果显示,TSA使PANC-1细胞MMP1和TIMP-1 mRNA表达明显升高,其凋亡机制可能激活Notch通路、MMP1和TIMP-1通路有关。
[1]Ballestar E,Wolffe AP.Methyl-CpG-binding proteins.Targeting specific gene repression[J].Eur J Biochem,2001,268(1):1-6.
[2]Kim DH,Kim M,Kwon HJ.Histone deacetylase in carcinogenesis and its inhibitors as anti-cancer agents[J].J Biochem Mol Biol,2003,36(1):110-119.
[3]Nozell S,Laver T,Patel K,Benveniste EN.Mechanism of IFN-beta-mediated inhibition of IL-8 gene expression in astroglioma cells[J].J Immunol,2006,177(2):822-830.
[4]Kamitani H, Taniura S, Watanabe K, Sakamoto M,Watanabe T,Eling T.Histone acetylation may suppress human glioma cell proliferation when p21 WAF/Cip1 and gelsolin are induced[J].Neuro Oncol,2002,4(2):95-101.
[5]Harper J,Yan L,Loureiro RM,Wu I,Fang J,D'Amore PA,et al.Repression of vascular endothelial growth factor expression by the zinc finger transcription factor ZNF24[J].Cancer Res,2007,67(18):8736-8741.
[6]Yu X,Guo ZS,Marcu MG,Neckers L,Nguyen DM,Chen GA,et al.Modulation of p53,ErbB1,ErbB2,and Raf-1 expression in lung cancer cells by depsipeptide FR901228[J].J Natl Cancer Inst,2002,94(7):504-513.
[7]Hess-Stumpp H,Bracker TU,Henderson D,Politz O.MS-275,a potent orally available inhibitor of histone deacetylases-the development of an anticancer agent[J].Int J Biochem Cell Biol,2007,39(7-8):1388-1405.
[8]Batty N,Malouf GG,Issa JP.Histone deacetylase inhibitors as anti-neoplastic agents[J].Cancer Lett,2009,280(2):192-200.
[9]Marks PA,Dokmanovic M.Histone deacetylase inhibitors:discovery and development as anticancer agents[J].Expert Opin Investig Drugs,2005,14(12):1497-1511.
[10]Acharya MR,Sparreboom A,Venitz J,Figg WD.Rational development of histone deacetylase inhibitors as anticancer agents:a review[J].Mol Pharmacol,2005,68(4):917-932.
[11]Sato N,Ohta T,Kitagawa H,Kayahara M,Ninomiya I,Fushida S,et al.FR901228,a novel histone deacetylase inhibitor,induces cell cycle arrest and subsequent apoptosis in refractory human pancreatic cancer cells[J].Int J Oncol,2004,24(3):679-685.
[12]Yamaguchi Y,Watanabe H,Yrdiran S,Ohtsubo K,Motoo Y,Okai T,et al.Detection of mutations of p53 tumor suppressor gene in pancreatic juice and its application to diagnosis of patients with pancreatic cancer:comparison with K-ras mutation[J].Clin Cancer Res,1999,5(5):1147-1153.
[13]Ambrosini G,Adida C,Sirugo G,Altieri DC.Induction of apoptosis and inhibition of cell proliferation by survivin gene targeting[J].J Biol Chem,1998,273(18):11177-11182.
[14]Wang Z,Zhang Y,Li Y,Banerjee S,Liao J,Sarkar FH.Down-regulation of Notch-1 contributes to cell growth inhibition and apoptosis in pancreatic cancer cells[J].Mol Cancer Ther,2006,5(3):483-493.
[15]Greenblatt DY,Cayo MA,Adler JT,Ning L,Haymart MR,Kunnimalaiyaan M,et al.Valproic acid activates Notch1 signaling and induces apoptosis in medullary thyroid cancer cells[J].Ann Surg,2008,247(6):1036-1040.
[16]Limb GA,Matter K,Murphy G,Cambrey AD,Bishop PN,Morris GE,et al.Matrix metalloproteinase-1 associates with intracellular organelles and confers resistance to lamin A/C degradation during apoptosis[J].Am J Pathol,2005,166(5):1555-1563.

