冷库中低温细菌的分离及鉴定
邹昊
(丽水职业技术学院 环境工程分院,浙江 丽水323000)
1 引言
嗜冷微生物,又称嗜冷菌,是指一类最适生长温度低于15℃,最高生长温度低于20℃和最低生长温度在0℃以下的细菌、真菌和藻类的微生物[1]。而部分虽然能在0℃下生长,但最适生长温度为20~40℃的微生物,则只能称耐冷微生物[2],易从不稳定的低温环境中分离得到,如冷水或土壤中。按照Morita的定义可将冷适应微生物分成两类,即嗜冷微生物(psychrophiles)和耐冷微生物(psychrotolerants,又称适冷微生物-psychrotrophs)。嗜冷微生物是指最适生长温度为15℃,最高生长温度低于20℃的微生物。而耐冷微生物通常指不能在0℃生长,但能在3~5℃生长,其最适和最大生长温度在20℃以上的微生物。为了简单起见,从广义上讲,也常用冷适应微生物(cold-adapted microorganism)这个词表示这两个类群。
嗜冷微生物能在土壤、海洋、河流以及植物和冷血动物的体内等环境中找到。在自然环境中,没有哪个基本的物质循环能与嗜冷微生物的代谢活动分开,它们对自然界的基本循环有重要贡献,如碳、氮、硫、磷等元素的循环。已知的嗜冷固氮根瘤菌,能够产生某些降解大分子(如蛋白质、碳水化合物)以及低分子量的环境污染物的胞外酶。这些嗜冷微生物不仅在有机碳的再循环,而且在处理非天然的和人造的化合物中,都起了巨大的作用,是保持全球生态平衡必不可少的角色[3]。
生物圈大部分(约80%以上)温度在20℃以下,而低温微生物是指最适生长温度小于20℃的微生物,因此,分离鉴定能分解蛋白质、淀粉、纤维素等物质的低温细菌,不仅可对微生物多样性进行研究,还将具有一定的实际应用价值[4]。
本文利用经典微生物学方法,对职业技术学院肉制品保藏冷库中的低温微生物进行纯培养分离和研究。
2 材料和方法
2.1 材料
2.1.1 菌株来源
样品采集自职业技术学院肉制品保藏冷库。
2.1.2 培养基
实验主要采用LB液体培养基(g/L):蛋白胨10,酵母膏5,NaCl l0,pH 值为7.0。LB固体培养基(g/L):蛋白胨10,酵母膏5,NaCl 10,琼脂20,pH7.0。
2.1.3 酶和试剂
Ex-Taq DNA聚合酶、T4DNA连接酶和pMD18-T载体购自大连宝生物公司,其他试剂均为国产分析纯。
2.2 方法
2.2.1 低温细菌的分离
样品的分离分别采用土壤悬液涂布法[5](称取少量土样于灭菌三角瓶中,加入100倍于土样质量的无菌水)、划线法(用接种环挑取少许,在LB平板上划线,置于150℃恒温箱中培养)、点样接种法(划线平板上生长出单菌落后,用灭菌牙签沾取少许菌样,点接至母板Master Plate上,供进一步研究使用)。
2.2.2 低温细菌的鉴定
(1)形态学观察。结晶紫染色及革兰氏染色观察菌体形态。
(2)生理生化鉴定。利用杭州天和微生物制剂有限公司的生化微量鉴定管进行生理生化鉴定。对5株分离细菌进行10种生理、生化鉴定。用砂轮割去鉴定管一端,加菌液15μL,管口塞少许已灭菌的棉花封口,防止杂菌参与反应,15℃下培养18~24 h,观察结果。将5株菌接种于LB平板上,置于不同温度中培养,观察菌体生长情况。
(3)16SrDNA序列分析。利用16SrDNA的一对通用引物进行PCR扩增,引物序列见表1。
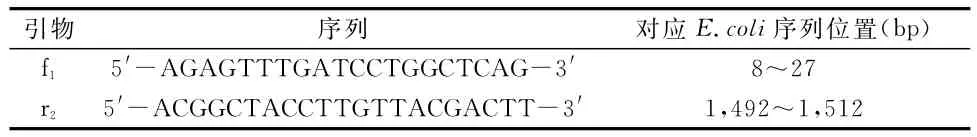
表1 16SrDNA所用引物
PCR扩增反应体系(50L)组成如下:
10×Ex-Taq buffer 5L
2.5mM dNTP 3L
模板 10ng
正向引物f150pmol
反向引物r250pmol
Ex-Taq DNA polymerase 0.2L
无菌水 补足至50L
PCR扩增程序:94℃变性30sec,50℃退火1min,72℃延伸90sec,30个循环;72℃延伸10min。PCR结束后,通过1%的琼脂糖凝胶电泳检测目的条带。
PCR产物经胶回收纯化后,与pMD18-T载体(Takara产品)16℃连接10h。
连接体系如下:
胶回收产物 7.5L
pMD18-T载体 0.5L
10×T4DNA ligase buffer 1L
T4DNA ligase 1L
连接产物通过化学转化法转化E.coli DH5,涂布含有氨苄青霉素(Amp)的LB平板,置于37℃培养12h。
以M13(RV/M4)为引物,通过菌落PCR扩增检测转化产物。引物序列如下:
M13(RV):5′- ATTTCACACAGGAAACAGCTATGAC-3′,
M13 (M4): 5′ - GTTTTCCCAGTCACGACGTTCTAAA-3′。
PCR结束后,通过1%的琼脂糖凝胶电泳检测目的条带。PCR扩增验证的产物进行双向测序,然后将所测序列提交GenBank,通过Blastn进行序列同源性检索分析。
3 结果分析
3.1 低温细菌的分离
在低温环境中共分离到低温细菌5株。
3.2 低温细菌的鉴定
分离到的5株菌均为革兰氏阴性菌。
生理生化鉴定结果见表2。从表2可以看出,5株菌均无法利用卫茅醇、山梨醇和乳糖为唯一碳源;5株菌均不能分解含硫氨基酸产生硫化氢;均可产生鸟氨酸脱羧酶及赖氨酸脱羧酶;01菌可利用硝酸盐并产生气体氨和氮气,其它菌种不能。
将5株菌接种于LB平板上,置于不同温度中培养,菌体生长情况见表3。
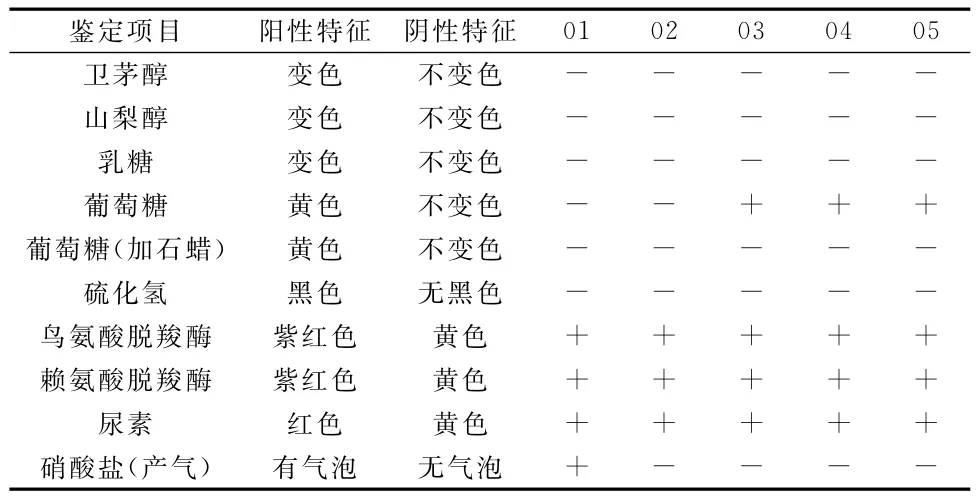
表2 细菌生理生化反应结果
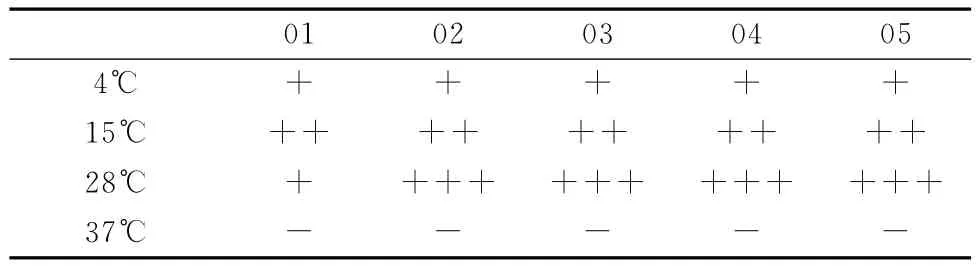
表3 生长温度测定结果
实验结果表明,除01号菌外,其余菌在4~28℃下随温度的升高而生长速度加快。5株菌在37℃下均不能生长,这一特点符合低温微生物的特征,且与采样的低温环境相符合。
01、02和03菌株的16SrDNA的扩增结果见图1。

图1 分离菌株16SrDNA电泳
分离菌株经16SrDNA扩增后的序列,连接pMD18-T载体,测序拼接后的序列提交NCBI,通过Blastn比对进行分离菌株的初步鉴定。用DNAStar软件构建系统进化树[6],如图2所示。
从系统进化树可看出,分离菌株与Pseudomonas属中的各菌株归于同一簇群。因此,依据形态学和生理生化试验的结果,将其鉴定为假单胞菌属(Pseudomonas sp.)的菌株。

图2 分离菌株与相关菌株的系统发育树
4 讨论
从环境中分离获得5株低温细菌,并对其中的3株低温细菌的16SrDNA进行了测序,测序结果表明3株均属于假单胞菌属(Pseudomonas)的菌株。
假单胞菌是微生物的重要类群,其广泛分布于自然界之中,是自然界分布最广的微生物之一。假单胞菌较广的分布使其面对多样的生境,多样的生境造就了假单胞菌较广的生长温度、pH值,较多的营养代谢类型等,为人类提供了多样的遗传资源,使假单胞菌在环境的生物修复、生物防治、生物转化等领域发挥了越来越重要的作用[7~9]。低温有助于蛋白质的正确折叠[10],假单胞菌有相当一部分属于耐冷菌,用其作为宿主可生产一些用E.coli等中温菌宿主无法生产或生产不好的蛋白质。同时,假单胞菌的营养类型多样,利用其多样的代谢途径可以为人类生产某些用别的菌无法生产的物质。假单胞菌分布极广,其遗传多样性异常丰富。这一特性决定了其有为人类解决诸多问题的巨大潜力。
[1]黄秀梨.微生物学(第二版)[M].北京:高等教育出版社,2003.
[2]沈 萍.微生物学[M].北京:高等教育出版社,2000.
[3]曹军卫,沈 萍,李朝阳.嗜极微生物[M].武汉:武汉大学出版社,2004.
[4]陆小波.低温蛋白酶纯化分离[D].昆明:昆明理工大学,2007.
[5]赵 斌,何绍江.微生物学实验[M].北京:科学出版社,2002.
[6]Takeshi Suzuki,Toru Nakayama,Tatsuo Kurihara,et al.Coldactive lipolytic activity of psychrotrophic Acinetobacter sp.strain No.6[J].Journal of Bioscience and Bioengineering.2001(12):371~372.
[7]Wang S L,Yieh T C,Shih I L.Production of antifungal compounds by Pseudomonas aeruginosa K-187using shrimp and crab powder as a carbon sourse[J].Enayme and Microbial Technology,1999,25(1):142~148.
[8]Slininger P J,Burknead K D,Schisler D A.Isolation,identification,and accumulation of 2-acetamidophenol in liquid culture of the wheat take-all biocontrol agent Pseudomonas fluorescens 2-79[J].Applid Microbiology and Biotechnology,2001,54(3):376~380.
[9]Martin C H,Wu D Y,Prather K L J.Integrated bioprocessing for the pH-dependent production of 4-valerolactone from levulinate in Pseudomonas putida KT2440[J].Applied and Environmrntal Microbiology,2010,76(2):417~424.
[10]Georgiou G,Valax P.Expression of correctly folded proteins in Escherichia coli.Curr[M].Opin:Biotechnol,1996:190~197.

