螺旋藻小分子多肽泡沫分离法最佳工艺参数研究
郭 准,周琳娜,李博生
(1.北京林业大学生物科学与技术学院,北京 100083;2.北京林业大学螺旋藻研究所,北京 100083)
螺旋藻[1-2]是存在于地球已逾30亿a的低等水生藻类植物。它不仅可作为人类丰富的蛋白质来源,其中某些蛋白质和多肽还是重要的生理活性物质,能促进免疫系统功能,抗氧化,降血压,延缓衰老,抵抗多种疾病。大多数的强抗氧化肽和降压肽主要集中在分子量在5 000 D以下的小肽[3]。通常采用酶解法[4]得到多肽初提物后,为了进一步得到分子量5 000 D以下的多肽,通常需要对酶解液进行后续复杂的分离纯化。采用何种分离纯化方法主要取决于所提取组分物质和目的。目前主要有毛细管电泳法、反向高压液相色谱法、超滤法和凝胶过滤层析法等[5],试验过程十分繁琐、复杂。泡沫分离是膜分离技术的一种,它是以泡沫作为分离介质,以组分之间的表面活性差异作为分离依据,利用在溶液中的鼓泡来达到富集物质目的的一种新型分离技术[6]。该方法设备简单,试验过程简洁,但目前采用泡沫分离法直接提取螺旋藻小分子多肽尚未见报道。笔者以螺旋藻为原料,采用泡沫分离法直接提取螺旋藻悬浮液上清液,并对提取液进行紫外可见光扫描和基质辅助激光解吸飞行时间串联质谱扫描,对泡沫分离提取液的主要成分进行了确定,研究了不同pH值和料液比对螺旋藻多肽溶解率、回收率以及提取率的影响以及最佳工艺参数。最后进行抗氧化活性实验,对其总还原力以及对羟基自由基和超氧阴离子的清除能力进行了研究。
1 材料与方法
1.1 材料
1.1.1 供试材料 螺旋藻粉,北京林业大学螺旋藻研究所提供。
1.1.2 仪器与试剂 仪器:FA1004电子天平(上海衡平仪器仪表厂)、HJ-3磁力搅拌机(金坛市金城金华仪器厂)、JKY/SJ-4A电子PH计(北京北瑞达医药科技有限公司)、TU-1901紫外分光光度计(上海沪粤明科学仪器有限公司)、Thermo BIOFUGE PRTMO R centrifuge(美国Thermo Fisher Scientific公司)、Thermo Heto Power Dry LL1500 Freeze Dryer(美国 Thermo Fisher Scientific公司)、4700 Proteomics Analyzer型基质辅助激光解吸电离飞行时间串联质谱仪(美国应用生物系统(ABI)公司);试剂:所有试剂均为分析纯。
1.2 方法
1.2.1 试验装置 图1为泡沫分离的试验装置示意图。泡沫分离柱的内径47 mm、高度700 mm。空气经压缩机压缩后,通过气体分布器,分散成气泡由柱底通入螺旋藻藻悬液。泡沫沿柱体上升,到达柱顶后经过泡沫溢出管进入泡沫收集装置,每次试验时间持续到产生的泡沫不能从装置中溢出,停止通气,每次收集的泡沫提取液采用搅拌方式消除泡沫。
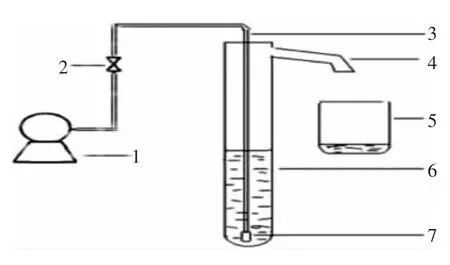
图1 试验装置结构
1.2.2 螺旋藻泡沫提取物的制备 准确称取0.5 g的螺旋藻粉于烧杯中,加入500 mL蒸馏水配置成料液比为1 g/L的螺旋藻藻悬液,调节pH值为9时,800 r/min磁力搅拌10 min。螺旋藻细胞内物质充分溶解后,5 000 r/min离心10 min,收集上清液,加入图1所示装置进行泡沫提取并对提取液进行收集。将泡沫提取液冷冻干燥后得到粗提物。
1.2.3 紫外-可见光扫描 将粗提物加蒸馏水配置成1 mg/mL的溶液,利用TU-1901紫外分光光度计对其进行紫外-可见光扫描,初步分析提取液中所含物质。扫描波段为200~850 nm。
1.2.4 基质辅助激光解吸飞行时间串联质谱扫描将粗提物加蒸馏水配置成1 mg/mL的溶液,然后对其进行基质辅助激光解吸飞行时间串联质谱法(MALDI-TOF-MS/MS)进行质谱扫描,确定提取液中所含物质及其分子量。
1.2.5 单因素试验 分别考察不同料液比值(g/L)0.5、1、1.5、2,不同 pH 值 5、6、7、8、9,对泡沫分离法提取多肽的溶解率、回收率以及提取率的影响,确定最佳工艺参数。
1.2.6 多肽浓度的测定 采用福林酚试剂法,以牛血清白蛋白作标准曲线,在波长540 nm处测量上清液、消融后的泡沫提取液的多肽浓度[7]。
螺旋藻多肽溶解率P=(Ci×Vi)/m×100%;回收率W=(Cf×Vf)/(Ci×Vi)×100%;提取率Y=(P×W)×100%。
其中,Ci和Cf分别指上清液和提取液中多肽浓度(mg/mL),Vi和Vf分别指进样原液和提取液的体积(mL),m 指藻粉的质量(mg)。
1.2.7 抗氧化活性试验 (1)螺旋藻泡沫提取物总还原力的测定[8]:在2 mL样品(空白用蒸馏水)中加入1%的铁氰化钾溶液2 mL以及浓度为0.2 mol/L的pH 6.6的磷酸盐酸缓冲液2 mL,混合均匀后在50℃保温20 min,然后加入10%的三氯乙酸2 mL,混合后3 000 r/min离心10 min。取上清液4 mL加入4 mL蒸馏水和0.1%的氯化铁0.8 mL,混合均匀后在700 nm波长处测吸光值,记A700。以Vc作为对照。浓度设计 1.0、2.0、3.0、4.0、5.0、6.0、10 mg/mL。吸光度A值越大,样品还原能力越强。(2)螺旋藻泡沫提取物对超氧阴离子(O2)自由基清除能力的测定:采用邻苯三酚自氧化法[9],邻苯三酚在弱碱条件下发生自氧化反应产生O2-,O2-清除剂能使邻苯三酚自氧化产物在波长325 nm处吸收峰受到抑制。每支试管加入浓度为0.05 mol/L的Tris-HCL缓冲液4.5 mL(pH=8.2)、不同浓度样品液1 mL、蒸馏水2.4 mL,摇匀后在25℃水浴保温10 min。加入0.1 mL邻苯三酚,摇匀,计时30 min,迅速加入0.1 mL浓盐酸终止反应,测325 nm处吸光度值 A325。以 Vc作为对照。浓度设计 0.5、1.0、2、0、3.0、4.0、5.0、6.0 mg/mL。
清除率(%)=[A0-(Ai-Aj)]/A0×100
式中:A0为不加样品溶液的吸光值;Ai为加入样品溶液后的吸光值;Aj为不加邻苯三酚的吸光值。
(3)螺旋藻泡沫提取物对羟基自由基清除能力的测定[10]:在10 mL试管中依次加入6 mmol/L硫酸亚铁溶液2.0 mL,不同浓度的样品液2.0 mL,6 mmol/L双氧水溶液2.0 mL,摇匀后静置10 min,在加入6 mmol/L的水杨酸溶液2.0 mL,摇匀后静置30 min后于510 nm处测定其吸光度值A510。以Vc作为对照,浓度设计 0.5、1.0、2.0、3.0、4.0、5.0、6.0 mg/mL。
清除率(%)=[A0-(Ai-Aj)]/A0×100
式中:A0为不加样品溶液的吸光值;Ai为加入样品溶液后的吸光值;Aj为不加水杨酸溶液的吸光值。
2 结果与分析
2.1 泡沫提取液的紫外可见光全波长扫描
将螺旋藻粗提取液冻干成粉末,并配置成1 mg/mL溶液后进行紫外全波长扫描。结果显示:提取液在220 nm附近,有明显的吸收峰(4.162 Abs),其峰高明显大于提取液中其他物质。小分子在小肽的分子结构中200~220 nm处的吸收峰主要是由肽键产生的,270~290 nm范围内的吸收峰(0.874 Abs)主要是由芳香氨基酸侧链的大π键产生的[11]。由此推断溶液中可能含有大量多肽物质。另外,在674 nm和620 nm附近也有一定的吸收峰(0.271 Abs,0.298 Abs),推测可能为别藻蓝蛋白和藻蓝蛋白[12]。
2.2 泡沫提取物基质辅助激光解吸飞行时间串联质谱扫描
根据紫外-可见光全波长扫描,初步分析可知,螺旋藻粉泡沫提取液中多肽的含量比较高。为进一步确定提取液中所含物质和分子量,进而对其进行质谱分析,分析方法采用基质辅助激光解吸飞行时间串联质谱扫描(MALDI-TOF-MS),结果如图2所示,提取液中多肽分子量大多集中在5 000 D以下。另外,分子量在10 000 D和11 000 D左右有吸收波长,对比紫外全波长扫描结果,为藻蓝蛋白和别藻蓝蛋白。对质谱扫描图中2000~5000区域进行分析可知,取液中多肽的分子量主要为:2 230、2 278、2 358、2 484、2 556、2 612、2 845、2 953、2 994、3 017、3 034、3 301、3 541、3 748、3 775、3 884、4 261 D。分子量小于5 000 D的多肽大多具有抗氧化活性能力。
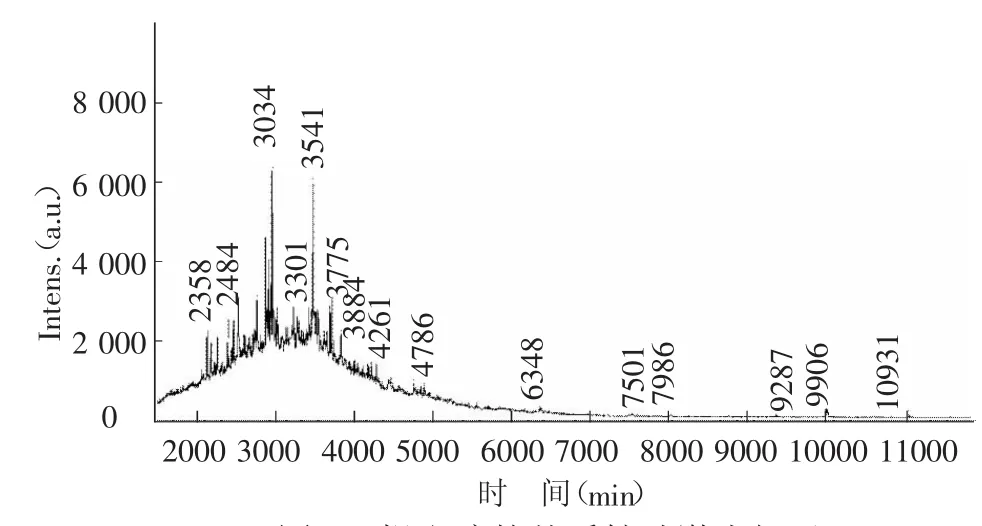
图2 提取液的基质辅助激光解吸飞行时间串联质谱扫描图
2.3 料液比和pH值对螺旋藻多肽溶解率的影响
溶解率是指原液中多肽的质量与藻粉质量之比。由图3可知,随着料液比的增加,pH值的降低,螺旋藻多肽溶解率逐渐降低。当料液比为0.5 g/L时,pH值从5到9,多肽溶解率增加了2倍多。随着料液比的增加,螺旋藻多肽的溶解率差距逐渐缩小,当料液比达到2 g/L时,不同pH值下溶解率非常接近。随着料液比的增加,pH值对溶解率的影响越来越小。另外,越接近多肽的等电点,多肽的溶解率越低,pH=5更接近螺旋藻多肽的等电点[13]。

图3 料液比和pH值对螺旋藻多肽溶解率的影响
2.4 料液比和pH值对螺旋藻多肽回收率的影响
回收率指提取液与原液中多肽质量的百分比。由图4可知,在相同pH值下,随着料液比的增加,螺旋藻多肽回收率增加。当pH=9时,料液比从0.5 g/L增加到2 g/L,回收率从25%上升到92%,料液比对回收率影响显著。当料液比大于1 g/L时,多肽回收率增加的速度减缓。随着料液比的增加,pH值对回收率的影响越发显著,在料液比0.5 g/L时,W(pH=9)与W(pH=7)相差4%,在料液比2 g/L时,W(pH=9)与W(pH=7)的差值增加至近30%。
2.5 料液比和pH值对螺旋藻多肽提取率的影响

图4 料液比和pH值对螺旋藻多肽回收率的影响
提取率是指提取液螺旋藻多肽质量与藻粉质量的百分比。提取率的值等于回收率和溶解率的乘积。由图5可知,在相同料液比下,提取率随pH值的增加而提高;相同pH值下,提取率随着料液比的增加先提高而后降低。在pH=9时,当料液比从0.5 g/L增加到1 g/L后,提取率提高了近2倍。在所选pH值和料液比范围内,当pH=9、料液比为1g/L时,螺旋藻多肽提取率达到最大值。综合考虑溶解率、回收率和提取率3种因素,选取pH=9、料液比1 g/L为最佳工艺参数。

图5 料液比和pH值对螺旋藻多肽提取率的影响
2.6 螺旋藻多肽的总还原力
由图6可知,螺旋藻多肽提取物在浓度较低范围内,同Vc相比,还原能力较差。在测定范围内随着浓度的增加吸光度值也增加,说明多肽提取物的还原能力具有较好的效量关系。Vc是较强还原剂,低浓度时还原能力已经很强,随着浓度增加吸光度值增加缓慢。在浓度为10 mg/mL时,多肽提取物的还原能力达到同浓度Vc的81.7%。
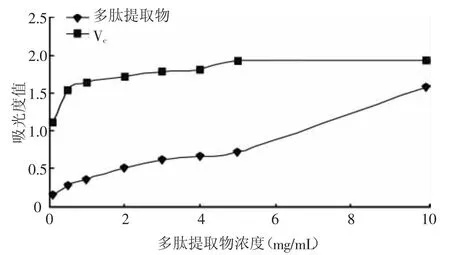
图6 螺旋藻多肽、Vc的还原能力
2.7 螺旋藻多肽对超氧阴离子自由基清除能力
超氧阴离子自由基是所有氧自由基中的第一个自由基,可经过一系列反应生成其他氧自由基,氧化能力很强,因此清除超氧阴离子具有特别重要的意义。由图7可知,多肽提取物对邻苯三酚自氧化体系产生的超氧阴离子有一定清除作用,随着浓度增加多肽提取物对超氧阴离子的清除率上升,剂量关系明显。当多肽提取物浓度为6 mg/mL时,对超氧阴离子的清除率达到47.3%。而对于Vc来说,在测定浓度范围内,对超氧阴离子的清除率迅速增大达到100%,然后保持不变。
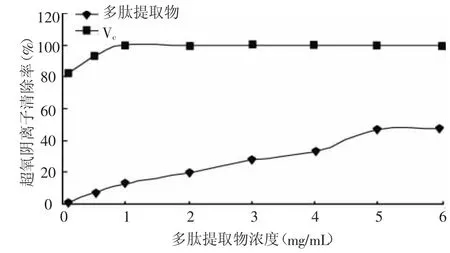
图7 螺旋藻多肽、Vc对超氧阴离子的清除作用
2.8 螺旋藻多肽对羟基自由基清除能力的测定
羟基自由基是生命活动代谢过程所产生的自由基中最强的氧化剂,比高锰酸钾和重铬酸钾的氧化性还强,是氧气的三电子还原产物,反应性极强,只要一产生,就会和缓冲液发生反应,几乎可以和所有细胞成分发生反应,对机体伤害极大。由图8可知,随着浓度增加,多肽提取物和Vc对羟自由基的清除率同时增大,多肽提取物的增率较Vc小一些。Vc在2 mg/mL时,清除率已达到100%,随后保持不变。多肽提取物在较小浓度5 mg/mL时,对羟基自由基的清除率为87.93%。由此可见,多肽提取物对羟自由基的清除效果较好。
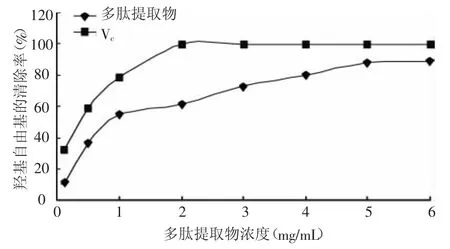
图8 螺旋藻多肽、Vc对羟基自由基的清除作用
3 讨论与结论
采用泡沫分离法提取螺旋藻多肽,对提取液进行紫外可见光扫描和MALDI-TOF-MS质谱扫描发现,多肽分子量主要集中在5 000 D以下。综合考虑溶解率、回收率和提取率3种因素,选取pH=9、料液比1 g/L为最佳工艺参数。对提取物进行抗氧化研究发现,提取物有一定抗氧化能力且与浓度呈剂量关系。提取物的还原能力和超氧阴离子清除能力与Vc相比较低,可能因为其成分复杂且未纯化有关。但其对羟自由基的清除能力,在较低浓度5 mg/mL时,达到了相同浓度Vc的87.93%,具有较好的清除率。
泡沫分离法与常用的酶解法提取多肽相比,前者得到的多肽分子量大多在5 000 D以下,且具有较强的抗氧化能力。后者为了得到分子量5 000 D以下的抗氧化多肽需要对其进行更加复杂的分离纯化,选用超滤过膜或凝胶层析[14-15]。两者提取率相差不大[16],泡沫分离法实验设备简单,方法简洁、环保,通常只需30~40 min,耗时较短。而酶解法通常需要复杂的仪器设备,种类繁多的化学试剂,繁琐的蛋白提取步骤,耗时较长[17]。对于泡沫分离法提取的小分子多肽,具有较强的抗氧化活性,是一种天然的抗氧化剂,可应用在保健品和食品与饲料添加剂等方面。另外,抗氧化活性通常还与抑菌活性相关[18],还可以对其进行更广泛的研究。
[1]李玉宝,郑 江,黎中宝,等.利用沼气废液培养螺旋藻[J].安徽农业科学,2011,39(22):13668-13670.
[2]田 辉,谯顺彬,彭晓东,等.无机与有机碳源混合营养培养对钝顶螺旋藻生长的影响[J].贵州农业科学,2011,39(10):122-124.
[3]邓成萍,薛文通,孙晓琳,等.不同分子量段大豆多肽功能特性的研究[J].食品科学,2006,27(5):109-112.
[4]赵世光,张 焱,薛正莲,等.酶法水解油茶籽粕制备油茶籽多肽的研究[J].中国油脂,2011,36(4):60-63.
[5]王立晖,袁永俊,孙勇民,等.生物活性多肽分离与检测的研究进展[J].农产品加工学刊,2008,(6):21-24,27.
[6]蔡金星,刘秀凤,常学东,等.蚕豆蛋白质提取分离及其物化性质研究[J].食品工业科技,2007,28(10):142-144.
[7]高 英,俞玉忠.福林酚法测定脑蛋白水解物溶液中的多肽含量[J].海峡药学,2004,16(6):57-58.
[8]Yen H H,Fereidoon S.Antioxidant avtivity of green tea and its catechins in a fish meat model system[J].J Agric Food Chem,1997,45:4264-4365.
[9]Beauchamp C,Fridocich I.Superoxide dimutase:Improved assays and an assay applicable to acrylamide gels[J].Anal Biochem,1971,44:276.
[10]阎欲晓,粟桂娇.文蛤肉酶解液清除自由基能力的研究[J].食品工业科技,2004,25(10):60-62.
[11]倪国华,宋焕禄.凝胶过滤分离鸡肉蛋白酶解物时紫外检测波长的选择[J].食品研究与开发,2002,23(5):73-75.
[12]殷 钢,刘 铮,刘 飞,等.钝顶螺旋藻中藻蓝蛋白的分离纯化及特性研究[J].清华大学学报(自然科学版),1999,39(6):20-22.
[13]朱 劼,董文杰,刘 佳.超声波协同等电点沉淀法提取螺旋藻藻胆蛋白工艺的优化[J].食品科学,2010,31(10):146-150.
[14]宋育璇.低分子量胶原多肽的制备及其抗氧化活性研究[D].太原:山西大学,2009.
[15]武萌萌.螺旋藻抗氧化多肽的制备及活性研究[D].北京:北京林业大学,2010.
[16]王洪涛,付学军,申京宇,等.海参多肽、多糖综合提取工艺条件的优化[J].食品与生物技术学报,2006,25(6):83-86.
[17]周利亘,陈新峰,王君虹,等.大豆多肽复合酶解工艺条件研究[J].食品科技,2005,(7):22-25.
[18]胡林子,马永全,于 新,等.紫甘薯色素抗菌与抗氧化作用研究进展[J].食品工业科技,2011,32(2):389-392.

