乌鳢鱼卵中胰蛋白酶抑制剂的分离纯化及性质研究
欧 雪 ,袁卉华,刘铮兆,吴守亮,顾婷婷,韩曜平
(常熟理工学院 生物与食品工程学院,江苏 常熟 2 15500)
蛋白酶抑制剂是一类能抑制蛋白水解酶催化活性的蛋白或多肽[1].蛋白酶抑制剂具有防止生物体内不必要的蛋白降解的作用,能调节各种蛋白酶的催化活性[2-3].作为自然界中含量最为丰富的蛋白种类之一,蛋白酶抑制剂广泛分布于植物、动物和微生物的组织中[4-6].
研究发现,鱼类组织中存在多种具有生物活性的蛋白及多肽.近年来,有学者报道了来源于几种鱼血清[7-8]、肌肉[9-11]和卵中的胰蛋白酶抑制剂[12-14].然而,迄今为止,有关鱼卵中胰蛋白酶抑制剂的纯化研究还比较少.特别是对于淡水鱼卵中蛋白酶抑制剂的研究在国内尚属空白.本研究以乌鳢鱼卵为研究材料,利用凝胶层析和发色底物检测等技术手段从乌鳢鱼卵中分离纯化得到了一种胰蛋白酶抑制剂,并进一步研究其部分理化性质,为淡水鱼卵的高效利用提供理论依据.
1 材料及方法
1.1 实验材料
试验用鱼为乌鳢(Ophicephalus argus),均采购于江苏省常熟市农贸市场,共5条,体重为500~1000 g,体长300~500 mm,全部为性成熟雌体.
胰蛋白酶(Trypsin),发色底物N-Benzoyl-L-Arg-4-nitroanilide hydrochloride(B-3133),购自Sigma公司;Sephadex G-50凝胶,Sephadex G-75凝胶,购自美国GE(Pharmacia)公司.其他国产试剂为分析纯,符合要求.
试验用主要仪器有冷冻离心机、成套层析设备、蛋白电泳仪、紫外/可见分光光度计等.
1.2 分离纯化[15]
1.2.1 卵匀浆液的制备
活体乌鳢鱼用水清洗干净,鱼体剖腹取卵,用清水冲洗干净血污,加适量纯水后,研磨匀浆,4℃,10000 rpm,离心30 min,收集上清液,制成冻干粉备用.
1.2.2 Sephadex G-50凝胶过滤层析
用0.1 M磷酸氢盐缓冲溶液(PBS,pH6.0)平衡凝胶过滤柱(2.6×100 cm);将冻干粉溶解于适量的0.1 M磷酸氢盐缓冲溶液(pH6.0)中,12000 rpm,20 min离心,取上清液用0.45 um滤膜过滤后上样于平衡好的Sephadex G-50凝胶过滤柱(100 cm×2.6 cm),用平衡用缓冲溶液进行洗脱,流速3 mL/10 min,收集洗脱液,280 nm紫外分光光度计检测各收集管蛋白或多肽含量,收集活性峰,冻干备用.
1.2.3 Sephadex G-75凝胶过滤层析
用0.1 M磷酸氢盐缓冲溶液(PBS,pH6.0)平衡凝胶过滤柱(2.6×100 cm);将Sephadex G-50凝胶过滤层析得到的活性峰冻干粉溶于0.1 M磷酸氢盐缓冲溶液(PBS,pH6.0)中,12000 rpm,20 min离心,取上清液用0.45 μm滤膜过滤后上样于平衡好的Sephadex G-75凝胶柱,用平衡用缓冲溶液进行洗脱,流速2.6 mL/10 min,收集洗脱液,280 nm紫外分光光度计检测各收集管蛋白含量,合并各洗脱峰,冻干备用.
1.3 乌鳢鱼卵蛋白酶抑制剂活性检测及抑制常数确定[15]
蛋白酶抑制剂活性检测参照文献[15],具体方法如下:在50 mM Tris-HCl缓冲溶液的反应体系中,于25℃测定待测样品对胰蛋白酶水解生色底物的抑制影响,将不同浓度的待测样品与蛋白酶(终浓度为30 nM 胰蛋白酶)于25℃保温15 min,加入终浓度为0.3 mM的发色底物(B-3133)起动反应.连续3 min于405 nm处监测光吸收的变化.分离纯化的每一步均采用胰蛋白酶与发色底物(B-3133)检测抑制剂活性.1单位的酶活由每分钟释放的对硝基苯胺的量来表示,1单位的抑制作用指对每分钟释放1 nmol的对硝基苯胺胰蛋白酶活性的抑制.
乌鳢鱼卵蛋白酶抑制剂对蛋白酶的抑制稳定性测定方法如上.能够被抑制的蛋白酶分别与反应缓冲液、相应浓度纯化的卵蛋白酶抑制剂于25 ℃保温,时间分别为0.5 h、1 h、4 h、8 h、12 h、16 h、20 h和24 h.以无抑制剂时的酶活力为100%,计算剩余酶活力.
按照Dixon的方法[16]测定纯化的乌鳢鱼卵丝氨酸蛋白酶抑制剂对蛋白酶的抑制常数(Ki)[7].简单过程为:不同量纯化的乌鳢鱼卵蛋白酶抑制剂溶解于50 mM Tris-HCl缓冲溶液中,分别与一定量的胰蛋白酶(最终浓度为68 nM)于室温下保温15分钟,最后加入酶相对应的发色底物启动反应,于405 nm处监测 5 min内吸收值的变化,空白对照加同抑制剂体积的50 mM Tris-HCl缓冲溶液.抑制常数按公式Ki=[I]/(V0/V1+1)计算,其中[I]为乌鳢鱼卵丝氨酸蛋白酶抑制剂的摩尔浓度,V0为空白对照(无抑制剂)反应的反应速度,V1为加抑制剂时的反应速度.实验重复6次,取平均值.
1.4 SDS-PAGE电泳及分子量的测定
分离纯化过程各组分的纯度用SDS-PAGE电泳检测.SDS-PAGE参考汪家政的方法[16],采用不连续高pH电泳胶,分离胶浓度为12%,pH8.8;堆积胶浓度为3.9%,pH6.8.SDS-PAGE中,纯化的样品在上样缓冲液(非还原状态)中,100℃处理5 min.凝胶于含0.1%考马斯亮兰R-250的甲醇/乙酸/水(3/1/6)中染色.标准分子量蛋白为上海生化所的分子量蛋白质分子量标准.纯化样品分子量用SDS-PAGE电泳测定.
1.5 乌鳢鱼卵的蛋白酶抑制剂的热及酸碱稳定性[15]
1.5.1 热稳定性
纯化的乌鳢鱼卵蛋白酶抑制剂样品溶液(终浓度45 nM)在30℃、40℃、50℃、60℃、70℃、80℃、90℃和100℃加热10 min,取出后立即冷却,然后按前面1.3检测抑制剂活性的方法测定处理样品的抑制活性.
1.5.2 酸碱稳定性
纯化的乌鳢鱼卵蛋白酶抑制剂样品溶液(终浓度45 nM)与等体积的pH2~11的各种缓冲溶液混合,4℃放置18小时,然后用0.4 MTris-HCl缓冲溶液,pH7.8调整抑制剂混合溶液的pH值为7.8并测定其抑制剂活性.
1.6 蛋白浓度测定
蛋白浓度测定采用BCA(Bicinchoninic Acid,二喹啉甲酸)法(试剂盒,购自上海鼎国生物公司)测定样品蛋白含量,以牛血清白蛋白为标准蛋白.
2 结果与分析
2.1 乌鳢鱼卵蛋白酶抑制剂分离纯化
乌鳢鱼卵匀浆液经Sephadex G-50凝胶过滤曲线图谱见图1.乌鳢鱼卵匀浆液经此步分离得到2个峰,以B-3133为底物经tryspin抑制活性测定发现,活性峰为第I峰(箭头所指).收集合并活性峰,冻干备用.
合并Sephadex G-50凝胶过滤的第Ⅰ峰冻干后经Sephadex G-75凝胶过滤层析,所得图谱见图2.经胰蛋白酶抑制活性测定发现,第Ⅰ峰(箭头所指)胰蛋白酶抑制活性最高,收集该峰备用.

图1 乌鳢鱼卵过Sephadex G-50凝胶过滤洗脱曲线
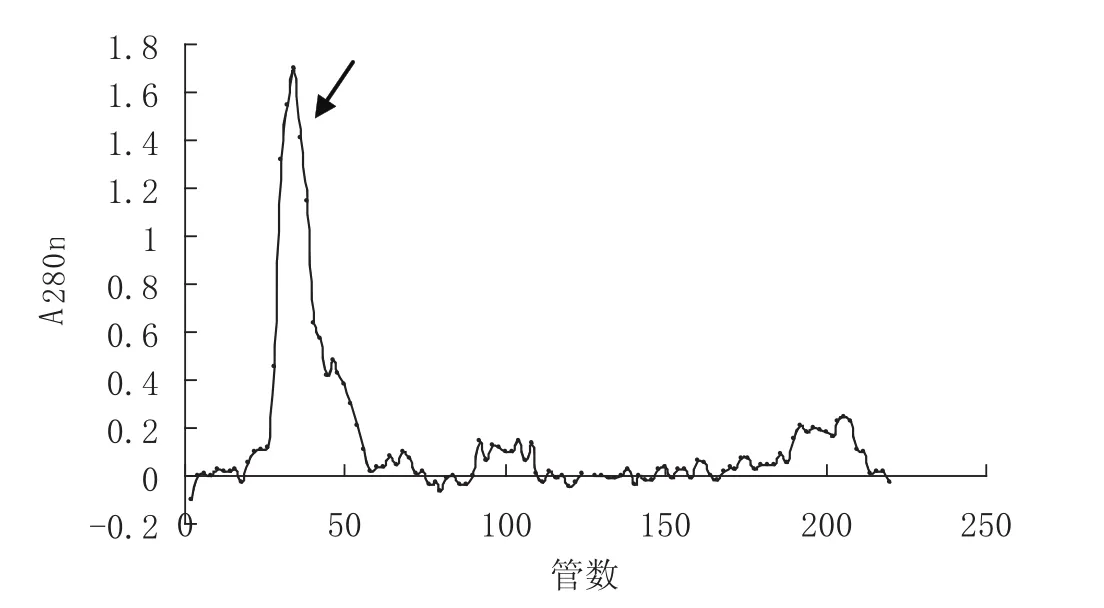
图2 Sephadex G-50凝胶过滤层析所得第Ⅰ峰过Sephadex G-75凝胶过滤洗脱曲线
2.2 SDS-PAGE蛋白电泳
在SDS-PAGE还原与非还原条件下,纯化的蛋白酶抑制剂(lane2,lane3)表现出单一条带,表明该蛋白不含二硫键.其表观分子量分别约为42 kDa,而未通过Sephadex G-50的样品(lane4,lane5)条带较多(见图3).表明达到了很好的分离效果.
2.3 乌鳢鱼卵丝氨酸蛋白酶抑制剂活性检测及抑制常数的确定
从图4可以看出,纯化的乌鳢鱼卵提取液的丝氨酸蛋白酶抑制剂能抑制胰蛋白酶水解底物的活性.当乌鳢鱼卵提取的抑制剂蛋白浓度约为130 μg/mL(箭头所指)以上时,可以抑制95%以上的68 nM浓度的胰蛋白酶的水解活性.
通过实验数据按抑制常数(Ki)公式计算[15],纯化的乌鳢鱼卵丝氨酸蛋白酶抑制剂的抑制常数为30.3 nM.

图3 分离纯化乌鳢卵丝氨酸蛋白酶抑制剂及未纯化样品的SDS-PAGE电泳分析
2.4 乌鳢鱼卵的丝氨酸蛋白酶抑制剂的热及酸碱稳定性
乌鳢鱼卵提取物的丝氨酸蛋白酶抑制剂热的稳定性检测见图5,从检测的数据看,在30~100℃温度处理的条件下,纯化的乌鳢鱼卵的丝氨酸蛋白酶抑制剂能抑制胰蛋白酶对发色底物(B-3133)的水解活性,即使温度高达100℃,仍能保持75%以上的抑制剂活性.
对酸碱的稳定性检测见图6.在pH2~11处理条件下,纯化的乌鳢鱼卵的丝氨酸蛋白酶抑制剂对胰蛋白酶水解发色底物(B-3133)的抑制活性几乎达到了90%以上.只有在pH值为12时酶活性才降低到50%.说明这种丝氨酸蛋白酶抑制剂具有很强的热稳定性和酸碱稳定性.本研究为该种丝氨酸蛋白酶的利用提供了有价值的信息,也为大规模分离纯化该种抑制剂提供了新思路,即可以通过加热及酸碱处理,先期除去部分不耐热和酸碱的蛋白质,使分离纯化效率更高.
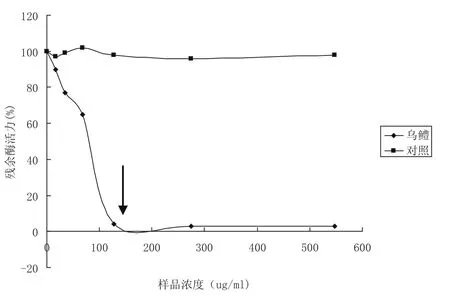
图4 鱼卵提取物对蛋白酶抑制活性检测
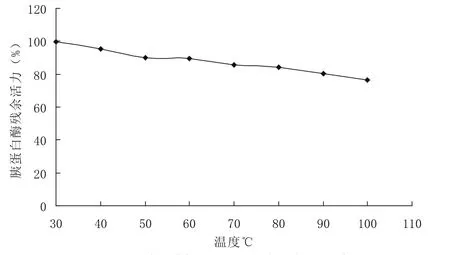
图5 温度对乌鳢鱼卵蛋白酶抑制活性的影响
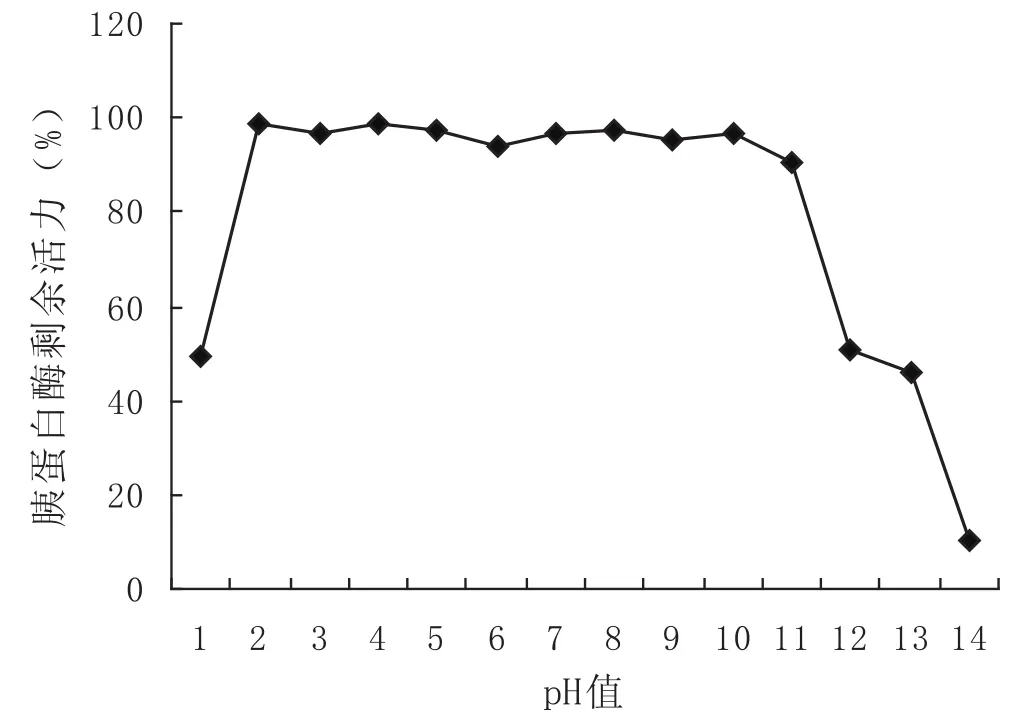
图6 pH对乌鳢鱼卵蛋白酶抑制活性的影响
3 讨论
本研究通过凝胶色谱技术,从乌鳢鱼卵的匀浆液中得到了表观分子量大约为42 kDa的丝氨酸蛋白酶抑制剂,该抑制剂对胰蛋白酶有专一性的抑制作用.对该抑制剂进行的稳定性研究表明,该蛋白酶抑制剂在pH2~11时有比较好的pH稳定性和温度在30~100℃有较好的热稳定性.
目前,有关鱼卵中蛋白酶抑制剂的研究已有一些报道[12-14].这些已纯化和鉴定的抑制剂基本属于半胱氨酸蛋白酶抑制剂.对其理化性质尤其是热稳定性和酸碱稳定性的研究将有助于推动该类抑制剂的利用.已有研究结果表明[12-14,17-18],半胱氨酸蛋白酶抑制剂的热稳定性在50℃以下;酸碱稳定性一般在pH3~10范围内.因此,热稳定性和酸碱稳定性高的蛋白酶抑制剂在一些高温及极度偏酸碱的条件下,如食品加工、临床用药等应用蛋白酶抑制剂,可避免因环境条件严酷带来的活性丧失.本研究所分离的蛋白酶抑制剂在pH2~11时有较好的pH稳定性和温度在30~100℃有较好的热稳定性.因此,该抑制剂具有很高的实用价值.
[1] Laskowski M,Kato I. Protein inhibitors of proteinases[J]. Annu Rev Biochem,1980,49:593-626.
[2]Bode W ,Huber R.Natural protein proteinase inhibitors and their interaction with proteinases[J]Eur JBiochem,1992,204:433-451.
[3]Otlewski J,Krowarsch D,Apostoluk W.Protein inhibitors of serine proteinases[J].Acta Biochimica Polonica,1999,46:531-565.
[4]Pubols MH.Isolation,purification and amino acid sequence of a secretory trypsin inhibitor from chicken pancreas[J].Poult Sci,1990,69:640-646.
[5]赵欣,付煊赫,张宗申,等.鹰嘴豆种子胰蛋白酶抑制剂的分离纯化与鉴定[J].中国生物化学与分子生物学报,2011,27(3):287-292.
[6]Birk Y.Protein proteinase inhibitors in legume seeds[J].Arch Am Nutrition,1994,44:26-30.
[7]AranishiF.Purification and characterization ofserum serpin from carp(Cyprinus carpio)[J].Mar Biotech,1999(1):81-88.
[8]黄素文,陆承平.七种常见养殖鱼血清胰酶抑制活性的比较[J].水产学报,2003,27(5):415-419.
[9]Martone CB,Busconi L,Folco E,et al.Detection of a trypsin-like serine protease and its endogenous inhibitor in hake skeletal muscle[J].Arch Biochem Biophys,1991,289:1-5.
[10]Sangorrin MP,Folco EJ,Martone CM,etal.Purification and characterization ofa proteinase inhibitor from white croaker skeletal muscle(Micropogon opercularis)[J].Int JBiochem Cell Biol,2001(3):691-699.
[11]胡新颖,刘欢,张楠,等.白鲢骨骼肌丝氨酸蛋白酶抑制剂的提取、纯化及其特性[J].中国水产科学,2006,13(2):316-321.
[12]Yamashita M,Konagaya S.A novel cysteine proteaseinhibitor of the egg of chum salmon,containing a cysteinerich thyroglobulin-likemotif[J].JBiolChem,1996,271(3):1282-1284.
[13]Choi JH,Park PJ,Kim SK.Purification and characterization ofa trypsin inhibitor from theegg ofskipjack tuna Katsuwonuspelamis[J].Fisheries Science,2002,68:1367-1373.
[14]Ustadi,Kim K Y,Kim SM.Purification and Identification ofa Protease Inhibitor from Glassfish(Liparis tanakai)Eggs[J].JAgric Food Chem,2005,53(20):7667-7672.
[15]韩曜平.无指盘臭蛙和山溪鲵皮肤及卵中3种生物活性多肽的分离鉴定和克隆[D].南京:南京农业大学,2006.
[16]汪家政,范明.蛋白质技术手册[M].北京:科学出版社,2000:8.
[17]TsaiYJ,Chang GD,Huang CJ,etal.Purification andmolecular cloning of carp ovarian cystatin[J].Comp Biochem Physiol Part B,1996,113:573-580.
[18]Koide Y,Noso T.The complete amino acid sequence of pituitary cystatin from chum salmon[J].Biosci Biotechnol Biochem,1994,58:164-169.

