6-甲基-1-茚酮的光敏化合成与纯化
王帅,董伟兵,孟繁博,张俊杰
(1.河北联合大学 化学工程学院,河北 唐山 063009;2.河北联合大学 生命科学学院,河北 唐山 063009)
取代茚酮是重要的药物合成前体,常用于药物合成。茚酮结构广泛存在于天然产物、药物、农药等生物活性分子中,也是有机发光、光致变色、染料等材料中的重要结构单元。近年来关于茚酮类化合物的报道较多[1-3]。利用光化学合成茚酮具有比以前的方法更简洁、合成反应的中间步骤少、产率高等特点,且产物易分离、反应条件温和[1]。本研究是对光化学合成6-甲基-1-茚酮方法的改进,极大地简化了生产工艺,实现了绿色化学反应,具有较好的应用前景。
1 实验部分
1.1 试剂和仪器
除非特殊说明,化学试剂一般为化学纯,溶剂二甲苯为分析纯。
Bruker EQUINOX 55型红外光谱仪;Bruker 300 MHz核磁共振光谱仪;Thermo Finnigan Polaris Q气质联用仪(HP-5型毛细管柱);Hewlett Packard Model HP 6890 Series气相色谱仪(HP-5型毛细管柱);VARIAN Cary-100 Bio紫外分光光度计;北京泰克仪器有限公司X-4型数字显微熔点仪(熔点未校正)。
TLC板(自制)。
1.2 实验方法
1.2.1 傅-克(Friedel-Crafts)酰基化反应
取对二甲苯19.0mL(150.0mmol)于100mL四口烧瓶中,加入3.0mL氯乙酰氯(37.1mmol),在氮气保护下,加入5.50g(41.2mmol)无水三氯化铝。在电磁搅拌和冰浴条件下,反应1小时。在室温条件下搅拌2小时,可见大量盐酸产生,可使湿润试纸变红。盐酸应导入到氢氧化钠溶液中吸收。必要时可以用石油醚稀释。
反应的混合物,倒入100mL含有4mL浓盐酸的冰水混合液中,放置到冰融化后,用100mL对二甲苯分两次萃取,合并有机相并用水萃取至中性。利用硫酸镁干燥过夜。砂芯漏斗中垫入少许硅胶,抽滤。TLC板检测。
1.2.2 苯甲酸-(2,5-二甲基)-苯甲酰甲基酯的合成
称取2,5-二甲基-苯甲酰甲基氯546mg(310mmol)溶解于50mL二甲苯溶液中,加入316mmol相应的羧酸和316mmol的三乙胺作为缚酸剂和500mg(310mmol)KI作为引发剂,在二甲苯中回流反应120min。反应的混合物经乙酸乙酯和水萃取,有机相用无水硫酸钠干燥。抽滤,利用旋转蒸发脱除有机溶剂后在石油醚中重结晶。TLC板检测。
1.2.3 2,5-二甲基苯甲酰甲基氯的光解反应研究
用对二甲苯稀释酰基化反应后的溶液,每加入10mL对二甲苯用TLC板监测一次,稀释后的浓度以用TLC板监测时点的颜色深浅适中为宜。
取10mL溶液加入石英管中,通过改变温度以及加入辅助试剂等在紫外灯下进行光化学反应,每二十分钟监测一次,观察是否有新点产生。
2 结果与讨论
2.1 傅-克酰基化反应
试验中我们将对二甲苯的用量过量,对二甲苯既作为反应原料,同时也是溶剂。反应产物经过处理和硅胶过滤后,溶液仍有些颜色,此时可以利用活性炭吸附脱色,以保证后续的光化学反应能够有效的克服内滤光效应。
实验产物经TLC板检测,发现除对二甲苯原料外,新生成产物为单点。经过柱色谱分离产物,经过波谱表征,与文献报道相同[1],证明产物 2,5-二甲基苯甲酰甲基氯生成。
图1分别给出了2,5-二甲基苯甲酰甲基氯、苯甲酸-(2,5-二甲基)-苯甲酰甲基酯、6-甲基-1-茚酮在不同比例展开剂(乙酸乙酯:石油醚)中的迁移率曲线。由曲线1可以得出:应用乙酸乙酯:石油醚=1:20展开剂,可以有效地将傅-克酰基化反应中的产物2,5-二甲基苯甲酰甲基氯与弱极性的原料对二甲苯分离,达到纯化2,5-二甲基苯甲酰甲基氯的目的。

图1 各级产物迁移率曲线
2.2 苯甲酸-(2,5-二甲基)-苯甲酰甲基酯的合成

图2 酯化反应三乙胺用量曲线
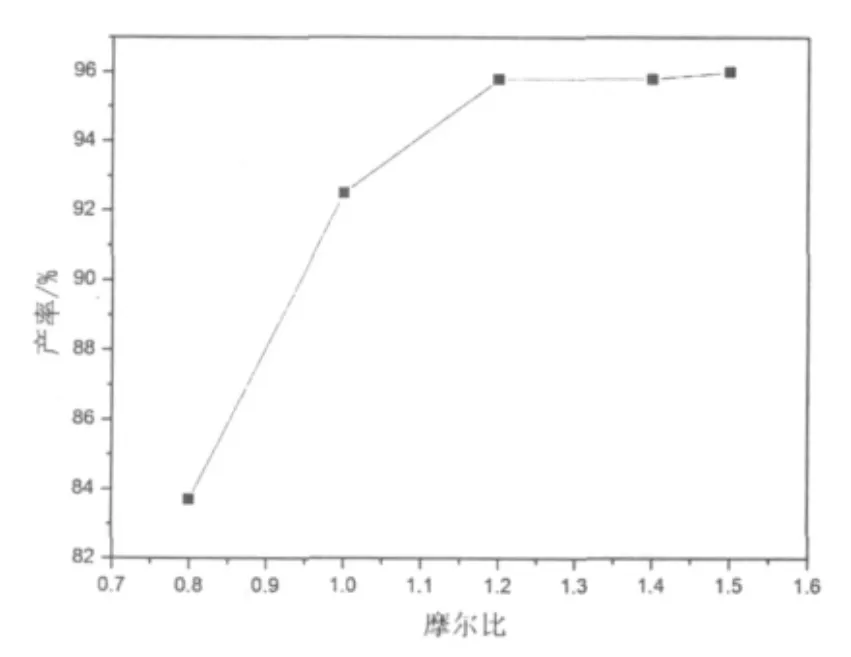
图3 酯化反应苯甲酸用量曲线
2.2.1 三乙胺用量的影响
三乙胺能有效地催化2,5-二甲基苯甲酰甲基氯与苯甲酸的酯化反应,图2给出了三乙胺用量对酯化反应产率的影响。由图2可见,三乙胺的用量为2,5-二甲基苯甲酰甲基氯的1.2倍(摩尔比)时,酯化反应产率可以达到95%以上。
2.2.2 苯甲酸用量的影响
羧基是一个较氯原子更好的离去基团,文献[1]曾用取代苯甲酰氯代烷酯化的方法得到相应的酯,通过光解进一步得到相应的取代茚酮。图3给出了2,5-二甲基苯甲酰甲基氯与苯甲酸的酯化反应中苯甲酸的用量曲线。由图3可见,苯甲酸的用量为2,5-二甲基苯甲酰甲基氯的1.2倍(摩尔比)时,酯化反应产率可以达到96%以上。
苯甲酸-(2,5-二甲基)-苯甲酰甲基酯的分离,可以采用石油醚中重结晶或柱色谱分离,图1中曲线2和曲线3分别给出了苯甲酸-(2,5-二甲基)-苯甲酰甲基酯和6-甲基-1-茚酮在不同比例展开剂(乙酸乙酯:石油醚)中的迁移率(Rf),实验结果表明:柱色谱分离纯化6-甲基-1-茚酮可以乙酸乙酯:石油醚=1:20进行分离,去除2,5-二甲基苯甲酰甲基氯和苯甲酸-(2,5-二甲基)-苯甲酰甲基酯后,改用乙酸乙酯:石油醚=1:12的展开剂快速洗脱。收集的残液可以进一步用于傅-克酰基化反应。苯甲酸-(2,5-二甲基)-苯甲酰甲基酯的表征数据与文献报道相同[1]。
2.3 2,5-二甲基苯甲酰甲基氯的敏化光解反应
2.3.1 温度对光解反应的影响
实验研究了室温和50℃条件下的2,5-二甲基苯甲酰甲基氯光解生成6-甲基-1-茚酮的现象。在室温中,光解产物生成率较低,光解3小时产率约为5%;提高反应温度对于光化学反应作用不大,由室温升高到50℃时,光解3小时后产率提升至8%左右。
2.3.2 2,5-二甲基苯甲酰甲基氯光敏化现象的研究
考虑到苯甲酸-(2,5-二甲基)-苯甲酰甲基酯(量子效率0.23)比2,5-二甲基苯甲酰甲基氯(量子效率0.09)更容易光解的特点[1,4,5],本文选择了在50℃条件下,加入三乙胺、苯甲酸和少量碘化钾边酯化边光解的方法合成6-甲基-1-茚酮。实验结果表明:在50℃条件下,光解2小时,6-甲基-1-茚酮约占50%,苯甲酸-(2,5-二甲基)-苯甲酰甲基酯有45%,2,5-二甲基苯甲酰甲基氯还剩大约5%。可见6-甲基-1-茚酮的合成速度得到明显提高,速率大约提高了16倍,也表明了苯甲酸具有敏化光解反应的作用。本方法简化了反应工艺和省略了酯化步骤,分离产物后的溶液可以进一步用于傅-克酰基化反应,节省了原料且减少了环境污染。
光解后的样品经过稀氢氧化钠水溶液萃取,水相和有机相分别保存。水相被进一步加热除水,得到白色晶体,检验后可知为苯甲酸。有机相旋转蒸发脱除溶剂,在石油醚中重结晶,得到相应的取代茚酮,或通过色谱柱分离。分离后的残液,可以经过处理,再重新用于傅-克酰基化反应,实现了绿色化学反应。
2.3.3 光解反应及其机理的探讨
根据分离的产物分析,我们推测光化学反应的机理如图4所示。首先是在催化剂三乙胺的作用下,苯甲酸和2,5-二甲基苯甲酰甲基氯发生了酯化反应,该酯受到光照,吸收光子后,形成单线激发态,经过系间窜跃生产三重激发态。分子内发生1,5位氢转移,产生了烯醇式形态的激发态,存在有顺反两种构型。显然只有反式构型的形态有利于产生分子内环化,即形成茚酮。释放出的苯甲酸进一步参与反应,如此反复。
余下的有机残液进一步用于2,5-二甲基苯甲酰甲基氯的合成,这样实现了绿色化学反应,无有机残液排放,有利于环境保护,降低了生产成本。

图4 光敏化合成6-甲基-1-茚酮反应机理
3 结束语
本研究是对利用光诱导分子内氢转移形成烯醇化反应进而有效合成取代茚酮的光化学方法的改进。方法充分利用了相对苯甲酰类保护剂而言,羧基比氯原子是更好离去基团的特点,通过温和条件下的边合成边光解获得了一个有效的合成取代茚酮的新方法。反应在50℃温和条件下进行,极大地提高生成茚酮的速度,反应过程中只需加入少量的三乙胺和苯甲酸,由于生成茚酮后苯甲酸可以再和2,5-二甲基苯甲酰甲基氯反应,使反应循环进行,因此该方法简单、光反应的产率高,产物易分离纯化,而且具有绿色化学反应的特点,分离出产物后的残液主要是对二甲苯,经过处理可重新用于傅-克酰基化反应。
[1]张俊杰,刘桂芳,李红霞.一种光化学合成取代茚酮的有效方法[J].化学通报,2009,4:377-380.
[2]麻远,殷巍,赵玉芬.1-茚满酮合成方法研究进展[J].有机化学,2008,28(1):37-43.
[3]段义杰,刘建利,王翠玲.茚酮类化合物的研究进展[J].有机化学,2011,30(7):988-996.
[4]B.W.Rergmark,C.Barnes,J.Clark.et al.Photoenolization with α-Chloro Substituents[J].J.Org.Chem..1985,50(26):5612-5615.
[5]A.P.Pelliccioli,P.Klán,M.Zabadal et al.Photorelease of HCl from o-Methylphenacyl Chloride Proceeds through the Z-Xylylenol[J].J.Am.Chem.Soc.2001,123:7931-7932.

