整夜完全睡眠剥夺对某部队军人动态血压的影响
石亚君 王晋丽 杨庭树 宋小武 吴传勇 郭亚涛 牛卢芳 白婧 李牧 陈韵岱
睡眠是人类不可缺少的生理过程,占据了生命约1/3的时间。睡眠剥夺(sleep deprivation,SD)指人因环境或自身原因丧失了所需要的睡眠量的过程和状态,是部队在紧急情况下特别是自然灾害营救和战争发生时的常见现象,是导致人员疲劳衰竭,出现非战斗减员的重要因素之一[1]。在未来高科技战争条件下,SD问题更加突出。研究证实,血压可使心血管事件的发生率增加[2],是高血压的独立危险因子[3],而急性应激反应主要表现为肾素-血管紧张素-醛固酮系统(RAAS)的激活和儿茶酚胺水平的升高,引起血压升高,进而增加心血管事件的发生率。本研究旨在通过检测急性SD后军人动态血压、儿茶酚胺水平及肾素、血管紧张素和醛固酮水平的变化,探讨SD对军人的影响。
1 对象和方法
1.1 研究对象
整群抽样驻军某部队服役1年以上的军人共60名作为研究对象,均为体检健康青年男性,年龄19~23岁,平均(20.8±1.06)岁。
1.2 研究方法
1.2.1 SD的实行 研究在一间安静的监测室内进行,室内温度保持在20℃。采用急性整夜完全SD,持续24 h无睡眠[4]。要求受试者研究当天正常时间起床后即一直保持清醒状态,禁止打盹或小睡。禁止躺卧位,保持坐位或站立位,可进行一些日常活动,如阅读、玩游戏及走动等以保持清醒。整个过程由研究员监督和陪同。受试者在研究当天14∶00进入监测室,接受仪器安装,并于14∶30开始记录,至次日14∶30结束。研究方案通过医院伦理委员会审批,受试者均签署知情同意书。
1.2.2 动态血压监测 采用美国Suntech动态血压记录仪。所有接受SD的受试者均佩戴动态血压记录仪。动态血压设置22∶00~6∶00为正常夜间睡眠时间,白天每30 min监测1次,夜间每1 h监测1次。监测指标包括:全天平均心率、白天平均心率,夜间平均心率,平均收缩压、平均舒张压,各个时段的血压与心率,血压负荷,血压变异等。
1.2.3 血生化指标检测
1.2.3.1 儿茶酚胺检测 SD 24 h后采血取样,并在1周后再次取样,作为恢复期对照。检测指标包括:多巴胺、肾上腺素、去甲肾上腺素。测定方法:放射免疫法。采用 REF KIPL1600试剂(DIAsource Immunoassays s.s Belgium试剂公司生产)和西安核仪器厂的XH6080放射免疫仪器,由北京北方生物技术研究所检测。
1.2.3.2 醛固酮、肾素和血管紧张素的检测 SD 24 h后采血取样,采用放射免疫法,由解放军总医院内分泌实验室检测。
1.3 统计学方法
2 结果
2.1 动态血压监测结果
记录数据有效率大于85%的受试者共57例。24 h全天平均心率(69.8±6.5)次/min,白天平均心率(70.8±7.1)次/min,夜间平均心率(67.8±7.8)次/min。全天平均收缩压(127.0±11.0)mm Hg,白天平均收缩压(127.0 ±10.8)mm Hg,夜间平均收缩压(126.7±13.0)mm Hg。全天平均舒张压(74.3±6.6)mm Hg,白天平均舒张压(74.4±6.8)mm Hg,夜间平均舒张压(74.0±9.3)mm Hg。全天收缩压负荷32.5% ±4.3%,全天舒张压负荷13.0%±2.4%。全天收缩压夜间血压下降0.5%±4.8%,全天舒张压夜间血压下降3.8% ±7.4%。白天收缩压负荷17.1% ±22.9%,白天舒张压负荷7.1%±10.5%。夜间收缩压负荷55.3% ±37.0%,夜间舒张压负荷26.5% ±28.8%。
2.2 SD 24 h后与恢复期儿茶酚胺水平比较血生化指标检测结果
配对样本t检验显示,SD 24 h后儿茶酚胺水平包括多巴胺、肾上腺素和去甲肾上腺素均较恢复期升高,差异有统计学意义(P<0.05),见表1。
表1 SD 24 h后与恢复期儿茶酚胺水平比较(±s)
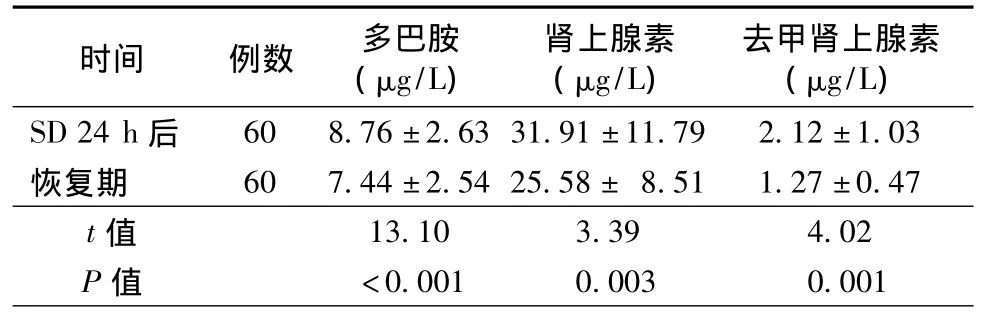
表1 SD 24 h后与恢复期儿茶酚胺水平比较(±s)
时间 例数 多巴胺(μg/L)肾上腺素(μg/L)去甲肾上腺素(μg/L)SD 24 h后60 8.76±2.63 31.91±11.79 2.12±1.03恢复期 60 7.44±2.54 25.58± 8.51 1.27±0.47 t值13.10 3.39 4.02 P值 <0.001 0.003 0.001
2.3 SD 24 h后肾上腺素水平与心率的相关性
双变量相关分析显示,SD 24 h后肾上腺素水平与平均心率呈正相关(r=0.446,P<0.05)。
2.4 肾素、血管紧张素、醛固酮水平检测
SD 24 h 后肾素 [(3.33 ± 2.00)nmol·L-1·h-1]、血管紧张素[(67.98 ±27.46)ng/L]和醛固酮[(495.58±70.04)pmol/L]水平升高,采用 T检验分析显示,SD后三者水平与参考值[肾素(0.82~2.00)nmol·L-1·h-1,血管紧张素(19 ±10)ng/L,醛固酮(0.1~0.2)pmol/L]比较差异有统计学意义(P<0.05)。
3 讨论
研究整夜完全SD对健康军人血压和血生化水平的影响,主要发现:(1)静息状态下急性SD后可引起夜间血压负荷的增加;(2)SD后儿茶酚胺水平升高,与恢复期比较差异有统计学意义;心率与肾上腺素水平呈正相关。
一般认为血压正常者24 h血压负荷应<10%,当血压负荷≥20%时,表明交感神经和迷走神经对血管调节的动态平衡受到破坏,提示交感神经活性增强,迷走神经活性减弱。本研究显示,急性整夜SD后血压昼夜节律消失,夜间血压负荷增加。长期血管系统处于高水平的血压负荷,交感神经系统、RAAS兴奋,使儿茶酚胺、肾素、血管紧张素等分泌增多,血压升高,最终导致高血压的发生[5]。另外长期血压负荷增加,与靶器官的损害程度相关,与左心室肥厚和心肌缺血的程度呈正相关[6]。而单独夜间血压负荷值增高是高血压发生的危险因素[7]。本研究显示,急性整夜完全SD可引起军人夜间血压负荷增加,提示有发生高血压的潜在风险。
血压和心率昼夜节律的变化是正常机体1 d中不同时间点不同活动水平的需求。体液中参与血压调节作用的许多活性物质(如去甲肾上腺素、肾素、血管紧张素、醛固酮等)均呈明显的昼夜节律变化,并与血压昼夜节律呈明显相关性。高血压时这些体液因子的变化可能是血压异常节律产生的病理基础。昼夜节律由机体的生物钟决定。有研究发现夜间/日间血压比值每下降10%,发生心血管事件的危险增加41%[8],而心率变异性的降低与心肌缺血程度呈正相关[9],SD作为一种应激原可通过各种途径诱发机体的氧化应激,包括SD后导致能量消耗代谢及自由基的增多,机体抗氧化能力降低以及通过内质网应激间接引起氧化应激三条途径[10]。本研究通过检测SD24 h后与恢复期血液中儿茶酚胺水平和RAAS活性物质的变化,探讨SD后血压和心率变化的可能机制。
本研究显示SD后儿茶酚胺较恢复期增高,而且心率与肾上腺素呈正相关,而肾素、血管紧张素和醛固酮均较参考值上限高,提示急性SD作为一种应激,可引起体内儿茶酚胺的增高和RAAS系统的激活。这与文献报道关于不同昼夜血压分布特征的高血压患者体内儿茶酚胺、肾素和醛固酮水平研究报道不一致,文献报道非杓型和超杓型高血压患者儿茶酚胺水平较杓型者高,而醛固酮和肾素水平在非杓型和杓型血压患者比较差异无统计学意义[11]。提示急性SD时,健康人机体对应激的反应与高血压患者存在差异。另外,RAAS基因的多态性会导致个体对原发性高血压的易感性或抵抗性[12],提示急性SD后RAAS的变化与个体反应密切相关。本研究还提示,儿茶酚胺和RAAS可能共同参与了SD过程中机体的生物学反应。
本研究显示健康军人急性SD后,夜间血压负荷增高,心率、血压昼夜节律消失,可能通过儿茶酚胺增高和RAAS系统的激活来调节血压,二者可能共同参与了SD对血压的调节作用,有待进一步研究证实。
[1]Zhang WM,Lin SC.Combat the effects of sleep deprivation and countermeasures.Chinese PLA Medical Information,1995,9:208-210.(in Chines)
张文明,林水成.作战睡眠剥夺的影响与对策.解放军医学情报,1995,9:208-210.
[2]Tofler GH,Stone PH,Maclure M,et al.Analysis of possible triggers of acute myocardial infarction(the MILIS study).Am J Cardiol,1990,66:22-27.
[3]Yaggi HK,Araujo AB,McKinlay JB.Sleep duration as a risk factor for the development of type 2 diabetes.Diabetes Care,2006,29:657-661.
[4]Zhong X,VXiao Y,Huang R,et al.The effects of overnight sleep deprivation on cardiovascular autonomic modulation.Chin J Intern Med,2005,44:577-580.(in Chinese)
钟旭,肖毅,黄蓉,等.整夜完全睡眠剥夺对心血管自主神经活动的影响.中华内科杂志,2005,44:577-580.
[5]Kim SY,VEuler DE.Baroreflex sensitivity assessed by complex demodulation of cardiovascular variability.Hypertension,1997,29:1119-1125.
[6]Zhang XR.The relationship of ambulatory blood pressure,blood pressure load and left ventricular hypertrophy in patients with hypertention.New Medical,2008,39:33-34.(in Chinese)
张新荣.高血压患者动态血压、血压负荷值及血压变异性与左心室肥厚的关系--附62例报告.新医学,2008,39:33-34.
[7]Wei X,LIAO H,He P,et al.Predictive Value of Nighttime Ambulatory Blood Pressure Load for Hypertension.Chin J Prev Contr Chron Dis,2011,19:377-378.(in Chinese)
韦汐,廖虹,贺平,等.夜间动态血压负荷值增高对高血压病的预测意义.中国慢性病预防与控制,2011,19:377-378.
[8]Guo YF,Yao LX.Circadian Rhythm of Blood Pressure:Clinical Significance of Dippers and Non-Dippers.Adv Cardiovasc Dis,2005,26:11-13.(in Chinese)
郭艺芳,姚丽霞.人体血压的昼夜节律:杓型与非杓型血压的临床意义.心血管病学进展,2005,26:11-13.
[9]Wang JL,Lu XL,Shi YJ,et al.Correlation between heart rate variability and total myocardial ischemia burden in 24h.J Chinese PLA Postgrad Med Sch,2011,32:922-923.(in Chinese)
王晋丽,卢喜烈,石亚君,等.心率变异性与24小时心肌缺血总负荷关系的研究.军医进修学院学报,2011,32:922-923.
[10]Jiang B,Zhao ZX.Oxidative stress induced by sleep deprivation:an update.Acad J Sec Mil Med Univ,2007,28:201-203.(in Chinese)
江波,赵忠新.睡眠剥夺诱发氧化应激反应研究进展.第二军医大学学报,2007,28:201-203.
[11]Guo YF,Stein PK,Yao LX,et al.Chronobiological feature of plasma catecholamine, renin, and aldosterone and their relationship with the circadian rhythm of blood pressure.Chin J Cardiol,2004,32:26-29.(in Chinese)
郭艺芳,Stein PK,姚丽霞,等.血浆儿茶酚胺肾素醛固酮与血压的昼夜节律.中华心血管病杂志,2004,32:26-29.
[12]Han S,Chong HL.Genetic basis of essential hypertension-Gene polymorphisms of renin-angiontensin-aldosterone system.Chinese Journal of Cardiovascular Medicine,2007,11:138-140.(in Chinese)
韩姗,丛洪良.原发性高血压的基因机制——RAAS系统基因多态性.中国心血管杂志,2007,11:138-140.

