红曲菌的复合诱变及其固态发酵条件的优化
杨欢欢,胡中泽*
(武汉工业学院食品科学与工程学院,湖北 武汉 430023)
红曲菌的复合诱变及其固态发酵条件的优化
杨欢欢,胡中泽*
(武汉工业学院食品科学与工程学院,湖北 武汉 430023)
通过紫外线和LiCl对一株红曲菌MP进行复合诱变,并通过响应面法对其固态发酵条件进行优化分析。结果表明:在前期温度为30℃,后期温度为24℃,初始含水量为60%的条件下,Monacolin K的产量最高可达5.33mg/g。
红曲菌;复合诱变;Monacolin K;响应面
红曲起源于中国,其在食品方面的应用已很广泛。目前,随着对红曲研究的深入,红曲在医药保健方面的用途也越来越受关注,其中功能性红曲在此方面的价值更为突出。功能性红曲是指可降胆固醇、治疗高血脂的红曲[1-2]。
红曲菌的主要功能性产物之一——Monacolin K是日本远藤章利用小型发酵罐深层发酵培养红曲菌得到的。Monacolin K抑制胆固醇形成的机理是Monacolin K能竞争性地抑制羟甲基戊二酰辅酶A (HMG-CoA) 还原酶(HMG-R),进而抑制了胆固醇的合成,其中HMGCoA还原酶是胆固醇合成中的限速酶[3]。Monacolin K还能增加胆固醇的分解代谢,降低甘油三酯及低密度脂蛋白(LDL)[4]。由于此种特性,如何提高红曲菌中Monacolin K的产量成为研究重点。
目前红曲生产中广泛采用的是固态发酵法,其具有投资少,产量大,生产经验丰富等优点[5]。生产Monacolin K一般也利用红曲菌固体发酵法,但在工业化固体培养时,培养条件对其产量的影响很大,因此合理设计固态发酵工艺条件是达到高产Monacolin K目的的关键步骤[6]。
本实验利用理化复合诱变方法提高红曲菌产Monacolin K的能力,并通过响应面分析法研究固态发酵过程中各工艺条件对红曲生产Monacolin K的影响,最终得到固态发酵条件的最优组合。
1 材料与方法
1.1 菌株与培养基
红曲菌MP 本实验室分离保藏。
基础培养基:麦芽汁10°Bx,琼脂2%。用作斜面和平板培养。固态发酵培养基:适量发芽糙米洗净浸泡后于250mL锥形瓶中蒸煮,灭菌20min。
1.2 试剂与仪器
无水乙醇、磷酸(分析级)、乙腈(色谱级)、洛伐他汀对照品。
PHS-3C型精密pH计 上海精密科学仪器有限公司;YM50型不锈钢立式蒸汽消毒器 上海三申医疗器械有限公司;YM50型不锈钢立式高压蒸汽灭菌箱 上海三申医疗器械有限公司;DNP-9082型电热恒温培养箱上海精密实验设备有限公司;SW-CJ-2D型净化工作台广州瑞智科学仪器有限公司。
1.3 方法
1.3.1 菌株诱变的处理方法
在红曲菌的培养过程中,Monacolin K是次级代谢产物,代谢机制复杂,其产量是由多基因决定的,诱变后产量提高是多基因效应的结果[7]。本实验采用LiCl作为化学因子和UV作为物理因子对红曲菌MP进行复合诱变处理。
具体操作步骤:量取6mL孢子悬液于无菌平皿中,在距离紫外灯30cm处打开皿盖开始照射。将照射后的菌悬液转入无菌试管中,并立即浸入冰水中暗室保存3h。按10倍稀释法将经UV处理过的孢子悬液依次稀释,并各吸取0.1mL涂布在含有0.8g/L LiCl溶液的平板上,放入暗室中34℃培养6d,以备分离筛选[7]。
1.3.2 诱变筛选
在对菌种进行诱变时,只有每次诱变后有1~2个控制产量的基因突变,使产量合成稍有增加且又能维持其最起码代谢平衡的菌株才能生存下来,因此,高产菌株的产量提高,是通过多代诱发突变逐渐积累的结果[8]。
采用传统选育中常用的方法,挑选的菌落直接接入固体培养基中培养。
第一代:红曲菌MP→制备孢子悬液→UV照射→分离到含有LiCl的MEA平板上→挑选200个菌落→初筛50株→复筛4株[8]。第二代:出发菌株4株→制备孢子悬液→UV照射→分离到含有LiCl的MEA平板上→挑选200个菌落→初筛50株→复筛4株。第三、四代与以上操作方法相同。
初筛:选择生长速度减缓和形态发生明显变异的菌落。
复筛:对初筛出的50株红曲菌进行固态发酵培养14d,采用HPLC法对发酵产物中的Monacolin K进行定量检测,筛选出产量高的菌株[9-10]。
1.3.3 HPLC法定量检测
样品处理:将发酵后的红曲米于60℃烘干至质量恒定,研磨过100目筛。取适量样品溶于5mL流动相中,并超声助溶30min,40℃水浴1h,5000r/min离心15min,取上清液过0.45μm滤膜待用。
色谱柱:Welchrom-C18(4.6mm×250mm,5μm);检测波长:238nm;流动相:乙腈-磷酸水溶液;流速:1mL/min;进样量:20μL。
1.3.4 响应面试验分析法
在红曲菌固态发酵萌芽米过程中采用变温培养,以前期培养温度、后期培养温度以及初始含水量为3个主要影响因素,进行单因素试验,基于单因素试验结果确定响应面试验因素水平。具体设计见表1。

表1 响应面试验因素水平及编码设计表Table 1 Factors and levels in Box-Behnken design
2 结果与分析
2.1 复合诱变
2.1.1 紫外线复合0.8g/L LiCl诱变对菌株的影响
选择紫外线照射时间分别为15、30、45、60、75、90、105、120s,将孢子悬液涂布在含LiCl质量浓度为0.8g/L的MEA平板上,观察红曲菌的生长情况。
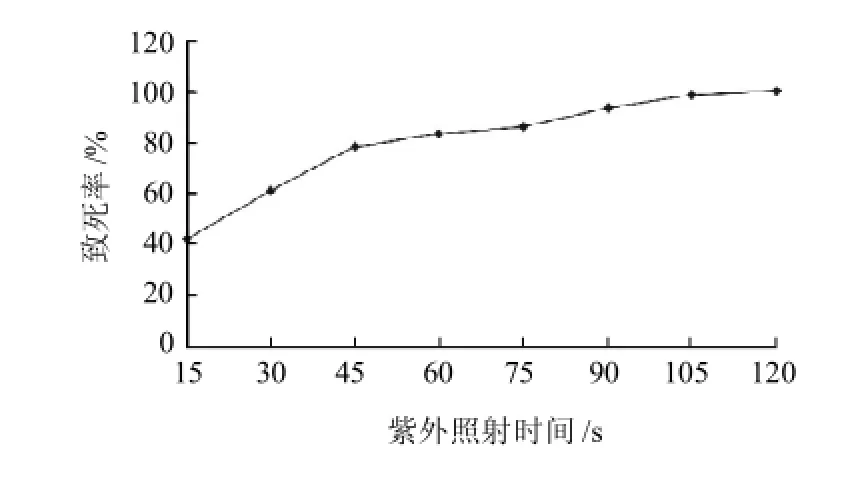
图1 紫外线照射时间对红曲孢子的致死作用Fig.1 Lethal effect of UV light on Monascus purpureu
由图1可知,孢子的致死率随着紫外照射时间的延长而增大,当照射时间为120s时,孢子的致死率近100%。而照射时间90s时致死率为90%左右,将此时间作为复合诱变处理的紫外照射时间。
2.1.2 复合诱变筛选出菌种的发酵产量
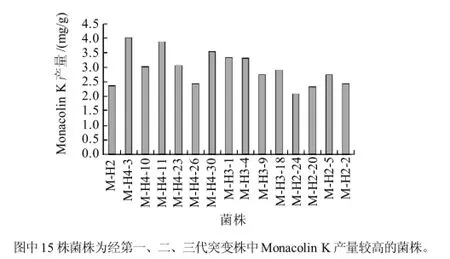
图2 突变菌株和出发菌株M-H2的比较Fig.2 Comparative monacolin K yield of original strain M-H2 and its mutant strains
对红曲菌MP进行上述复合诱变,诱变条件为紫外照射时间90s,LiCl质量浓度为0.8g/L。MP经诱变后得到80多株突变株,挑取菌落形态发生明显变异的30株进行固态发酵培养14d,采用HPLC法对发酵产物中的Monacolin K进行定量检测。按1.3.2节的筛选步骤和方法,连续诱变4代后得到以下突变株,结果如图2所示。15株菌株为第一、二、三代突变株中Monacolin K产量较高菌株,而第四代诱变时,相同条件下致死率下降,产Monacolin K能力无明显变化。经过初筛和复筛,并与诱变前进行比较得到目的菌株M-H4-3,其Monacolin K的产量为4.02mg/g,而相同发酵条件下出发菌株M-H2的Monacolin K的产量仅为2.35mg/g。
2.1.3 遗传稳定性实验
对目的菌株M-H4-3进行遗传稳定性实验,将其接种在麦芽汁培养基上连续传代至第五代,每代均接种到萌芽米上进行固态发酵培养。利用HPLC法对发酵样品进行检测,结果见图3。菌株M-H4-3在固态发酵萌芽米过程中对Monacolin K有较高的产量,且性能稳定。
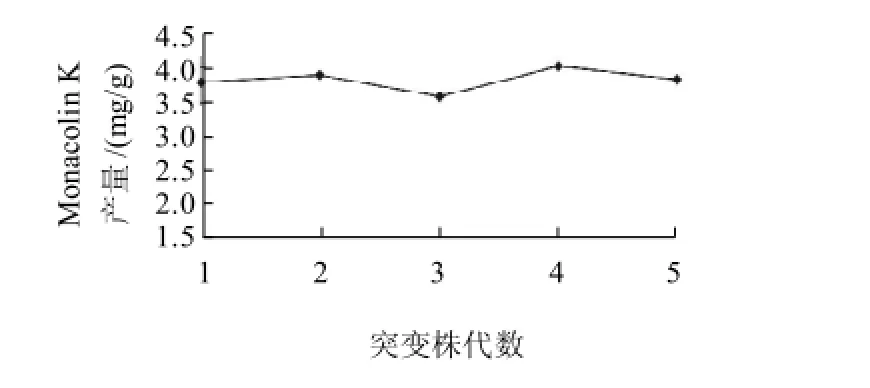
图3 突变株M-H4-3遗传稳定性实验结果Fig.3 Genetic stability of mutant strain M-H4-3
2.2 前期温度对Monacolin K产量的影响
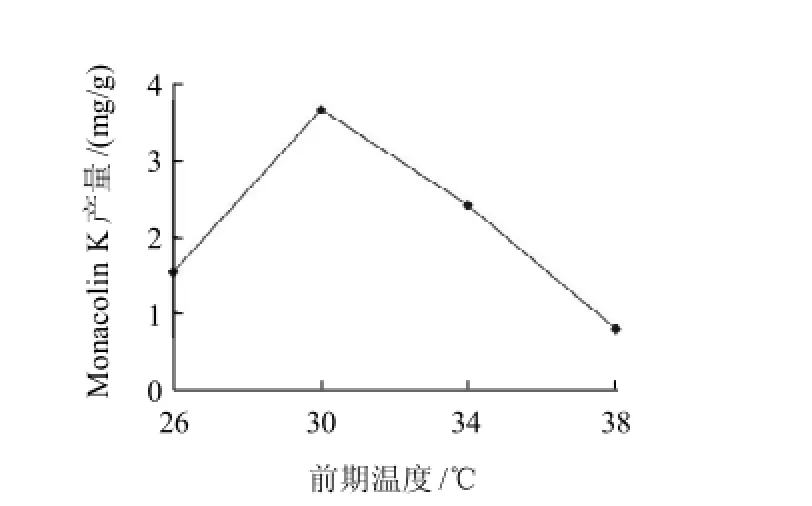
图4 前期温度对Monacolin K产量的影响Fig.4 Effect of initial temperature on monacolin K yield
Monacolin K是红曲发酵过程中产生的次级代谢产物,而次级代谢的一个重要特征是其代谢产物一般只在菌丝体的生长速率降低时才合成[11],因此Monacolin K的形成应滞后于菌丝体的生长,而红曲菌丝体的良好生长是高产Monacolin K的重要基础[12]。采用变温培养,在其他条件不变的情况下,首先固定后期温度为25℃,研究前期发酵温度对Monacolin K产量的影响,结果见图4。30℃时Monacolin K产量最高,之后Monacolin K产量随着温度的升高而增大,当温度升至38℃时几乎没有产量,说明此温度红曲菌菌丝体几乎不生长。
2.3 后期温度对Monacolin K产量的影响
在红曲米发酵过程中后期温度直接影响Monacolin K在菌丝体生长中的代谢积累[13],因此,固定前期温度30℃,后期温度分别设为20、24、28、32℃培养红曲米,研究后期温度对Monacolin K产量的影响,结果见图5。
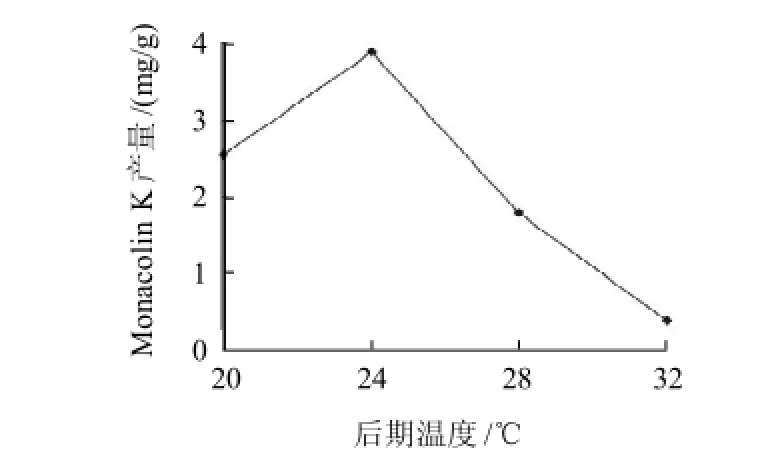
图5 后期温度对Monacolin K产量的影响Fig.5 Effect of late temperature on monacolin K yield
由图5可知,后期温度为24℃时Monacolin K的产量达到最大,而当温度高于24℃时Monacolin K的产量骤降,当后期温度高于前期温度时红曲生长缓慢几乎不代谢Monacolin K。
2.4 初始含水量对Monacolin K产量的影响
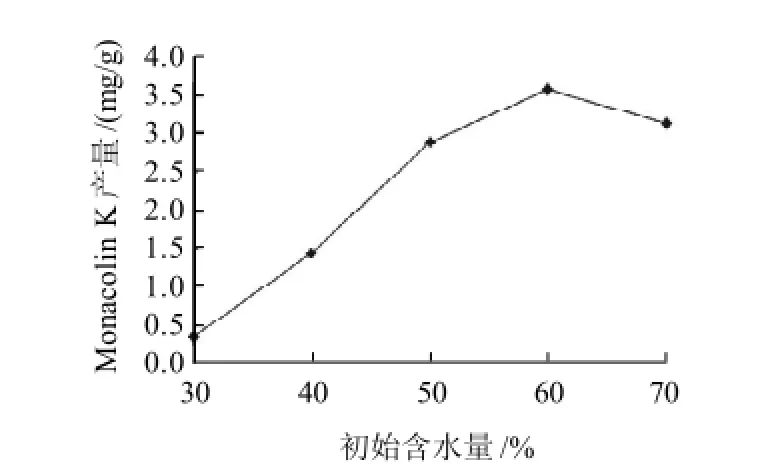
图6 初始含水量对Monacolin K产量的影响Fig.6 Effect of original moisture content on monacolin K yield
在固态发酵时,孢子萌发及菌丝生长都需要适宜的水分,而固态发酵最大的特点就是无游离水[14],因此底物含水量的变化对微生物的生长及代谢能力会产生重要的影响[15]。在其他条件不变的情况下进行发酵实验,研究初始含水量对Monacolin K产量的影响,结果见图6。在初始含水量60%时Monacolin K累积量达到最大值,通过观察各水平红曲米的发酵生长情况得知潮湿的环境比较适合红曲菌的生长。
2.5 固态发酵条件的响应面分析结果
以Monacolin K的产量为响应值(Y),通过Box-Behnken设计并进行试验,得到红曲菌固态发酵萌芽米的最优组合条件。结果见表2。方差分析见表3。根据回归方程,采用软件绘制响应面和等值线图,考察响应曲面情况,见图7。
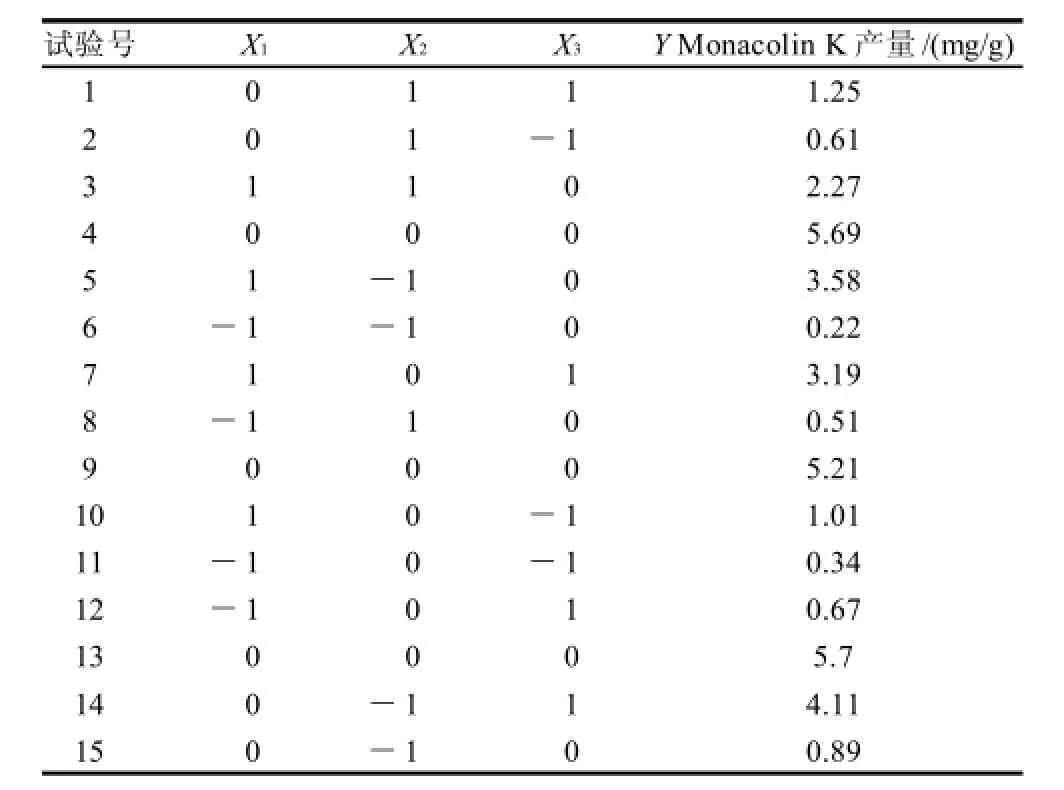
表2 响应面试验设计方案与结果Table 2 Box-Behnken experimental design and results for response surface analysis
对表2中的数据进行二次多项回归拟合,获得回归方程:
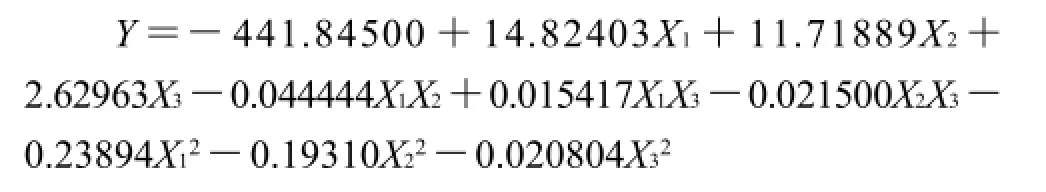
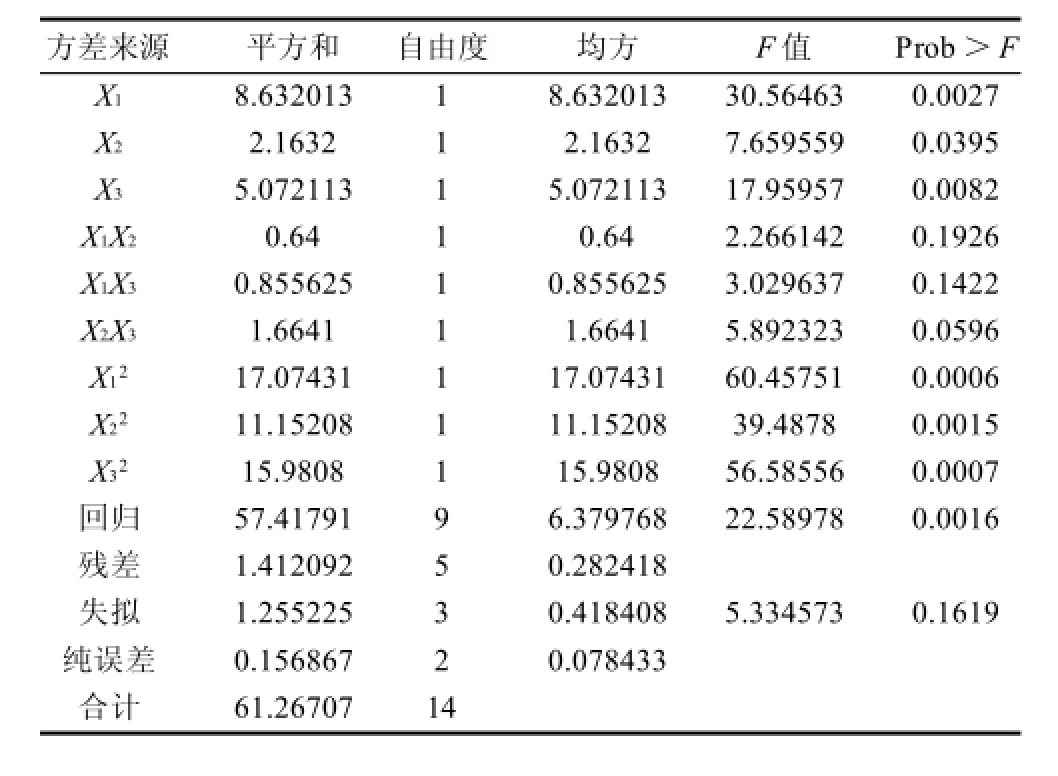
表3 方差分析Table 3 Variance analysis for the fitted regression equations
对回归方程求一阶偏导数并等于零,得到有3个方程组成的方程组,解答该方程组得到:X1=30.53,X2=25.68,X3=60.07。即应用数学模型得出的理论最优培养条件:前期温度为30.53℃,后期温度为25.68℃,初始含水量为60.07%,Y的最大值为5.92mg/g。而第4组试验的产量最高,即在前期温度为30℃、后期温度为24℃、初始含水量为60%的条件下,Monacolin K产量是5.69mg/g。因此可以看出理论最优点在此附近。
由表3可知,一次项以及二次项对响应值的影响均很显著,交互项则不显著。在此模型中失拟项不显著,回归高度显著,可以用此模型进行响应值的预测。模型的复相关系数的平方R2=0.9981,说明回归方程的拟合程度良好,可以用该方程代替真实试验点进行分析。
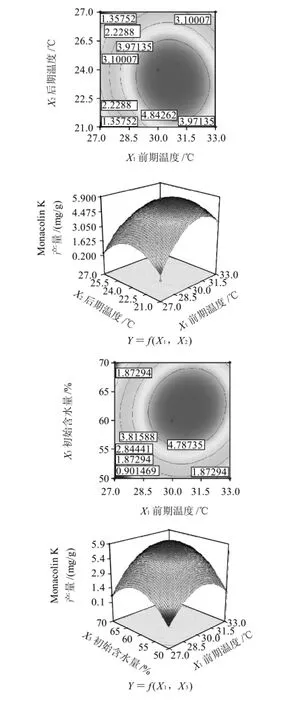
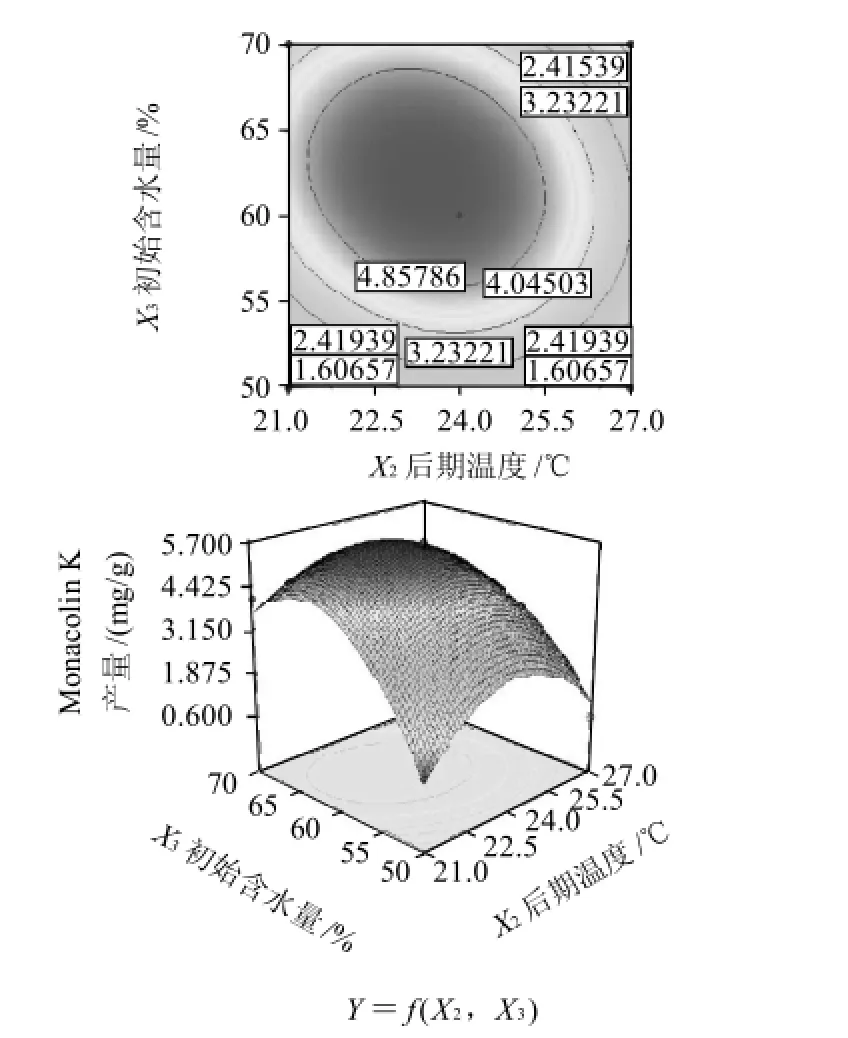
图7 前期温度、后期温度和初始含水量对Monacolin K产量影响的响应面及等值线图Fig.7 Response surface and contour plots for the effects of initial temperature, late temperature and original moisture content on monacolin K yield
2.6 拟合优化的验证
为检验响应面法所得结果的可靠性,通过重复性实验对统计分析计算出的理论最优条件进行验证,即在前期温度为30℃、后期温度为24℃、初始含水量为60%的条件下,用目的菌株M-H4-3固态发酵萌芽米,进行5次固态发酵所得的实验数据的平均值为5.33mg/g,与理论值的相对误差为0.91%。
3 结 论
3.1 以LiCl作为化学因子和UV作为物理因子对红曲菌MP进行复合诱变处理,通过反复诱变和筛选得到一株Monacolin K产量较高的菌株M-H4-3,其产量为4.02mg/g,与作为对照的出发菌株(2.35mg/g)相比,其产量提高1.7倍。
3.2 通过单因素及响应面试验对红曲菌固态发酵萌芽米条件进行优化,并通过Box-Behnken试验设计,建立红曲菌固态发酵萌芽米过程中Monacolin K代谢积累的回归模型,分析各因素效应的显著性以及两两因素间的交互作用。在前期温度为30℃、后期温度为24℃、初始含水量为60%的条件下,Monacolin K产量提高至5.33mg/g。
[1]熊晓辉, 张李阳, 韦策, 等. 红曲霉菌产Monacolin K固体发酵条件的优化[J]. 无锡轻工大学学报, 2004, 23(1): 8-10.
[2]崔有贵, 李永峰, 任南奇, 等. 甜菜废蜜生物制氢细菌的诱变育种[J].中国甜菜糖业, 2004, 1(3): 36-40.
[3]张素青. 糖蜜发酵选育高产蛋白酵母及发酵条件优化研究[J]. 内蒙古农业大学, 2009, 12(7): 76-80.
[4]丘振宇, 王雅琴, 许喜林, 等. 红曲霉的特点及应用研究[J]. 食品工业科技, 2006(12): 55-59.
[5]张良. 高产Monacolin K红曲菌的诱变选育及其固态发酵条件的优化[D]. 南昌: 南昌大学, 2010.
[6]王金字. 红曲菌固态发酵产红曲色素和Monacolin K条件研究[J]. 陕西科技大学, 2010, 20(3): 67-71.
[7]索江华, 黄现青, 郭爽, 等. 红曲霉及其主要产物[J]. 郑州牧业工程高等专科学校学报, 2006(1): 21-23.
[8]孙嘉龙, 邹晓, 刘爱英, 等. 高产Monacolin K红曲菌株的复合诱变选育[J]. 菌物学报, 2007, 26(4): 507-516.
[9]王立新, 莫海涛, 石红. 红曲霉固态发酵生产洛伐他汀的研究[J]. 中国抗生素杂志, 1999, 24(2): 96-98.
[10]SAYYAD S A, PANDA B P, JAVED S, et al. Optimization of nutrient parameters for lovastatin production by Monascus purpureus MTCC 369 under submerged fermentation using response surface methodology [J]. Microbiol Biotechnol, 2007, 73(21): 1054-1058.
[11]WANG J, LEE C L, PAN T M. Improvement of Monacolin K, γaminobutyric acid and citrinin production ratio as a function of environmental conditions of Monascus purpureus NTU 601[J]. Microbiol Biotechnol, 2003, 30(12): 669-676.
[12]谌斌. 紫红曲的原生质体紫外线诱变育种[J]. 广西科学院学报, 1999, 15(2): 86-89.
[13]BLANC P J, LAUSZAC J P, le BARS J, et a1. Characterization of monascidin A from Monascus as citrinin[J]. Int J Food Micmbiol, 1995, 27(2/3): 201-213.
[14]CHULEE C H. Mycelial reactions and mycelial compatibility group of red rice mould (Monascus purpureus)[J]. The British Mycological Society, 2002, 106(3): 298-304.
[15]MAARSE H. Volatile compounds in foods and beverages[M]. New York: Mareel Dekker, 1991: 168-173.
Combined Mutation of Monascus and Optimization of Fermentation Conditions for Monacolin K Production
YANG Huan-huan,HU Zhong-ze*
(College of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
A strain of Monascus purpureu was treated with UV irradiation and its spore was then incubated in media containing LiCl to induce mutation. A mutant strain with high yield of monacolin K was obtained and its fermentation conditions were optimized for monacolin K production. The results showed that the optimal fermentation conditions were initial temperature of 30 ℃, late temperature of 24 ℃ and original moisture content of germinated brown rice of 60%. Under these conditions, the yield of monacolin K reached 5.33 mg/g.
Monascus;combined mutation;monacolin K;response surface methodology
Q939.99
A
1002-6630(2012)11-0247-05
2011-05-18
湖北省自然科学基金重点项目(2009CDA099)
杨欢欢(1986—),女,硕士研究生,研究方向为食品微生物。E-mail:yanghuanhuan022@126.com
*通信作者:胡中泽(1968—),男,教授,硕士,研究方向为粮油工程。E-mail:hzz1968@126.com

