超高压处理对紫甘薯中多酚氧化酶活力的影响
刘军伟,胡志和
超高压处理对紫甘薯中多酚氧化酶活力的影响
刘军伟,胡志和*
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
以济薯18号为原料,研究超高压结合温度处理对紫薯多酚氧化酶(PPO)活力的影响。实验压力范围100~600MPa,温度20~60℃。结果表明:在温度30℃、保压时间10min的条件下,压力在100~600MPa范围内,500MPa时紫薯多酚氧化酶的活力最高,并且高于自然酶活力;在600MPa压力下,当温度小于30℃时,酶活力随温度上升而升高,大于30℃时,随温度升高酶活力下降。另外,酶活力随保压时间的延长而减小;但在300MPa时,前20min酶活力随保压时间延长而降低,20~50min内随时间延长而升高。因此,紫薯多酚氧化酶具有较好的耐压性。对紫薯进行温度、压力、保压时间的L9(34)正交试验结果表明:在600MPa、65℃条件下处理35min后,PPO活性最弱,抑制效果最佳。
超高压;紫甘薯;多酚氧化酶
紫薯是我国近年引进开发的一种用于工业加工的甘薯新品种,是一类具有紫色肉质的高花青素甘薯品种,所含花青素具有抗氧化活性、降血压和抗糖尿病等多种生理功能,以及膳食纤维等其他重要营养成分[1],引起了许多学者的关注。紫薯花色苷的重要生理活性表现在抗氧化[2-5]、抗肿瘤[6-9]、抗高血糖[10-11]、抗高血压[12]以及保肝作用[13-17]。
多酚氧化酶(polyphenol oxidase,PPO)是植物体内普遍存在的一种末端氧化还原酶[18],是引起果蔬酶促褐变的主要酶类,PPO催化果蔬原料中的内源性多酚物质氧化生成黑色素,严重影响制品的营养、风味及外观品质。在紫薯深加工过程中,由于其组织中的多酚氧化酶与酚类物质接触,催化多酚类物质氧化成邻醌,再进一步氧化聚合成黑色素[19]。因此,影响了精深加工和产业化,降低了产品的加工品质。
超高压加工技术(ultra-high pressure,UHP)属于一种冷加工技术,在超高压条件下,生物体高分子立体结构中的氢键结合、疏水结合、离子结合等非共有结合发生变化,使蛋白质变性、淀粉糊化、酶失活、细胞膜破裂、菌体内成分泄漏,使微生物因菌体破坏而死亡。蛋白质的氨基酸的缩氨结合、维生素、香气成分等低分子化合物是共有结合,在超高压下不会破坏而得以完整地保留。目前,国内的食品超高压处理技术还处于研究阶段,但超高压食品符合新型食品的简便、安全、天然、营养的消费需求,具有潜在的市场发展前景。
为了在生产紫薯色素、分离淀粉过程中防止紫薯中多酚类物质的褐变,本实验对紫薯PPO的酶学性质以及褐变抑制进行初步的研究,为紫薯加工过程中抑制褐变的产生提供理论依据。
1 材料与方法
1.1 材料与试剂
紫薯为山东济薯18号。
邻苯二酚、磷酸二氢钠、磷酸氢二钠等试剂均为分析纯。
1.2 仪器与设备
超高压设备 天津市华泰森淼生物工程技术有限公司;Sigma 3-18K离心机 美国Sigma公司;UVWIN5紫外-可见分光光度计 北京普析通用仪器有限责任公司;JJ-2组织捣碎匀浆机 常州国华电器有限公司。
1.3 方法
1.3.1 样品前处理
新鲜紫薯→清洗→称质量→包装→超高压处理
1.3.2 紫薯PPO酶液的提取和活力测定
1.3.2.1 紫薯PPO酶液的提取
参照袁根良等[20]方法,有所改进。称取超高压处理后的紫薯小块50g,加入200mL预冷的(4℃)磷酸缓冲液(1.76g Na2HPO4·12H2O和5.5g NaH2PO4·2H2O加水溶解,定容至200mL,pH6.0)于高速组织捣碎机中打浆,浆液在4℃、8000r/min离心15min,取上清液。
1.3.2.2 紫薯PPO反应产物吸收光谱分析
依次向试管中加入pH6.0的磷酸缓冲液10mL、0.2mol/L的邻苯二酚1.0mL,再加入酶液0.5mL迅速摇匀,30℃反应10min后,反应产物在200~500nm范围内每隔10nm进行扫描。
1.3.2.3 紫薯PPO酶促反应最佳反应时间确定
紫薯PPO与底物反应后,在不同时间段检测波长300nm的吸光度变化。
1.3.2.4 紫薯PPO残余酶活力的测定
PPO活性测定采用消光值法,并有所改进:依次向试管中加入pH6.0的磷酸缓冲液10mL、0.2mol/L的邻苯二酚1.0mL,再加入0.5mL酶液迅速摇匀,30℃反应10min后立即在300nm波长处测定其吸光度(A300nm),以每分钟吸光度增加0.001为一个酶活力单位。以未经超高压处理的紫薯为空白对照。PPO的残余酶活力按照下式计算:

1.3.3 试验设计
1.3.3.1 单因素试验
将紫薯块切成3mm×3mm×3mm后,以磷酸盐缓冲液(pH6.0)为介质装袋,后经超高压处理,分别考察压力、温度、保压时间对PPO活性的影响。
压力的影响:在30℃处理紫薯10min,考察不同压力(100、200、300、400、500、600MPa)对PPO活力的影响。温度的影响:在600MPa处理紫薯10min,考察不同温度(20、30、40、50、60℃)对PPO活力的影响。保压时间的影响:在30℃的条件下分别在300、500、600MPa压力下处理10、20、30、40、50min,考察其对PPO活力的影响。
1.3.3.2 正交试验
将紫薯块装袋密封,选用超高压压力、处理温度和保压时间作为试验因素,进行L9(34)正交试验,筛选抑制紫薯中PPO活性的压力、温度和保压时间的最佳组合。
1.4 数据分析
每测定重复两次,分别平行取样,结果以平均值计算。全部实验数据用Microsoft Excel 2003数据处理系统进行处理。
2 结果与分析
2.1 紫薯PPO反应产物吸收光谱分析
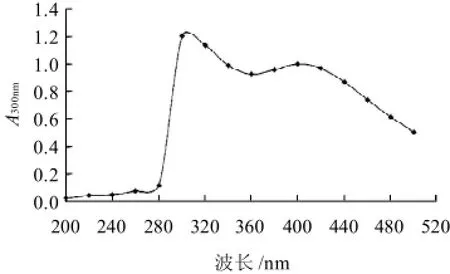
图1 紫薯PPO酶促反应产物的紫外吸收光谱Fig.1 Ultraviolet absorption spectrum of products of the enzymatic reaction catalyzed by PPO from purple sweet potato
紫薯PPO与邻苯二酚的反应产物醌于200~500nm波长下每隔20nm扫描光密度,形成吸收光谱图(图1)。图1显示,醌在300nm波长处有最大吸收峰。因此,后续实验均在300nm波长处测定吸光度。
2.2 紫薯PPO酶促反应最佳反应时间确定
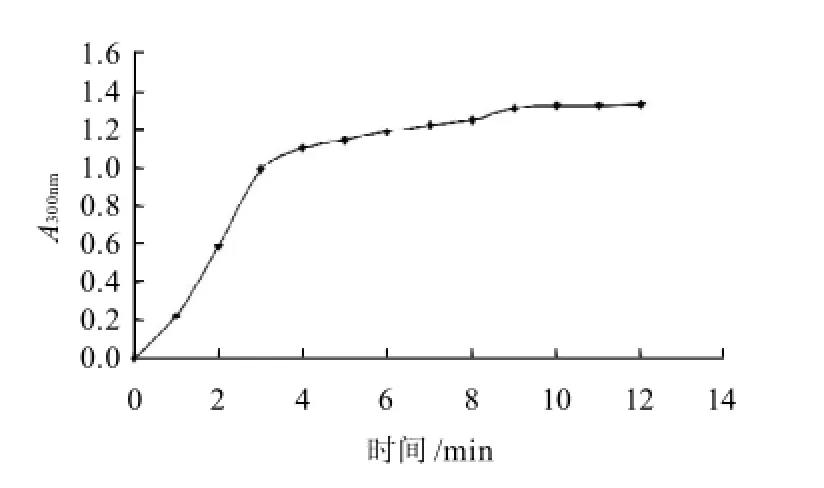
图2 紫薯PPO酶促反应随时间的变化Fig.2 Selection of optimal enzymatic reaction time for PPO activity determination
取制备的PPO粗酶液反应体系,每隔1min检测波长300nm的吸光度变化,直至前后连续3次检测的示值差小于1%时,则认定其酶促反应趋于稳定。由图2可知,PPO酶促反应速度在0~3min内呈现很好的线性关系,其后反应速度变慢,10min后反应趋于稳定,所以均以反应时间10min时的吸光度来表示PPO的酶活力。
2.3 单因素试验
2.3.1 压力对PPO活性的影响

图3 压力对紫薯PPO残余酶活力的影响Fig.3 Effect of pressure on residual PPO activity in purple sweet potato after combined UHP and heat treatment
由图3可知,100~400MPa处理后,PPO残余酶活力均有所下降,但随着压力的升高残余酶活力逐渐升高;并且在500MPa处理下,与未处理的对照样酶活力相比PPO残余酶活为1.066;600MPa时残余酶活为0.875。总体来说,压力可以在一定程度上降低酶的活性。但材料不同,结果有一定的差异性。曾庆梅等[21]研究了超高压处理对对砀山梨汁中多酚氧化酶活性的影响,发现200~300MPa处理梨汁时多酚氧化酶被激活,活性表现最高,超过300MPa后活性逐渐降低。但在本实验条件下,600MPa处理下还不足以使紫薯中的PPO完全失活,这表明紫薯中的PPO是一种强耐压性的酶。
2.3.2 温度对PPO活性的影响
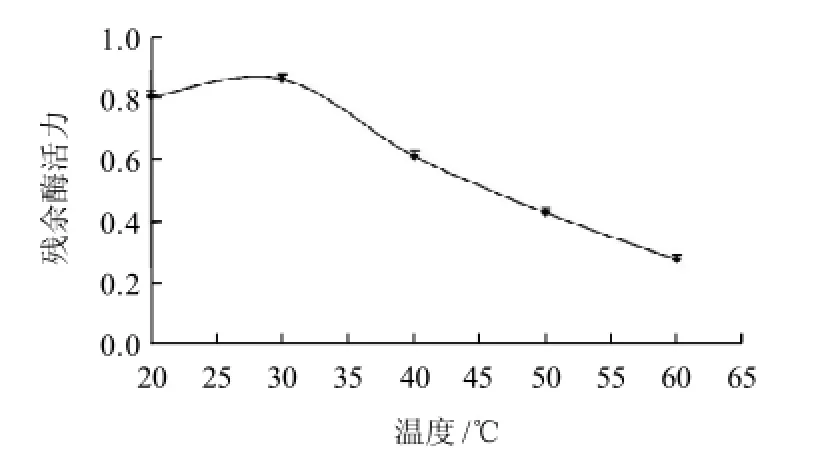
图4 温度对紫薯PPO残余酶活力的影响Fig.4 Effect of temperature on residual PPO activity in purple sweet potato after combined UHP and heat treatment
由图4可知,在600MPa压力条件下处理10min,紫薯PPO残余酶活力随着处理温度的升高先升高后降低,在30℃时达到最大,之后迅速下降;60℃时降到0.278。因此用温度与压力协同作用对PPO灭活时,需要选用40℃以上的温度才可以有显著的协同效果。这一结果与韩永斌等[22]研究超高压对山药泥中多酚氧化酶活力的影响,得到相似结果。
2.3.3 保压时间对PPO活性的影响
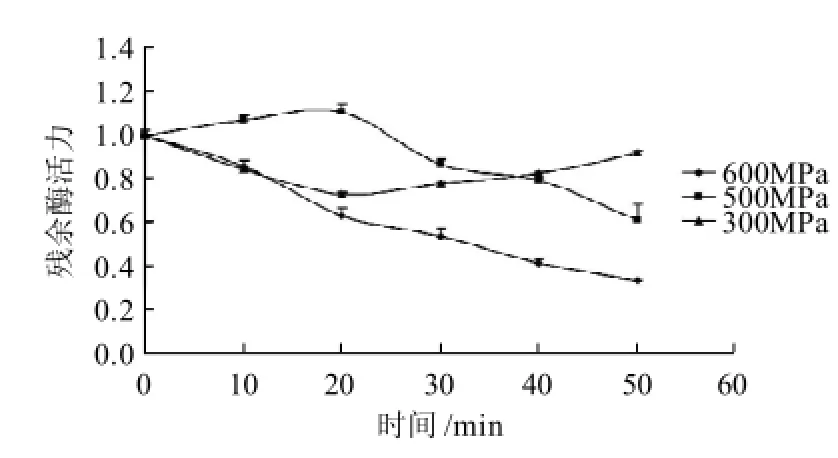
图5 保压时间对紫薯PPO残余酶活力的影响Fig.5 Effect of pressure holding time on residual PPO activity in purple sweet potato after combined UHP and heat treatment
随保压时间的延长,大多数酶的活力逐渐下降,但超过一定时间后影响不显著[23]。由图5可知,在压力600MPa处理下,保压时间越长残余酶活力越低,表明较高压力处理后,可以使酶产生不可逆的失活;500MPa时,随保压时间先升高后降低,20min时最高,可能是处于附着状态的酶被完全释放出来,但压力不足以将其灭活,综合提高了酶的活性;300MPa处理后,残余酶活随时间延长先降低后升高,因为低压下酶的失活通常是可逆的。因此要在短时间内尽可能的降低酶活力,必须采用高压处理。
2.4 正交试验
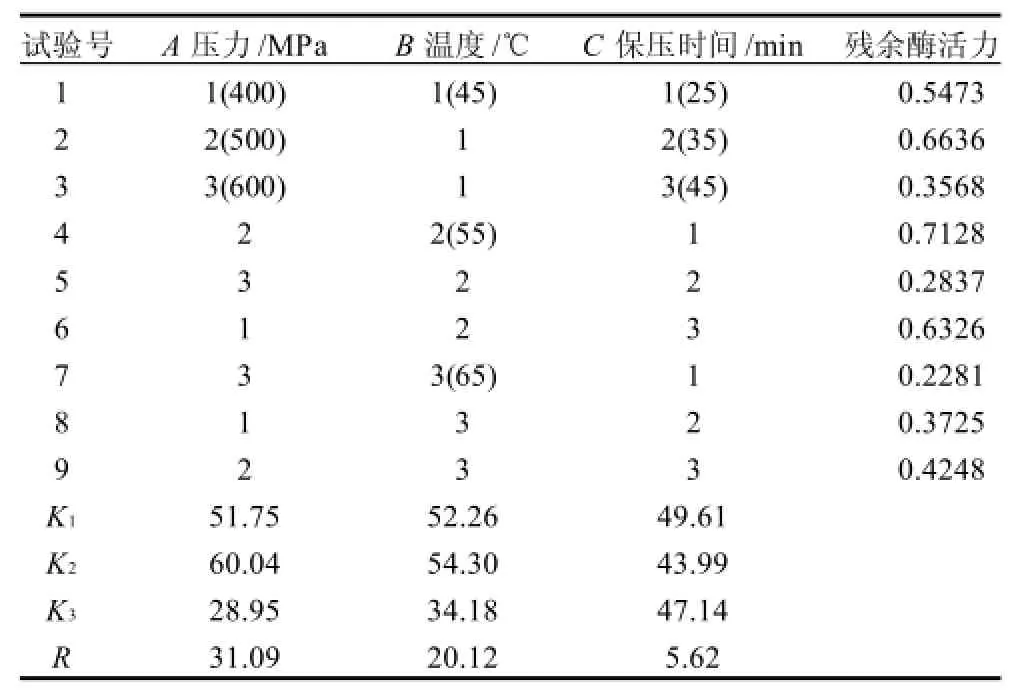
表1 L9(34)正交试验结果Table 1 L9(34) orthogonal array design and corresponding experimental results
由表1可知,第7组组合A3B3C1处理对PPO抑制效果最好。因此,表观确定超高压最佳处理条件为600MPa、65℃、25min。由极差分析结果可知:极差越大抑制酶活力越好,对抑制酶活力的影响因子的作用大小顺序为A>B>C。由正交表极差分析得出最佳组合为A3B3C2,即压力600MPa、温度65℃、保压时间35min,但加热会使原料的质地、颜色和风味改变以及热敏性物质遭破坏。因此一定的温度配合一定的高压来处理原料可使各方面都有所兼顾,当温度升至55℃时,随着压力的增大PPO活性明显减小,综合比较,A3B2C2(600MPa、55℃、35min)也许在实验效果理论上优于A3B3C2,待进一步实验证明。
3 结 论
3.1 紫薯PPO酶促反应的最大吸收波长在300nm处,酶促反应最佳时间为10min。
3.2 在30℃、10min条件下,100~400MPa处理后,PPO残余酶活力均有所下降,但随着压力的升高残余酶活力逐渐升高;500MPa时PPO被激活,活性达到最大;600MPa处理后残余酶活力为0.875,效果不显著。
3.3600 MPa处理10min,随着温度的升高,紫薯PPO活性先升高后降低,在30℃时达到最高。因此,用温度与压力协同作用进行PPO灭活时,需要选用40℃以上的温度才可以有显著的协同效果。
3.4 在压力600MPa处理下,保压时间越长残余酶活力越低;500MPa时,随保压时间先升高后降低,20min时最高;300MPa处理后,残余酶活力随时间延长先降低后升高。
3.5 利用正交试验优化超高压处理对紫薯PPO酶活力残存率得到工艺条件为压力600MPa、温度65℃和保压时间35min。
[1]陆国权. 甘薯品质性状的基因型与环境效应研究[M]. 北京: 气象出版社, 2003: 8.
[2]卢立真, 张雨青, 马永雷, 等. 紫甘薯花青素苷对老龄小鼠的抗氧化作用[J]. 安徽农业科学, 2010, 38(13): 6916-6917; 6920.
[3]須田郁夫. 健康機能性を活用した甘しょと大豆の高付加価値化[J].九州農業研究, 2001(63): 29-34.
[4]SUDA I, OKI T, MASUDA M, et al. Physiological functionality of purple-fleshed sweet potatoes containing anthocyanins and their utilization in foods[J]. Japan Agricultural Research Quarterly, 2003, 37(3): 167-173.
[5]区子弁, 王丽娟, 王琴, 等. 紫甘薯花色苷体外清除自由基的研究[J].粮油加工, 2010(1): 110-112.
[6]唐传核, 彭志英. 类黄酮的最新研究进展(Ⅲ): 吸收、代谢及排泄[J]. 中国食品添加剂, 2002(2): 14-21.
[7]CARLO G D, MASCOLO N, IZZO A A, et al. Flavonoids: old and new aspects of a class of natural therapeutic drugs[J]. Life Science, 1999, 65 (4): 337-353.
[8]王关林, 岳静, 苏冬霞, 等. 甘薯花青苷色素的抗氧化活性及抑肿瘤作用研究[J]. 营养学报, 2006, 28(1): 71-74.
[9]曹东旭, 董海叶, 李妍, 等. 紫甘薯花色苷对人肝癌细胞HepG2的作用[J]. 天津科技大学学报, 2011, 26(2): 9-12.
[10]MATSUI T, EBUCHI S, KOBAYASHI M, et al. Anti-hyperglycemic effect of diacylated anthocyanin derived from Ipomoea batatas cultivar Ayamurasaki can be achieved through the α-glucosidase inhibitory action[J]. Journal of Agricultural and Food Chemistry, 2002, 50(25): 7244-7248.
[11]马淑青, 吕晓玲, 范辉. 紫甘薯花色苷对糖尿病大鼠血糖和血脂的影响[J]. 营养学报, 2010, 32(1): 88-90.
[12]胡志和, 张然嬉, 冯永强, 等. 提取紫甘薯淀粉的副产物对SHR血压的影响[J]. 食品科学, 2010, 31(21): 361-164.
[13]HWANG Y P, CHOI J H, YUN H J, et al. Anthocyanins from purple sweet potato attenuate dimethylnitrosamine-induced liver injury in rats by inducing Nrf 2-mediated antioxidant enzymes and reducing COX-2 and iNOS expression[J]. Food and Chemical Toxicology, 2011, 49(1): 93-99.
[14]CHOI J H, HWANG Y P, PARK B H, et al. Anthocyanins isolated from the purple-fleshed sweet potato attenuate the proliferation of hepatic stellate cells by blocking the PDGF receptor[J]. Environmental Toxicology and Pharmacology, 2011, 31(1): 212-219.
[15]ZHANG Zifeng, FAN Shaohua, ZHENG Yuanlin, et al. Purple sweet potato color attenuates oxidative stress and inflammatory response induced by D-galactose in mouse liver[J]. Food and Chemical Toxicology, 2009, 47(2): 496-501.
[16]HWANG Y P, CHOI J H, CHOI J M, et al. Protective mechanisms of anthocyanins from purple sweet potato against tert-butyl hydroperoxideinduced hepatotoxicity[J]. Food and Chemical Toxicology, 2011, 49 (9): 2081-2089.
[17]ZHANG Zifeng, LU Jun, ZHENG Yuanlin, et al. Purple sweet potato color protects mouse liver against D-galactose-induced apoptosis via inhibiting caspase-3 activation and enhancing PI3K/Akt pathway[J]. Food and Chemical Toxicology, 2010, 48(8/9): 2500-2507.
[18]李忠光, 龚明. 植物多酚氧化酶活性测定方法的改进[J]. 云南师范大学学报, 2005, 25(1): 44-45.
[19]姜绍通, 罗志刚, 潘丽军. 甘薯中多酚氧化酶活性的测定及褐变控制[J]. 食品科学, 2001, 22(3): 19-22.
[20]袁根良, 杨公明, 余铭, 等. 超高压处理对香蕉果肉多酚氧化酶和过氧化物酶活性抑制的研究[J]. 食品科学, 2010, 31(10): 64-68.
[21]曾庆梅, 潘见, 谢慧明, 等. 超高压处理对多酚氧化酶活性的影响[J].高压物理学报, 2004, 18(2): 144-148.
[22]韩永斌, 刘桂林, 冯莉, 等. 超高压和酶抑制剂对山药泥中多酚氧化酶活性的影响[J]. 食品科学, 2005, 26(5): 111-115.
[23]HENDRICKX M, LUDIKHUYZE L, van den BROECK I, et al. Effects of high pressure on enzymes related to food quality[J]. Trends in Food Science and Technology, 1998, 9(5): 197-203.
Effect of Ultra High Pressure Treatment on Polyphenol Oxidase Activity in Purple Sweet Potato
LIU Jun-wei,HU Zhi-he*
(Tianjin Key Laboratory of Food and Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
Purple sweet potato Jishu 18 was used to investigate the effect of combined ultra high pressure (UHP, 100—600 MPa) and heat (20—60 ℃) treatment on polyphenol oxidase (PPO) activity in purple sweet potato. The results showed that in the investigated range of pressure, UHP treatment at 500 MPa and 30 ℃ for 10 min resulted in maximum PPO activity in Jishu 18, exceeding the pre-treatment activity level. When the UHP pressure was 600 MPa, PPO activity in Jishu 18 indicated an upward trend with increasing temperature up to 30 ℃, followed by a decline at higher temperature. Moreover, a decreasing trend was found with prolonged pressure holding time. PPO activity decreased gradually during the first 20 min of UHP treatment at 300 MPa, but increased during the subsequent 30 min. Consequently, PPO activity is tolerant to high pressure. The results of orthogonal array design experiments revealed that treatment at 600 MPa and 65 ℃ for 35 min had the best inhibitory effect on PPO activity in purple sweet potato.
ultra-high pressure;purple sweet potato;polyphenol oxidase
TS205.9
A
1002-6630(2012)15-0262-04
2011-10-23
刘军伟(1986—),男,硕士研究生,研究方向为食品生物技术。E-mail:liujunweidalao@126.com
*通信作者:胡志和(1962—),男,教授,硕士,研究方向为专用功能食品。E-mail:hzhihe@tjcu.edu.cn

