黑曲霉降酸菌株F1降解酒石酸关键酶的分离纯化
王贵珍,董 昕,文连奎
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
黑曲霉降酸菌株F1降解酒石酸关键酶的分离纯化
王贵珍,董 昕,文连奎*
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
为得到黑曲霉菌株F1中具有降酸作用的蛋白,将黑曲霉菌株F1经酒石酸诱导发酵得到菌丝体,用液氮研磨破碎细胞壁,超声波辅助提取得到粗酶液,硫酸鱼精蛋白去除核酸,热变除杂蛋白,聚乙二醇浓缩,透析脱盐,DEAE-纤维素52阴离子交换层析,Sephadex G-75葡聚糖凝胶柱分子筛层析,最终得到该蛋白的单一组分,其纯化倍数为14.32,并确定该酶为脱氢酶类。
黑曲霉;酒石酸降解酶;分离纯化
酒石酸(tartaric acid),又名葡萄酸、二羟基琥珀酸,化学性质较稳定,广泛存在于高等植物中,葡萄和罗望子(酸角)中含量较高。山葡萄中酒石酸含量占总有机酸的60%以上,对山葡萄酒的口感和品质具有较大影响[1-3]。在某些食品工厂废液中也含有酒石酸,降解酒石酸对生产优质山葡萄酒、净化含酒石酸的废水有着非常重要的意义。
目前,降酸的方法主要有物理、化学和生物法[4-6]。而生物法降酸则主要集中在苹果酸的降解方面[7-10],生物降解酒石酸的报道很少。国外研究者发现了一种能降解酒石酸的假单胞菌微生物,并且对该过程中涉及到的一系列酶进行了分离纯化[11-12]。
笔者所在实验室从富含酒石酸的环境中筛选到一株能降解酒石酸的黑曲霉菌株F1,酒石酸降解率高达97%。本实验进一步对其降解酒石酸的关键酶进行分离纯化,以探究其降酸的机理。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 菌株
黑曲霉(Aspergillius niger)F1由吉林农业大学食品科学与工程学院农产品加工及贮藏工程实验室筛选,中国微生物菌种保藏管理委员会普通微生物中心保藏(CGMCC5025)。
1.1.2 培养基
黑曲霉活化培养基(察氏培养基):蔗糖30g、NaNO32g、K2HPO4·7H2O 1g、氯化钾0.5g、MgSO4·7H2O0.5g、FeSO4·7H2O 0.01g、琼脂 15~20g、蒸馏水1000mL,pH值自然。
诱导产酶培养基:L(+)酒石酸5g、K2HPO4·7H2O 1g、氯化钾0.5g、MgSO4·7H2O 0.5g、FeSO4·7H2O 0.01g、蒸馏水1000mL,pH3.0。
1.1.3 试剂
硫酸鱼精蛋白(分析纯)、NAD+(分析纯) 上海索宝生物科技有限公司进口分装; SephadexG-75、DEAE-cellulose 52 上海楷洋生物技术有限公司;甲叉双丙烯酰胺(电泳纯)、考马斯亮蓝G-250、R-250(分析纯)、牛血清白蛋白(分析纯) 中国惠世生化试剂有限公司进口分装;四甲基乙二胺 国药集团化学试剂有限公司;丙烯酰胺、β-巯基乙醇 北京鼎国生物技术有限公司;其他试剂均为分析纯或化学纯。
1.1.4 仪器与设备
JY92-II型超声波细胞粉碎机 宁波新芝生物科技股份有限公司;GL-21LM型高速冷冻离心机 湖南星科科学仪器有限公司;SPX-250B-D型微电脑全温振荡培养箱上海博讯实业有限公司医疗设备厂;YC-2型层析实验冷柜、FD-1B-50型冷冻干燥机 北京博医康实验仪器有限公司;DW-F190-40℃超低温冰箱 中科美菱低温科技有限责任公司;HD-2000型核酸蛋白检测仪 上海嘉鹏科技有限公司;T6型紫外-可见分光光度计 北京普析通用仪器有限责任公司;DYY-11型电泳仪 北京市六一仪器厂。
1.2 方法
1.2.1 诱导产酶实验
1.2.1.1 菌种活化
将-40℃保藏的菌种解冻后转接到察氏斜面培养基中,32℃培养72h,进行活化培养。
1.2.1.2 菌悬液制备
将斜面培养基上生长的孢子轻轻刮下,悬浮到灭菌的生理盐水中,置于摇床中振荡打散。采用比浊法测定孢子数。
1.2.1.3 诱导产酶实验
在500mL三角瓶装入200mL液体产酶发酵培养基,121℃灭菌20min,接种黑曲霉孢子悬浮液,接种量1%,置于振荡培养箱中培养,160r/min、32℃培养4d。
1.2.2 酒石酸降解酶的提取
粗酶液制备→硫酸鱼精蛋白去除DNA→热变→聚乙二醇浓缩→透析除盐→DEAE纤维素52离子交换层析柱→SephadexG-75分子筛层析。其中每一步均测定酶活力和可溶性蛋白质含量。
1.2.2.1 菌丝体制备
将振荡培养4d的黑曲霉细胞经循环水式真空泵抽滤,用蒸馏水多次洗涤直至细胞表面无培养基残留,收集菌丝体,备用。
1.2.2.2 细胞提取物的制备
取上述菌丝体50g,放入已事先预冷的研钵中,倾入液氮快速充分研碎细胞,加入0.1mol/L pH7.0 Tris-HCl缓冲溶液200mL,该缓冲溶液中含0.4mmol/L MnCl2和5mmol/Lβ-巯基乙醇,将细胞混合物置于冰水浴中,160W超声40min(每隔30s超声一次,每次超声时间30s),在4℃、10000r/min条件下离心30min[13],弃去细胞碎片,得上清液,即为细胞提取物,记录上清液体积。
1.2.2.3 去除核酸
取上述细胞提取物置于冰水浴中,边搅拌边缓慢加入0.1倍体积的质量浓度为2g/100mL硫酸鱼精蛋白[14],在4℃、10000r/min离心30min,弃去沉淀,得上清液,记录体积。
1.2.2.4 热变去除杂蛋白
将得到的上清液在53℃恒温水浴锅中保温10min[15],保温过程中不断缓慢搅拌,取出后迅速置于冰水浴中,冷却一段时间,再4℃、10000r/min离心30min,弃去沉淀,得上清液,记录体积。
1.2.2.5 硫酸铵分级沉淀
将含有5mmol/L β-巯基乙醇的饱和中性硫酸铵溶液加入上述得到的上清液中,两者的体积比为1.4:1[16],在冰水浴中边搅拌边加入,4℃静置2h。4℃、10000r/min离心30min,弃去上清液,收集沉淀,将其再次溶解到少量体积0.05mol/L pH7.0的Tris-HCl缓冲溶液中,该缓冲溶液中含0.4mmol/L MnCl2和1mmol/L β-巯基乙醇。得到黑曲霉酒石酸降解酶的粗提液。
1.2.2.6 透析脱盐、浓缩
将得到的粗酶液装入事先处理好的透析袋中,置于500mL相同缓冲液中透析5h,每隔100min更换一次透析缓冲液;将经透析后的粗酶液于-20℃预冻10h后置于冷冻干燥机中冻干,得黑曲霉酒石酸降解酶浓缩液。于-20℃保存,备用。
1.2.2.7 DEAE-纤维素52离子交换层析
将处理好的DEAE-纤维素52装入离子交换层析柱中(1.5cm×28cm),用0.05mol/L、pH7.0的缓冲液过夜平衡,平衡缓冲液中含有0.4mmol/L MnCl2和5mmol/Lβ-巯基乙醇。将得到的粗酶浓缩液上样于平衡好的层析柱中,分别用0、0.1、0.2、0.3、0.4、0.5mol/L的KCl平衡缓冲液配制溶液进行梯度洗脱,流速30mL/h,5mL/管进行收集[17]。测定出峰部分各管在280nm波长处吸光度和酶活力情况,合并有酶活力部分洗脱液,真空冷冻干燥浓缩。
1.2.2.8 Sephadex G-75凝胶层析
将溶胀好的Sephadex G-75葡聚糖凝胶灌入层析柱中(1.6cm×60cm),用0.05mol/L、pH7.0的缓冲液过夜平衡,平衡缓冲液中含有0.4mmol/L MnCl2和5mmol/Lβ-巯基乙醇,用相同的缓冲溶液洗脱,流速12mL/h,5mL/管进行收集[18]。测定出峰部分各管在280nm处吸光度和酶活力情况,合并有酶活力部分洗脱液,真空冷冻干燥浓缩。
1.2.3 分析测定
1.2.3.1 蛋白质含量测定
采用考马斯亮蓝G-250法测定可溶性蛋白质含量[19]:配制一系列质量浓度分别为10、20、40、60、80、100μg/mL的标准牛血清白蛋白溶液,在595nm波长处测其吸光度。
以标准牛血清白蛋白溶液质量浓度为横坐标,不同质量浓度溶液对应的吸光度为纵坐标,绘制标准曲线,得出标准曲线方程为:A595nm=0.0038ρ+0.0064,相关系数R2=0.9982。式中:ρ为标准蛋白液质量浓度(μg/mL),质量浓度范围为0~100μg/mL。
1.2.3.2 酶活力测定
[20],所获得的降解酒石酸的蛋白酶为酒石酸脱氢酶类,该种酶类需要有NAD+作为辅酶来实现对酒石酸的催化降解作用,其反应机理如下:
L(+)酒石酸+NAD+草酸乙醇酸+NADH+H+
由上式可知,当有过量底物存在时,NAD+被还原的速度与酶活力成正比,酶活力越高,单位时间内产生的NADH就越多。NADH对340nm紫外线有较强吸收,NAD+则无此能力,因此可通过测定反应体系在340nm处吸光度的变化来反映NADH的生成量,从而表示酶活力的大小。25℃条件下,每分钟催化1μmol NAD+转化为NADH所消耗的酶量定义为一个酶活力单位,即IU。
酶活力反应体系包括:0.2mol/L Tris-HCl、pH8.6、1mmol/L β-巯基乙醇、0.4mmol/L MnCl2、10mmol/L L(+)酒石酸、2mmol/L NAD+。25℃条件下,向该酶活反应体系中加入适量酶,在340nm波长处每隔30s测定一次吸光度。并以蒸馏水代替底物,做空白实验。
为了证明所获得的目的蛋白是否为脱氢酶类:分别在该酶中不添加NAD+和添加NAD+,于340nm波长处每隔30s测定一次吸光度,检测两种情况下是否有酶活。
2 结果与分析
2.1 粗酶液的获得
菌丝体经破碎,超声辅助提取获得的粗酶液中含有一定量的蛋白,说明所要提取的目的蛋白存在于粗酶液中。
2.2 热变去除杂蛋白结果
热变之后,酶活力14.14IU,总蛋白、总酶活力都有所下降,酶比活力上升,热变除去了一部分小分子质量的蛋白质,目的蛋白也有一定损失,造成酶活降低。
2.3 DEAE-纤维素52离子交换层析
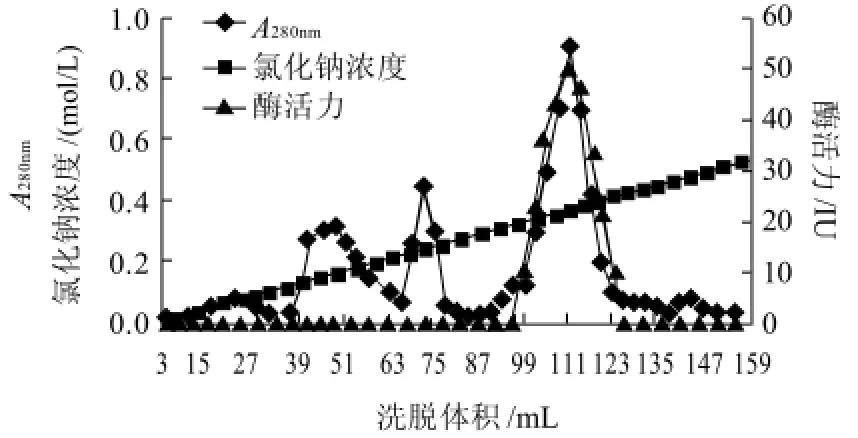
图1 DEAE-纤维素52离子交换层析结果Fig.1 Elution profile of crude enzyme on DEAE-52 column
由图1可知,经DEAE-纤维素52洗脱主要得到4个蛋白峰,1个主蛋白峰(99~123mL处)和3个小蛋白峰(35~63mL、63~75mL、135~147mL处),分别收集4种不同组分,逐管测定酶活力情况,发现酶活力峰与主蛋白峰基本重合,但是主蛋白峰前面有一较小杂蛋白峰,说明这两种蛋白离子强度相近,仍需进一步分离,收集主蛋白峰部分样液,真空冷冻干燥冻干,于-20℃保存,备用。
2.4 Sephadex G-75凝胶层析结果

图2 Sephadex G-75凝胶层析结果Fig.2 Elution profile of on partially purified enzyme on Sephadex G-75 column
由图2可知,样液经过Sephadex G-75凝胶柱后,主要获得2个蛋白峰(27~39 mL、54~90mL处),分别收集这2个蛋白峰样液,逐管测定酶活力,从54mL时开始出现酶活力,90mL时酶活力消失,酶活力峰与主蛋白峰重合。另外,2个蛋白峰有一定距离,由于Sephadex G-75凝胶是根据蛋白质的相对分子质量大小进行分离的,那么图中两种蛋白质相对分子质量大小有一定差异。所以此方法能够较好分离目的蛋白与杂蛋白。收集主蛋白峰部分样液,真空冷冻干燥,-20℃保存,备用。
2.5 不同方法所测酶活力结果

表1 添加NAD+和不添加NAD+的酶活力实验结果Table 1 Results obtained for determination of enzyme activity in the presence and absence of NAD+
从表1可以看出,不添加NAD+的一组实验中吸光度没有变化,表示没有酶活力,而添加了NAD+的一组实验中吸光度逐渐变大,说明生成了NADH,表示有酶活力。NAD+是脱氢酶的辅酶,催化脱氢酶脱去氢而本身被还原为NADH,表明获得的目的蛋白酶为脱氢酶。
2.6 酶的分离纯化结果
为得到可降解酒石酸的酶,进行了细胞破碎、热变、DEAE-纤维素52层析、Sephadex G-75凝胶层析等纯化步骤。收集各纯化步骤得到的上清液,分别测定其总蛋白含量、酶总活力、酶比活力,结果见表2。
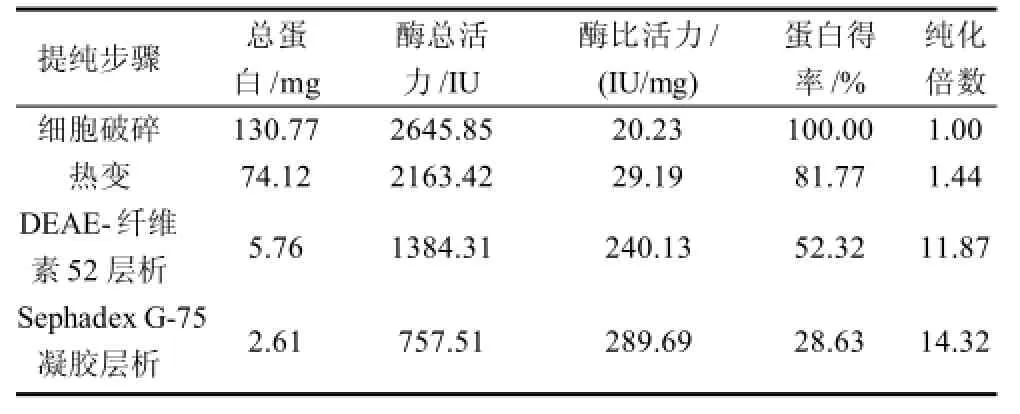
表2 黑曲霉中酒石酸降解酶的分离纯化Table 2 Purification of tartaric acid degrading enzymes from Aspergillus niger
由表2可知,黑曲霉菌细胞经细胞破碎、热变、离子交换层析、葡聚糖分子筛层析后,总蛋白含量变为2.61mg,表明细胞里的杂蛋白被除去,同时可降解酒石酸的酶也有损耗;酶总活力变为757.5IU表明可降解酒石酸的酶在提纯过程中有损失;酶比活力变为289.69IU/mg,表明经过一系列纯化步骤,获得了可降解酒石酸的酶,最终得率为28.63%,纯化倍数为14.32。
3 结 论
经过诱导产酶、液氮破碎、超声辅助提取、硫酸鱼精蛋白去除核酸、热变除杂蛋白、DEAE-纤维素52离子交换层析和Sephadex G-75凝胶层析等一系列分离纯化手段,最终获得了黑曲霉降酸菌株F1降解酒石酸目的蛋白酶的单一组分,冷冻干燥之后为白色粉末,最终纯化倍数为14.32,该酶在有NAD+存在的条件下才有降解酒石酸的作用,因此确定了该酶属于脱氢酶类。
参考文献:
[1]高年发, 李小刚, 杨枫. 葡萄及葡萄酒中的有机酸及降酸研究[J]. 中外葡萄与葡萄酒, 1999(4): 6.
[2]王华, 张春晖, 李华. 乳酸菌在葡萄酒酿造中的应用[J]. 西北农业大学学报, 1996, 24(6): 92-98.
[3]李华. 现代葡萄酒工艺学[M]. 西安: 陕西人民出版社, 1995.
[4]康孟利, 凌建刚, 林旭东. 果酒降酸方法的应用研究进展[J]. 现代农业科技, 2008(24): 26-27; 31.
[5]文连奎, 赵薇, 张微, 胡耀辉. 果酒降酸技术研究进展[J]. 食品科学, 2010, 31(11): 325-328.
[6]吕会娟, 逄森贵, 闫玉亮. 山葡萄酒降酸新工艺研究[J]. 酿酒工艺, 2008(21): 42-43.
[7]张春晖, 夏双梅, 莫海珍. 微生物降酸技术在葡萄酒酿造中的应用[J]. 酿酒科技, 2000(2): 56-58; 60.
[8]高年发, 王淑豪, 李晓刚, 等. 酿酒酵母与粟酒裂殖酵母属间原生质体融合选育降解苹果酸强的葡萄酒酵母[J]. 生物工程学报, 2000, 16 (6): 718-722.
[9]张春晖, 夏双梅, 张家翔. 生物工程技术在苹果酸-乳酸发酵中的应用[J]. 酿酒科技, 2002(5): 51-54.
[10]丁正国. 葡萄酒苹果酸: 乳酸发酵的理论与实践[J]. 中国酿造, 1995 (5): 10-15.
[11]KOHN L D, TRUDGILL P W. Tartaric acid metabolism Ⅲ. The formation of glyceric acid[J]. J Bio Chem, 1968, 243(10): 2465-2471.
[12]KOHN L D, TRUDGILL P W. Tartaric acid metabolism Ⅳ. Crytalline L-malic dehydofenase from Pseudomonas acidovoran sp. [J]. J Bio Chem, 1968, 243(10): 2472-2478.
[13]KOHN L D, PACKMAN P M, ALLEN R H, et al. Tartaric acid metabolism Ⅴ. Crystalline tartrate dehydrogenase[J]. J Bio Chem, 1968, 243(10): 2479-2485.
[14]KOHN L D, JAKOBY W B. Tartaric acid metabolism Ⅵ. Crystalline oxaloglycolate reductive decarboxylase[J]. J Bio Chem, 1968, 243(10): 2486-2493.
[15]KOHN L D, JAKOBY W B. Tartaric acid metabolism Ⅶ. Crystalline hydroxypyruvate reductase[J]. J Bio Chem, 1968, 243(10): 2472-2478.
[16]KOHN L D. Tartaric acid metabolism Ⅷ. Crystalline tartroniase mialdehydereductase[J]. J Bio Chem, 1968, 243(10): 4426-4433.
[17]舒正玉, 杨江科, 闫云君. 黑曲霉F044脂肪酶的分离纯化及酶学性质研究[J]. 生物工程学报, 2007, 23(1): 96-100.
[18]赵林果, 夏文静, 游丽金, 等. 黑曲霉胞内β-葡萄糖苷酶分离提纯及其性质的研究[J]. 现代化工, 2008, 28(10): 38-42.
[19]陈均辉, 陶力, 李俊, 等. 生物化学实验[M]. 3版. 北京: 科学出版社, 2003: 63-64.
[20]GIFFHORN F, KUHN A. Purificationand characterizationofa bifunctional. L-(+)tartrate dehydrogenase D-(+)malate dehydrogenase (decarboxylating) from Rhodopseudomonas sphaerodies Y.[J]. J Bacteriology, 1983, 155: 281-290.
Isolation and Purification of Key Tartaric Acid Degrading Enzyme from Aspergillus niger F1
WANG Gui-zhen,DONG Xin,WEN Lian-kui*
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
The purpose of this study was to prepare a key tartaric acid degrading enzyme from Aspergillus niger F1. Aspergillus niger F1 was cultured and the expression of tartaric acid degrading enzymes was induced by adding tartaric acid into the medium. Cultured mycelia of Aspergillus niger F1 were collected and homogenized in liquid nitrogen. Crude enzyme extract was obtained by ultrasonic assisted extraction, added with protamine sulfate for removing nucleic acids, denatured for removing unwanted proteins, concentrated by PEG treatment, dialyzed for desalting, and then purified by DEAE-cellulose 52 anion exchange chromatography and Sephadex G-75 gel filtration chromatography to obtain a single component with a purification factor of 14.32. The enzyme was proven to be a dehydrogenase.
Aspergillus niger;tartaric acid degrading enzymes;separation and purification
Q519
A
1002-6630(2012)15-0235-04
2011-09-23
吉林省科技支撑计划项目(20090228)
王贵珍(1983—),女,硕士,主要从事食品微生物及生物技术研究。E-mail:wangguizhen510@126.com
*通信作者:文连奎(1962—),男,教授,博士,主要从事长白山野生资源的开发利用研究。E-mail:wenliankui@163.com

