四川香肠中产蛋白酶和脂肪酶霉菌的分离与鉴定
杨 勇,程 燕*,廖定容,帅 谨
(四川农业大学食品学院,四川 雅安 625014)
四川香肠中产蛋白酶和脂肪酶霉菌的分离与鉴定
杨 勇,程 燕*,廖定容,帅 谨
(四川农业大学食品学院,四川 雅安 625014)
从四川自然发酵香肠表面分离得到121株霉菌菌株,分属曲霉、青霉和毛霉,以蛋白酶、脂肪酶活性作为筛选指标,经初筛、复筛,得到一株产蛋白酶、脂肪酶活性强的菌株P2。经形态观察以及菌株的分子生物学鉴定,该菌株鉴定为产黄青霉。通过对该菌株进行毒理学实验,表明各实验组小白鼠行为体征、血液指标、生化指标以及脏器的颜色、形状、大小均与空白对照组之间无显著差异,可初步判定该菌株是安全无毒的。
四川香肠;霉菌;蛋白酶;脂肪酶;分离;鉴定
霉菌在食品加工工业中用途十分广泛,许多酿造发酵食品、食品原料的制造,如豆腐乳、豆豉、酱、酱油、柠檬酸等都是在霉菌的参与下生产加工出来的。绝大多数霉菌能把加工原料中的淀粉、糖类等碳水化合物、蛋白质等含氮化合物及其他种类的化合物进行转化,制造出多种多样的食品、调味品及食品添加剂。霉菌在发酵肉制品中的应用主要集中于欧洲南部,比如意大利、西班牙、法国、匈牙利和德国的南部,主要的发酵肉制品类型有火腿、熏肉薄片、风干脖肉、杯形香肠、干腌香肠。
霉菌发酵肉制品是由霉菌的酶(蛋白酶、脂酶)系,在肉制品表面形成一层“保护膜”,充分隔氧,防止制品酸败、褪色,有利于产品的干燥,形成特征的表面外观,同时分解蛋白质、脂肪和乳酸产生特殊香味[1-2]。关于霉菌对香肠风味影响的研究文献有很多[3-9],主要是两方面:一是霉菌产生的脂肪酶分解脂肪,提高游离氨基酸的含量,对产品的香味和风味起重要作用;二是霉菌的蛋白酶对蛋白质进行水解,产生特殊的感官特征。目前国外已经筛选出了7种产黄青霉和2种纳地青霉用于工业化生产;德国将白地青霉和娄地青霉用于肉制品发酵已取得了成功。
传统发酵肉制品生产,其霉菌直接来自于环境并非人为接种的,常检测出有霉菌毒素的存在[10-12],因此用于发酵肉制品的霉菌应经过严格的筛选,确定其不产生霉菌毒素才能保证产品的安全性。霉菌作为肉品发酵剂,必须具备有不产毒素和无潜在的病原性威胁的特点,同时应具有良好均衡的蛋白质和脂肪降解活性,菌丝可以使产品表面致密坚固,颜色为灰白、黄色或乌黑。
四川香肠是国内传统腌腊制品中的典型代表之一,因其香气浓郁、滋味鲜美、风味独特而深受广大消费者的喜爱,在四川特产食品中,占有较高的地位并享有很好的声誉。其中含有丰富的有益微生物,是筛选优良发酵剂的重要微生物资源,具有很高的研究价值和开发潜力。本研究根据肉用发酵剂的筛选原则,以菌株产蛋白酶和脂肪酶能力为指标,以传统四川香肠为材料,以毒理学实验为依据,从中分离出安全的产蛋白酶和脂肪酶的霉菌菌株,同时对其进行形态和分子生物学鉴定,以期为发酵肉制品生产霉菌发酵剂的筛选与开发提供参考。
1 材料与方法
1.1 菌种与动物
所有菌株均从传统四川香肠中分离,香肠为四川农业大学食品学院肉品加工室的自制产品。
普通级昆明种小鼠,由成都达硕实验动物技术公司提供,合格证是:SCXK(川)2008-24,小鼠体质量均为18~22g。
1.2 培养基
察氏培养基:硝酸钠3g、磷酸氢二钾1g、硫酸镁0.5g、氯化钾0.5g、硫酸铁0.01g、蔗糖30g,蒸馏水1000mL,琼脂20g,121℃灭菌20min,供菌株分离用。
PDA培养基:葡萄糖20g、琼脂15g,200g马铃薯去皮后切丁,加入1L自来水煮沸30min后过滤,滤液以蒸馏水补满1L,121℃灭菌15min。
孟加拉红培养基:蛋白胨5g、葡萄糖10g、磷酸二氢钾1g、硫酸镁0.5g,1/3000孟加拉红100mL,琼脂20g,补水至1000mL,115℃灭菌30min。
蛋白酶检测培养基:以PDA为基础培养基,添加100g脱脂奶粉,115℃灭菌20min,其他条件不变。
脂肪酶检测培养基[13](三丁酸甘油酯琼脂):将PDA培养基在121℃灭菌15min,冷却至80℃时,加入1%三丁酸甘油酯。
1.3 仪器与设备
DHP-9162恒温培养箱 上海一恒科技有限公司;DSX-280B手提式高压蒸汽灭菌锅 上海申安公司;SWCJ-1F洁净工作台 苏州安泰空气技术有限公司;Sorvall离心机 美国科俊仪器有限医疗器械厂;MyCycler PCR仪、PowerPac Basic电泳仪、水平电泳槽、凝胶成像系统 美国Bio-Rad公司;全自动生化分析仪 意大利AMS公司;微量移液器 美国Thermo Finnpipette公司。
1.4 方法
1.4.1 菌种的分离纯化
以无菌操作剪取不同晾挂发酵期的香肠为样品,用无菌生理盐水制成一定浓度的菌悬液,分别于察氏培养基、PDA培养基、孟加拉红培养上涂布,培养5d挑取单个菌落进一步分离纯化。
1.4.2 菌株初筛实验
将所分离、纯化的菌株,接种于蛋白酶活性筛选培养基和脂肪酶活性培养基中。25℃恒温培养5d,分别测定每皿中透明圈直径和菌落直径,以每皿中3个菌落的平均值记为该菌株的测定结果,计算HE值(HE值=透明圈直径/菌落直径)。选择HE值较大的菌株,进一步做复筛实验。
1.4.3 菌株复筛实验
1.4.3.1 粗酶液的制备
将经过初筛后HE值较高的菌株,分别接种于PDA液体培养基中,置于旋转摇床上160r/min,25℃培养3d,取若干灭菌玻璃珠于三角瓶内,振摇,破碎菌丝,40℃水浴浸提1h,然后过滤,所得滤液即粗酶液,用于酶活性的测定。
1.4.3.2 蛋白酶活力测定
采用Folin-酚法[14]测定蛋白酶活力。酶活力单位定义为40℃、pH7.0条件下,1min内水解酪蛋白产生1μg酪氨酸所需的酶量为1个蛋白酶活力单位以U表示。
1.4.3.3 脂肪酶活力测定
以橄榄油为底物,采用NaOH滴定法[15]。酶活力单位定义为40℃、pH7.5条件下,以每分钟产生1μmol脂肪酸所需的酶量定义为1酶活力单位,以U表示。
1.4.4 霉菌的鉴定
1.4.4.1 菌落形态
观察分离培养基平板上菌落的形态,并记录结果。
1.4.4.2 菌株形态
将分离得到的菌株用乳酸苯酚液固定制成载片标本,在高倍显微镜下观察。
1.4.4.3 菌株的分子生物学鉴定[16]
DNA的提取采用试剂盒法(Omega真菌DNA提取试剂盒)。PCR扩增反应,以提取的菌株DNA为模板,ITS1(5'-TCCGTAGGTGAACCTGCGG-3')、ITS4 (5'-TCCTCCGCTTATTGATATGC-3')为引物,采用常规方法进行。将序列在GenBank中已有的ITS序列进行相似性比较分析。选取与供试菌株相似度高的序列,构建系统进化树,更直观的反映菌株间的亲缘关系。
1.4.5 霉菌的毒理学实验[17]
1.4.5.1 受试物
受试物为菌株的发酵液。将筛选出的菌株以土豆液体培养基为原料,在25℃、160r/min摇床培养48h的发酵液,发酵液直接饲喂昆明种小鼠。
1.4.5.2 急性毒理实验
按照GB 15193.3—2003《急性毒性试验》方法。健康的昆明种小鼠40只(雌雄各半),按照随机分组原则分为2组,每组20只,雌雄各半。实验组按0.4mL/20g(以体质量计),分两次(间隔4h)将孢子悬液经口灌胃小白鼠;空白对照组给予相同剂量无菌土豆培养液。实验前禁食过夜,禁食期间正常给水。灌胃2h后恢复正常饮食。实验期限为15d。每天观察记录小白鼠饮水、进食、活动及死亡情况。
1.4.5.3 30d喂养实验
按照 GB 15193.13—2003《30天和90天喂养试验》方法。健康昆明小鼠80只(雌雄各半),按照随机分组原则分为4组,青霉P2发酵液各设为2.5、5.0、10.0g/kg(以体质量计)3个剂量组,并设蒸馏水为空白对照组。
2 结果与分析
2.1 霉菌的分离、纯化和初步鉴定结果
从四川香肠中分离出霉菌菌株121株,分离出的菌株主要为青霉(Penicillium)、毛霉(Mucor)和曲霉(Aspergillus)。Sutic等[18]从356条美国乡村火腿中分离到403株青霉,121株式曲霉。Comi等[19]从伊比亚火腿表面分离到占优势的青霉、曲霉、毛霉、散囊菌和镰刀霉,其中青霉、曲霉和散囊菌共占了97%。陈士怡等[20]从金华火腿表面分离出226株青霉、159株曲霉。蒋云升等[21]从80条不同发酵期如皋火腿上分离出152株霉菌菌株,分属于曲霉、青霉、毛霉。本研究的实验结果与上述报道基本一致,说明霉菌是自然发酵肉制品中的重要微生物。
2.2 菌株初筛实验结果
经过初步鉴定的各属菌株经培养后,挑选生长速度快、孢子致密、透明圈明显的菌株进行蛋白酶和脂肪酶HE值的测定,并选出同时具有较高蛋白酶HE值和脂肪酶HE值的8株,将其HE值绘制成图,见图1。
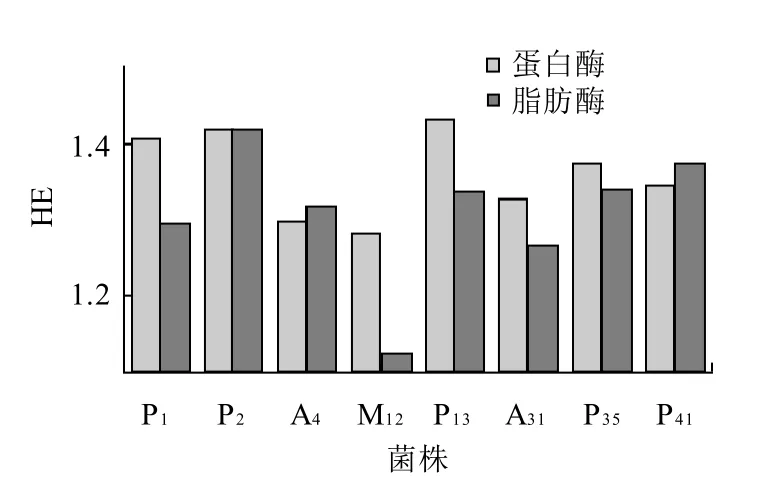
图1 霉菌菌株的蛋白酶和脂肪酶HE值Fig.1 HE values of protease and lipase of eight strains
由图1可知,蛋白酶HE值从高到低依次为:P13、P2、P1、P35、P41、A31、A4、M12;脂肪酶 H E值从高到低依次为:P2、P41、P13、P35、A4、P1、A31、M12。
2.3 菌株复筛实验结果
对初筛结果HE值较高的8株菌种进行酪氨酸产量和脂肪酶活力测定,结果见表1。
表1 受试菌酪氨酸产量和脂肪酶活力(±s,n=3)Table 1 Protease and lipase activities of tested strains (±s,n=3)
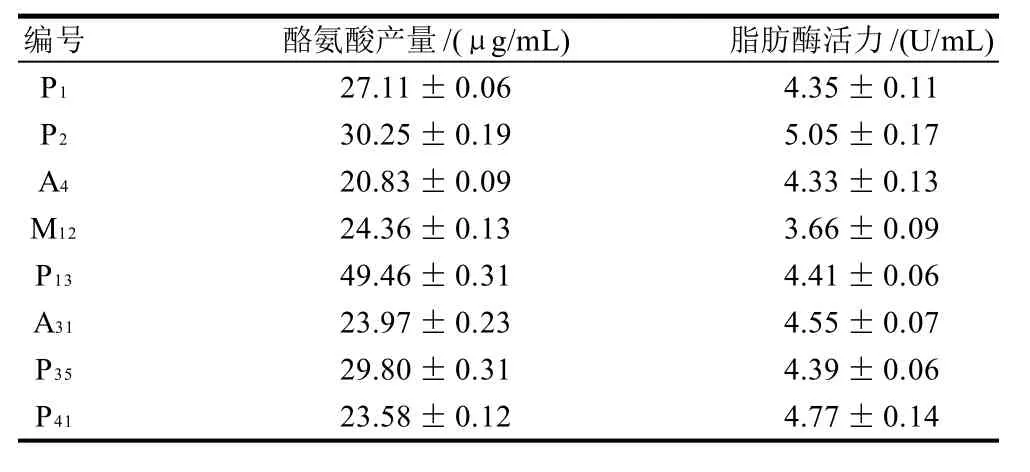
表1 受试菌酪氨酸产量和脂肪酶活力(±s,n=3)Table 1 Protease and lipase activities of tested strains (±s,n=3)
编号 酪氨酸产量/(μg/mL) 脂肪酶活力/(U/mL)P1 27.11±0.06 4.35±0.11 P2 30.25±0.19 5.05±0.17 A4 20.83±0.09 4.33±0.13 M12 24.36±0.13 3.66±0.09 P13 49.46±0.31 4.41±0.06 A31 23.97±0.23 4.55±0.07 P35 29.80±0.31 4.39±0.06 P41 23.58±0.12 4.77±0.14
由表1可知,菌落的酪氨酸产量从高到低依次是:P13、P2、P35、P1、M12、A31、P41、A4;菌落脂肪酶活力从高到低依次是:P2、P41、A31、P13、P35、P1、A4、M12。可看出菌株青霉P2的蛋白酶和脂肪酶活性最高。
霉菌产生的脂肪酶分解脂肪提高游离氨基酸的含量,对产品的香味和风味起重要作用[22],霉菌的水解蛋白能力与感官特征有一定的关系[23-24],因此在许多研究中,脂肪酶和蛋白酶活性是第一筛选标准。Rojas等[25]从火腿中分离出具有较高蛋白水解能力的222株产黄青霉,它们降解火腿中的蛋白质,生产大量游离氨基酸,使火腿呈香。Ockerman等[26]从西班牙火腿中分离出脂肪酶活性较强的5株青霉,并对其进行脂肪酶活力测试。蒋云升等[21]从如皋火腿肠中分离出152株菌株,其中青霉属具有较高的蛋白酶和脂肪酶活性。本研究中蛋白酶和脂肪酶的测试结果也充分说明从四川发酵香肠中分离出的青霉菌具有蛋白酶和脂肪酶活性,同时P2菌株具有较高的蛋白酶和脂肪酶活力。
2.4 菌种的鉴定
2.4.1 形态特征
菌落形态特征:在PDA培养基25℃培养5d后生长旺盛,生长至直径21~25mm。菌落初生为白色,随着不断生长变为青绿色,边缘菌丝体白色,菌落成圆形,质地绒状,边缘整齐,菌落反面呈淡黄色至黄色。
显微镜观察结果:子实体为帚状,其帚状枝有单束的小梗,分生孢子小梗有分枝,产生单轮帚状枝。孢子成串或链状,单个孢子为球形,非常光滑。依据文献[15]资料,初步鉴定为半知菌门,丝孢纲,丛梗孢科,青霉属(Penicillium)。
2.4.2 分子生物方法鉴定结果
以P2菌株的总DNA为模板,采用通用引物进行扩增,经琼脂糖电泳检测,出现唯一条带,大约为540bp的特异性扩增产物,如图2所示。
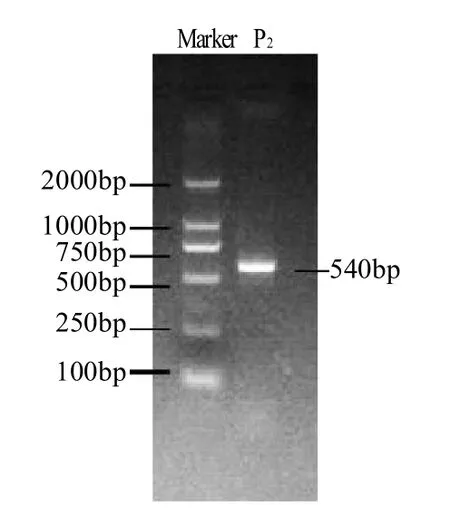
图2 P2的18S rDNA的PCR产物电泳图Fig.2 Agarose gel electrophoresis of PCR-amplified 18S rDNA from P2 strain
经DNA序列分析,菌株P2的18S rDNA序列长度为552bp,该序列已在GenBank上注册(JQ011376)。将测得的序列与数据库中已注册的18S rDNA序列进行B L A S T,并建立系统发育树,如图3所示。P2和Penicillium chrysogenumstrain F2 (HQ380757)的亲缘关系最近,同源性达到9 8%,可归为一群。

图3 菌株P2序列进行BLAST的系统发育进化树Fig.3 Phylogenetic tree based on 18S rDNA sequence
2.5 毒理学实验结果
在30d喂养期间,对照组和喂养组均未出现小白鼠死亡现象,进食、饮水和行为活动均正常,未观察到任何异常行为和体征。说明P2菌株发酵液对小白鼠生理功能无明显损害性。
2.5.1 急性毒理学实验结果
在实验期间各实验组小白鼠饮食和活动正常,生长发育良好,体质量增加,未见有任何明显的中毒表现,也无死亡。小白鼠喂养15d后解剖,肉眼观察其心、肝、脾、肺、肾、肠等脏器,与空白对照组相比,皆未发现病变和差异。这表明菌株发酵液的饲喂剂量达10.0g/kg体质量时不会引起小白鼠的死亡。按急性毒性剂量评价分级标准属无毒级物质[27]。
2.5.2 30d喂养实验结果
2.5.2.1 小白鼠30d的喂养进食量和食物利用率的影响
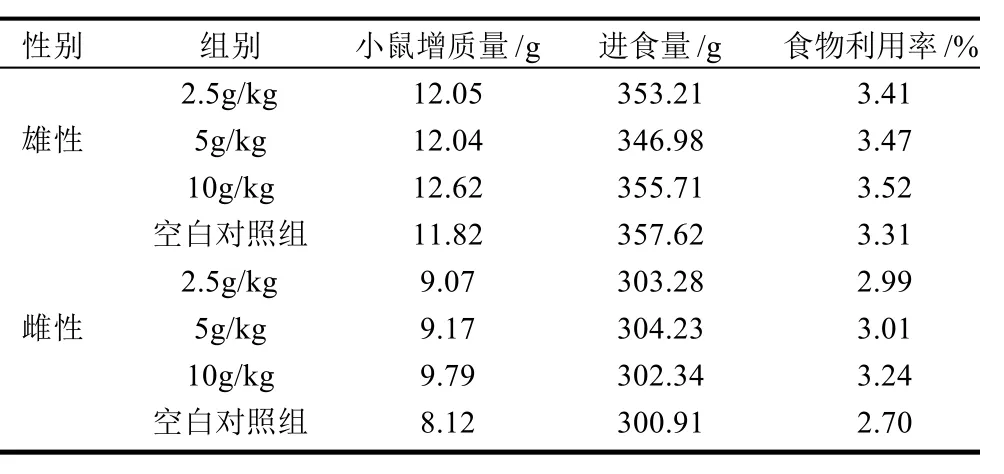
表2 P2菌株发酵液对小鼠食物利用率的影响Table 2 Effect of fermentation broth of P2 strain on mouse body weight, feed intake and feed conversion efficiency
由表2可知,P2发酵液各组与空白对照组之间无统计学的差异(P>0.05),可见P2发酵液喂养小鼠后,对其体质量进食量和食物利用率无明显影响。随着剂量的增加,食物的利用率略微增加,这说明P2发酵液在高剂量下,可能对小鼠有促进消化的功效。
2.5.2.2 小鼠血液学指标分析
由表3可知,各饲喂剂量组的小鼠红细胞、白细胞、血小板以及血红蛋白数结果与空白对照组之间无显著差异(P>0.05)。即P2发酵液对小鼠的血常规指标无明显影响。
表3 P2发酵液对小鼠血液指标的影响(±s,n=3)Table 3 Effect of fermentation broth of P2 strain on mouse blood indexes (±s,n=3)
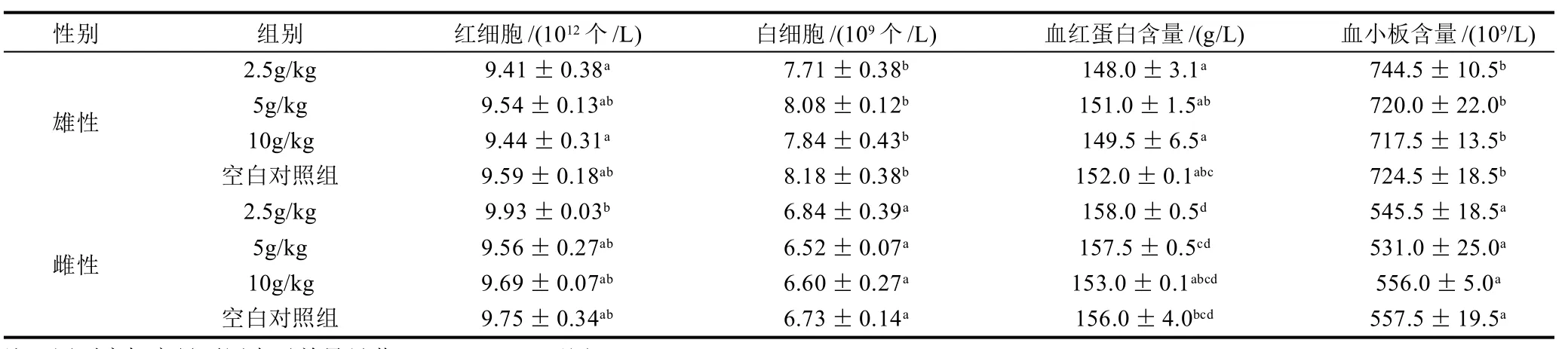
表3 P2发酵液对小鼠血液指标的影响(±s,n=3)Table 3 Effect of fermentation broth of P2 strain on mouse blood indexes (±s,n=3)
注:同列肩标字母不同表示差异显著(P<0.05)。下同。
性别 组别 红细胞/(1012个/L) 白细胞/(109个/L) 血红蛋白含量/(g/L) 血小板含量/(109/L)2.5g/kg 9.41±0.38a 7.71±0.38b 148.0±3.1a 744.5±10.5b雄性 5g/kg 9.54±0.13ab 8.08±0.12b 151.0±1.5ab 720.0±22.0b 10g/kg 9.44±0.31a 7.84±0.43b 149.5±6.5a 717.5±13.5b空白对照组 9.59±0.18ab 8.18±0.38b 152.0±0.1abc 724.5±18.5b 2.5g/kg 9.93±0.03b 6.84±0.39a 158.0±0.5d 545.5±18.5a雌性 5g/kg 9.56±0.27ab 6.52±0.07a 157.5±0.5cd 531.0±25.0a 10g/kg 9.69±0.07ab 6.60±0.27a 153.0±0.1abcd 556.0±5.0a空白对照组 9.75±0.34ab 6.73±0.14a 156.0±4.0bcd 557.5±19.5a
表4 P2发酵液对小鼠血液生化指标的影响(±s,n=3)Table 4 Effect of fermentation broth of P2 strain on mouse blood biochemical indexes (±s,n=3)
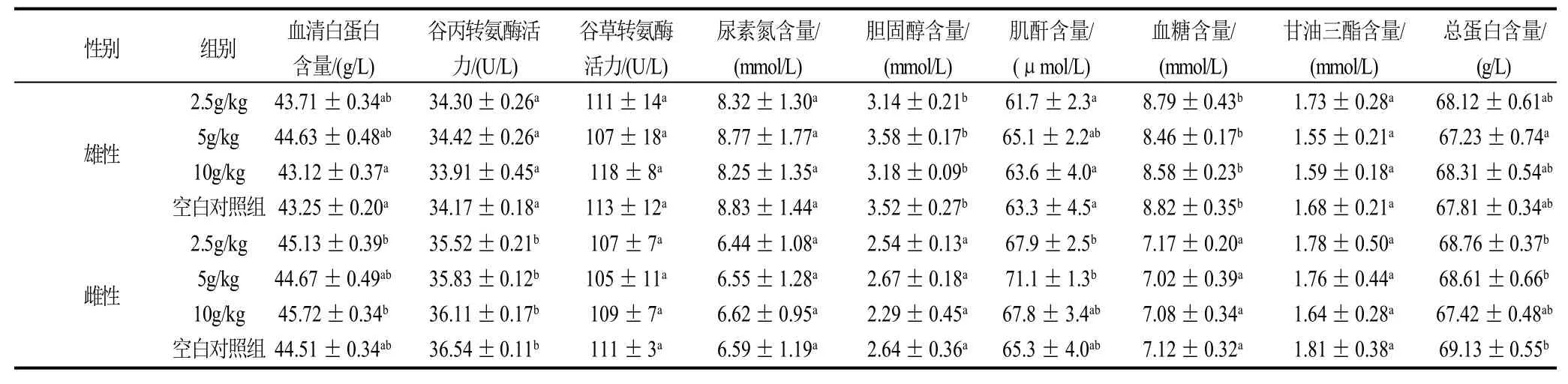
表4 P2发酵液对小鼠血液生化指标的影响(±s,n=3)Table 4 Effect of fermentation broth of P2 strain on mouse blood biochemical indexes (±s,n=3)
性别 组别 血清白蛋白 谷丙转氨酶活 谷草转氨酶 尿素氮含量/ 胆固醇含量/ 肌酐含量/ 血糖含量/ 甘油三酯含量/ 总蛋白含量/含量/(g/L) 力/(U/L) 活力/(U/L) (mmol/L) (mmol/L) (μmol/L) (mmol/L) (mmol/L) (g/L)2.5g/kg 43.71±0.34ab 34.30±0.26a 111±14a 8.32±1.30a 3.14±0.21b 61.7±2.3a 8.79±0.43b 1.73±0.28a 68.12±0.61ab雄性 5g/kg 44.63±0.48ab 34.42±0.26a 107±18a 8.77±1.77a 3.58±0.17b 65.1±2.2ab 8.46±0.17b 1.55±0.21a 67.23±0.74a 10g/kg 43.12±0.37a 33.91±0.45a 118±8a 8.25±1.35a 3.18±0.09b 63.6±4.0a 8.58±0.23b 1.59±0.18a 68.31±0.54ab空白对照组 43.25±0.20a 34.17±0.18a 113±12a 8.83±1.44a 3.52±0.27b 63.3±4.5a 8.82±0.35b 1.68±0.21a 67.81±0.34ab 2.5g/kg 45.13±0.39b 35.52±0.21b 107±7a 6.44±1.08a 2.54±0.13a 67.9±2.5b 7.17±0.20a 1.78±0.50a 68.76±0.37b雌性 5g/kg 44.67±0.49ab 35.83±0.12b 105±11a 6.55±1.28a 2.67±0.18a 71.1±1.3b 7.02±0.39a 1.76±0.44a 68.61±0.66b 10g/kg 45.72±0.34b 36.11±0.17b 109±7a 6.62±0.95a 2.29±0.45a 67.8±3.4ab 7.08±0.34a 1.64±0.28a 67.42±0.48ab空白对照组 44.51±0.34ab 36.54±0.11b 111±3a 6.59±1.19a 2.64±0.36a 65.3±4.0ab 7.12±0.32a 1.81±0.38a 69.13±0.55b
2.5.2.3 小鼠血液生化指标分析
由表4可知,小鼠的血清白蛋白、谷丙转氨酶、谷草转氨酶、尿素氮、胆固醇、肌酐、血糖、甘油三酯和总蛋白的含量与阴性对照组之间无明显差异(P>0.05)。
2.5.2.4 小鼠解剖结果
各饲喂剂量组的小白鼠解剖观察结果显示:各脏器颜色、形状、大小等均未见病变。说明通过对该菌株进行毒理学实验,表明各实验组小白鼠行为体征、脏体、血液指标和生化指标与空白对照组之间无显著差异,可初步判定该菌株是安全无毒的。
目前应用于干香肠表面处理的霉菌发酵菌株都属于青霉属,如纳地青霉(Penicillium nalgiovense)、产黄青霉(P.chrysogenum)、卡门培尔干酪青霉(P.camemberti)[28]。Benito等[29]从干腌火腿中分离得到一株菌株Penicillium chrysogenum,这个菌株在各种试验中均显示无毒性,且具有较强的降解蛋白质的能力,能降解肌肉蛋白质产生多肽和游离氨基酸。Nunez等[30]研究伊比利亚火腿上的霉菌菌相构成及其安全性评价,认为不产毒的产黄青霉(P.chrysogenum)可作为火腿的发酵剂。蒋云升等[21]从如皋火腿上分离得到一株产蛋白酶、脂肪酶活性较强的产黄青霉,并将该菌株涂布接种于腌腿表面,生产的火腿香气浓郁。
3 结 论
3.1 利用察氏培养基、PDA培养基和孟加拉红培养基,从四川自然发酵香肠中共分离出121株霉菌,其中主要是青霉(Pe n ic illiu m)、毛霉(Mu c o r)和曲霉(Asperillus)。通过脂肪酶活性和蛋白酶活性测试,得到8株具有脂肪酶和蛋白酶活性的菌株,其中一株菌株同时具有较强的蛋白酶和脂肪酶活性。
3.2 通过对菌株的菌落及显微镜观察、ITS序列测定,结果显示原始编码P2的菌株和Penicillium chrysogenumstrain F2 (HQ380757)同源性达到98%。
3.3 对P2菌株进行毒理学实验结果显示发酵液对小鼠的行为体征、血液指标、生化指标以及脏器颜色、形状、大小均无明显的不良影响。因此可初步判定菌株P2的发酵液产品符合GB 15193.1—2003《食品安全性毒理学评价程序》的要求,是安全无毒的。
[1] BACUS J N. Fermented meat and poultry products[J]. Advances in Meat Research, 1986, 2: 123-164.
[2] BRUNA J M, HIERRO E M, de la HOZ L, et al. The contribution ofPenicillium aurantiogriseumto the volatile composition and sensory quality of dry fermented sausages[J]. Meat Science, 2001, 59(1): 97-107.
[3] OCKERMAN H W, CESPEDES SANCHEZ F J, ORTEGA MARISCAL M A, et al. Influence of temperature on proteolytic activity of indigenous Spanish molds in meat products[J]. Muscle Foods, 2001, 12(4): 263-273.
[4] OCKERMAN H W, CESPEDES SANCHEZ F J, ORTEGA MARISCAL M A, et al. The lipolytic activity of some indigenous Spanish molds isolated from meat products[J]. Muscle Foods, 2001, 12(4): 275-284.
[5] HWANG H J, VOGEL R F, HAMMES W P. Entwicklung von schimmelpilzkulturen fr die rohwurstherstellung: charakterisierung der stmme und toxikologische bewertung=development of mould cultures for susage fermentation[J]. Fleischwirtschaft, 1993, 73: 89-92.
[6] HWANG H J, VOGEL R F, HAMMES W P. entwicklung von schimmelpilzkulturen fü r die rohwurstherstellung: technologische eignung der stmme und sensorische bewertung der produkte=development of mould cultures for susage fermentation Technical properties of the strains and sensorial assessment of the products[J]. Fleischwirtschaft,1993, 73: 327-332.
[7] BERWAL J S, DINCHEV D. Molds as protective cultures for raw dry sausages[J]. Food Protection, 1994, 57: 928-930.
[9] LEISTNER L. Mould-fermented foods: recent developments[J]. Food Biotechnology, 1990, 4: 433-441.
[10] SAMSON R A, HOEKSTRA E S, FRISVAD J C, et al. Introduction to food-borne fungi[M]. Baarn: Centraalbureau voor Schimmelcultures, 1995:212-218.
[11] BREMMELGARD A. Truslen fra multiresistente mikroorganismer[J].Ugeskrift for Leager, 1998, 160: 6329-6344.
[12] ANDERSEN S J. Antimikrobielle egenskaber hos hvidskimmelkulturer til fermentering af pφlser [D]. Lyngby: Technical University of Denmark,1994.
[13] 卢世珩, 刘光烨, 江跃林, 等. 合成乙酸乙酯酯肪酶产生菌的筛选及产酶条件[J]. 微生物学通报, 1994, 21(1): 23-26.
[14] 张树政. 酶制剂工业[M ]. 北京: 科学出版社, 1998.
[15] 雷晓燕. 土壤中产碱性脂肪酶霉菌的筛选[J]. 沈阳化工学院学报,2006, 20(1): 9-11.
[16] WHITE T J, BRUNS T, LEE S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[C]// PCR protocols a guide to methods and applications. New York: Academic Press,1990: 315-322.
[17] GB 15193.1—2003食品安全性毒理学评价程序和方法[S].
[18] SUTIC M, AYRES J C, KOEHLER P E. Identification and aflatoxin production of molds isolated from country cured hams[J]. Appl Microbiol,1972, 23(3): 656-658.
[19] COMI G, ORLIC S, REDZEPOVIC S, et al. Moulds isolated from Istrian dried ham at the pre-ripening and ripening level[J]. Food Microbiology, 2004, 96: 29-34.
[20] 陈士怡, 翁芷芬, 游树鹏, 等. 金华火腿微生物研究[J]. 杭州大学学报, 1980(3): 93-96.
[21] 蒋云升, 潘明. 如皋火腿用霉菌性表面涂膜发酵剂的应用研究[J]. 食品与发酵工业, 2007, 33(7): 81-84.
[22] SELGAS M D, CASAS C, TOLEDO V M, et al. Effect of selected mould strains on lipolysis in dry fermented sausages[J]. European Food Research and Technology, 1999, 209: 360-365.
[24] GEISEN R. Fungal starter cultures for fermented foods: molecular aspects[J]. Trends in Food Science and Technology, 1993, 4: 251-256.
[25] ROJAS F J, JODRAL M, GOSALVEZ F, et al. Mycoflora and toxigenicAspergillus flavusin Spanish dry-cured ham[J]. Food Microbiology, 1991, 13: 249-256.
[26] OCKERMAN H W, CESPEDES F, SANCHEZ J, et al. The lipolytic activity of some indigenous spanish molds isolated from meat products[J]. Muscle Foods, 2001, 12: 275-284.
[27] 赵文. 食品安全性评价[M]. 北京: 化学工业出版社, 2006.
[28] HAMMES W P, HERTE L C. New developments in meat starter cultures[J]. Meat Science, 1998, 49: 125-138.
[29] BENITO M J, NNEZ F, MARI A G, et al. Generation of non-protein nitrogen and volatile compounds byPenicillium chrysogenumPg 222 activity on pork myofibrillar proteins[J]. Food Microbiology, 2005, 22:513-519.
Isolation and Identification of Proteinase and Lipase Producing Mould from Sichuan Sausages
YANG Yong,CHENG Yan *,LIAO Ding-rong,SHUAI Jin
(College of Food Science, Sichuan Agricultural University, Ya’an 625014, China)
A total of 121 mould strains were isolated from the surface of naturally fermented Sichuan sausage, which belonged toAspergillus,PenicilliumandMucor. A strain with the highest proteanase and lipase activities named as P2 was screened out of them by primary and secondary screening. According to its morphological and molecular biological characteristics, P2 was identified asPenicillium chrysogenum. Toxicological tests were carried out to test the safety of P2. The data obtained showed that the behavior, blood indicators, biochemical parameters and viscera appearance of tested mice revealed no significant difference compared to those of control mice (P> 0.05), indicating that P2 is a safe and non-toxic mould.
Sichuan sausage;mould;proteinase;lipase;isolation;identification
TS201.3
A
1002-6630(2012)15-0246-06
2011-11-28
四川省教育厅科研计划项目(11ZA082)
杨勇(1969—),男,副教授,博士,研究方向为肉品科学与技术。E-mail:yangyong676@163.com
*通信作者:程燕(1986—),女,硕士研究生,研究方向为肉品科学与技术。E-mail:binghuowangqing@126.com

