胰腺癌中血管内皮生长因子C、D表达与血管淋巴管新生的关系
李智峰 李高强 田云霄 袁艳龙 司华鹏 陶 丽
1.河北省邯郸市第一医院,河北邯郸 056802;河北省邯郸市中心医院,河北邯郸 056802
胰腺癌是常见的消化系统恶性肿瘤之一,其5年生存率仅为3%左右[1],预后较差。肿瘤细胞的淋巴管转移是人类肿瘤的一个早期特征[2],胰腺腺癌也不例外。事实上,胰腺内分泌肿瘤更容易发生淋巴结转移。本文探讨胰腺癌中血管内皮生长因子C(VEGF-C)及血管内皮生长因子D(VEGF-D)的表达与血管淋巴管新生的关系。
1 资料与方法
1.1 一般资料
63例胰腺癌标本来自2005年1月~2009年12月邯郸市第一医院及邯郸市中心医院肝胆外科行胰头十二指肠切除的胰腺癌病例并均经病理证实,其中,男43例,女20例,年龄37~79岁,平均59.7岁;有淋巴结转移者25例,占39.7%。按照国际抗癌联盟(UICC)胰腺癌TNM(T指原发肿瘤情况,N指淋巴转移情况,M指远处转移情况)分期(2002年)诊断标准[3]:Ⅰ~Ⅱ期33例,Ⅲ~Ⅳ期30例,所有患者术前均未行任何抗癌治疗。癌周组织为距肿瘤边缘0.3~0.5 cm无癌细胞浸润处。正常胰腺标本共13例,来自邯郸市第一医院病理科非胰腺疾病死亡者尸检存档蜡块,病理学检查证实全部为正常胰腺组织。
1.2 方法
兔抗人VEGF-C、VEGF-D及CD31单克隆抗体购自北京中杉生物技术有限公司,Envision二抗等购自上海长岛公司。切片常规脱蜡,微波抗原修复,Envision法免疫组化染色,常规复染封片。用已知的乳腺癌阳性切片作阳性对照,以磷酸盐缓冲溶液(PBS)代替VEGF-C、VEGF-D单克隆抗体作阴性对照。结果判定:VEGF-C、VEGF-D以癌细胞胞浆呈现棕黄色颗粒为阳性细胞,每例切片至少计数10个400倍视野,评分标准按Shimizu方法[4]:≥3分为阳性。毛细血管淋巴管的记数参照Weidner等[5]报道的方法:先在低倍视野下观察切片,选取癌周毛细血管淋巴管数量最丰富的区域,在200倍视野下记数5个视野毛细血管淋巴管数,取其平均值。所有镜检及计数均由两名不了解患者临床病理特征的病理医师完成。
1.3 统计学方法
采用SPSS 16.0统计软件进行分析,计量资料数据以均数±标准差(x±s)表示,比较采用t检验,计数资料采用百分率表示,组间对比采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 胰腺癌组织中VEGF-C和VEGF-D蛋白的表达
VEGF-C和VEGF-D阳性物质呈棕黄色细颗粒状,主要位于癌细胞胞浆。VEGF-C和VEGF-D表达具有异质性,以肿瘤边缘的癌组织表达相对较强。63例标本中VEGF-C阳性率为 60.3%(38/63),与正常胰腺组织 23.1%(3/13)比较差异有统计学意义(P < 0.05);VEGF-D 阳性率为 63.5%(40/63),与正常胰腺组织23.1%(3/13)比较差异有统计学意义 (P<0.05)。VEGF-C与VEGF-D在胰腺癌中的表达无相关性(χ2=2.361,P > 0.05)。 见表 1。
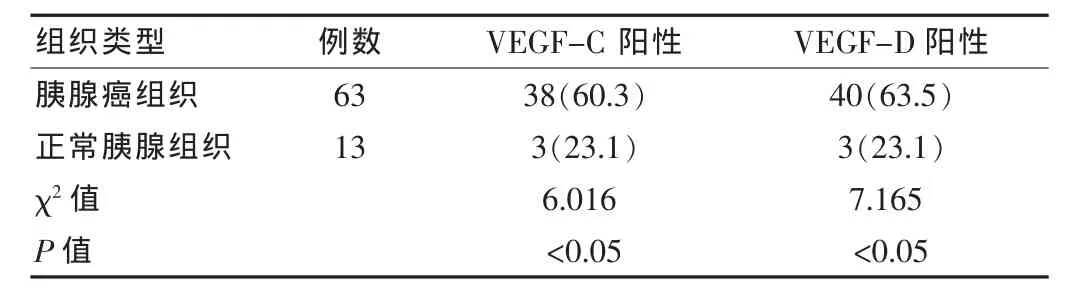
表1 胰腺癌组织中VEGF-C和VEGF-D蛋白的表达[n(%)]
2.2 胰腺癌组织中VEGF-C和VEGF-D与微血管淋巴管密度(MVD/MLVD)及淋巴结转移的关系
在胰腺癌周组织及正常胰腺组织中MVD/MLVD的均值分别为(14.83±4.32)、(8.08±3.07),差异有统计学意义(P <0.05)。 VEGF-C 阳性组中的癌周 MVD/MLVD(16.84±3.25)显著高于阴性组的(11.76±3.97),差异有统计学意义(P < 0.05);VEGF-C阳性组淋巴结转移率[55.26%(21/38)]高于阴性组的 16%(4/25),差异有统计学意义(P <0.05)。 VEGF-D 阳性组中的癌周MVD/MLVD (16.95±3.21)显著高于阴性组的(11.13±3.45),差异有统计学意义(P < 0.05);VEGF-D 阳性组淋巴结转移率[57.5%(23/40)]高于阴性的 8.7%(2/23),二者差异有统计学意义(P<0.05)。见表2。
3 讨论
相关研究发现无论是良性还是恶性肿瘤,都存在瘤内淋巴管;在良性肿瘤内淋巴管密度与肿瘤大小相关,恶性肿瘤的淋巴管密度与肝转移发生率相关[6],但与淋巴管转移发生率无关[7];近年来随着淋巴管标记物以及淋巴管生成因子的发现,对淋巴管生成性肿瘤转移的关注很多。肿瘤细胞VEGF-C的高表达和乏氧无明确联系[8]。肿瘤细胞VEGF-D的高表达cadherin似乎有联系,而肿瘤细胞VEGF-C的高表达可能是同样道理。这些发现证实,肿瘤中存在淋巴管新生,VEGF-C的表达与淋巴管侵袭及转移的发生相关[9-10]。
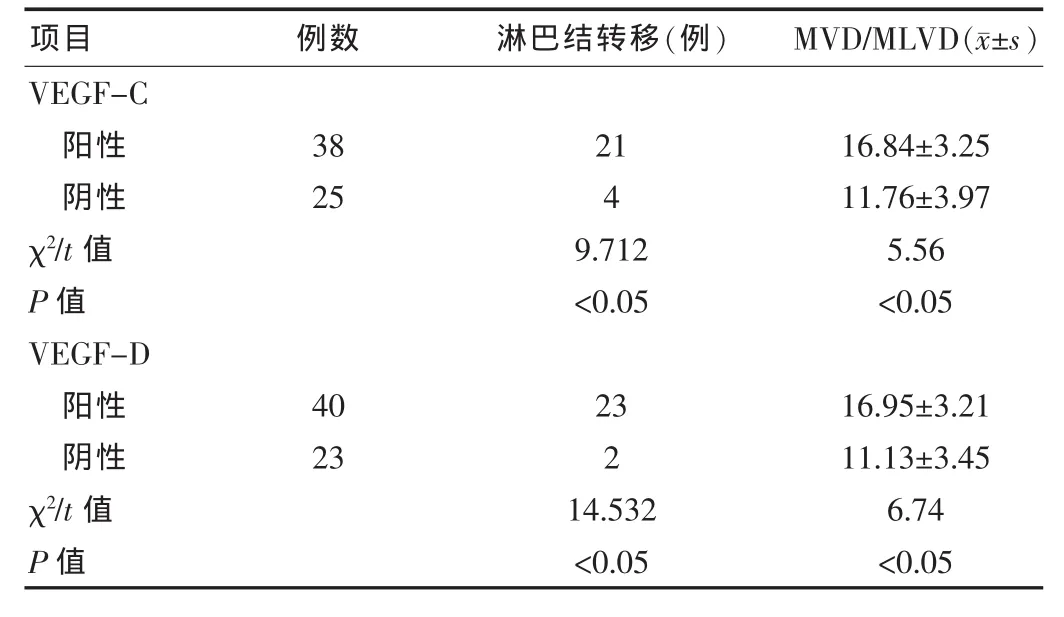
表2 胰腺癌组织中VEGF-C和VEGF-D与微血管淋巴管密度(MVD/MLVD)及淋巴结转移的关系
VEGFR-3:血管内皮生长因子-C的受体之一,以往认为它在正常成人组织和胚胎组织中特异的表达淋巴管,也是培养的淋巴管内皮细胞中保持特异性表达的唯一标志物。并且是一个淋巴管发生的调节因子。但最近有研究者认为它并非具有特异性,除存在淋巴管上皮细胞外,在正常组织的有孔血管、视网膜、伤口、肿瘤血管中亦有表达。肿瘤细胞表达VEGF-C,其中 21%(4/19)良性肿瘤为阳性,而 67%(6/9)的交界瘤与82%(9/11)的恶性瘤呈阳性表达。Onogawa等[11-12]发现在人结肠癌VEGF-C、VEGF-D高表达,且与结肠癌的淋巴管侵犯及淋巴结转移密切相关。笔者研究表明,在63例胰腺癌组 织中,VEGF-C 阳性率 60.3%(38/63),VEGF-D 为63.5%(40/63),且以肿瘤边缘部分及肿瘤与正常组织交界处表达最高,与正常对照组比较差异有统计学意义(P<0.05);在胰腺癌周组织中MVD/MLVD的均值为(14.83±4.32),明显高于正常胰腺中的 (8.08±3.0), 差异有统计学意义 (P<0.05);且VEGF-C及VEGF-D阳性组淋巴结转移率均高于阴性组,差异有统计学意义(P<0.05)。提示胰腺癌中VEGFC和VEGF-D蛋白表达升高,具有促进胰腺癌周血管淋巴生成、促进淋巴道转移的作用。此外,VEGF-C、VEGF-D蛋白表达与患者性别、年龄、肿瘤的大小及分化程度无关,与肿瘤的TNM分期有关,Ⅲ~Ⅳ期高于Ⅰ~Ⅱ期。
在肿瘤或VEGF-C诱导的新生淋巴管模型中,笔者发现在肿瘤周边区域,淋巴管新生的程度与淋巴管密度有相关性。研究显示[13-14]:在肿瘤淋巴管新生和肿瘤细胞经淋巴管转移的过程中,新形成的淋巴管是从即存的淋巴管网通过发芽方式产生的,而来源于骨髓的内皮祖细胞在其中只起很小或不起作用。VEGF-C、VEGF-D蛋白阳性组中胰腺癌周血管淋巴管密度明显增加,且与VEGF-C、VEGF-D的高表达明显正相关(P<0.05)。可能是促进淋巴管,导致肿瘤细胞进入淋巴管引起胰腺癌淋巴管侵袭和转移有关[15]。笔者推测VEGFC、D促进胰腺癌淋巴道转移机制是:胰腺癌癌细胞分泌的VEGF-C、D作为促血管淋巴管增生的始动因素,上调癌周组织内血管淋巴管内皮细胞膜上VEGFR的表达,二者互作用,使癌周血管淋巴管数目增多,内皮细胞增生,管壁结构通透性增加,增大了瘤细胞与淋巴管内皮接触的面积,改变了淋巴管内皮黏附特性或表面趋化因子的表达[16],再加上癌组织对淋巴管内皮细胞的破坏溶解作用,为癌细胞进入淋巴管提供了更加便利的通道[17]。
[1]Mohammed RA,Green A,El SS,et al.Prognostic significance of vascular endothelial cell growth factors-A,-C and-D in breast cancer and their relationship with angio-and lymphangiogenesis[J].Br J Cancer,2007,96:1092-1100.
[2]Jung HC,Young HO,Yong WP,et al.Correlation of Vascular Endothelial Growth Factor-D Expression and VEGFR-3-Positive Vessel Density with Lymph Node Metastasis in Gastric Carcinoma[J].JKorean Med Sci,2008,23(4):592-597.
[3]Arigami T,Natsugoe S,Uenosono Y,et al.Vascular endothelial growth factor-C and-D expression correlates with lymph node micrometastasis in pNO early gastric cancer[J].JSurg Oncol,2009,99(3):148-153.
[4]Shimizu M,Saitoh Y,Itoh H.Immunohistochemical staining of Ha-ras oncogene product in normal,benign,and malignant human pancreatic tissues[J].Hum Pathol,1990,21(6):607-612.
[5]Weidner N.Intratumor microvessel density as a prognostic factor in cancer[J].Am JPathol,1995,147:9-19.
[6]Makinen T,Jussila L,Veikkola T,et al.Inhibition of lymphangiogenesis with resulting lymphedema in transgenic mice expressing soluble VEGF receptor-3[J].Nat Med,2001,7(2):199-205.
[7]Stefano J,Mandriota,Lotta Jussila,et al.Vascular endothelial growth factor-C-mediated lymphangiogenesis promotes tumour metastasis[J].EMBO J,2001,20(4):672-682.
[8]Tanja Veikkola,Lotta Jussila,Taija Makinen,et al.Signalling viavascular endothelial growth factor receptor-3 is sufficient for lymphangiogenesis in transgenic mice[J].EMBO J,2001,20 (6):1223-1231.
[9]Hung CJ,Ginzinger DG,Zarneger R,et al.Expression of vasclar endothelial growth factor Cin benign and malignant thyrotumors[J].JClin Endocrinol Meta,2003,88(8):3694-3699.
[10]Lucie K,Tanja V,Valentin G,et al.Distinct Roles of Vascular Endothelial Growth Factor-D in Lymphangiogenesis and Metastasis[J].Am JPathol,2007,170(4):1348-1361.
[11]Onogawa S,Kitadai Y,Tanaka S,et al.Expression of VEGF-C and VEGF-D at the invasive edge correlates with lymph node metastasis and prognosis of patients with colorectal carcinoma [J].Cancer Sci,2004,95(1):32-39.
[12]Onogawa S,Kitadai Y,Amioka T,et al.Expression of vascular endothelial growth factor(VEGF)-C and VEGF-D in early gastric carcinoma:correlation with clinicopathological parameters[J].Cancer Lett,2005,226:85-90.
[13]Yancopoulos GD,Davis S,Gale NW,et al.Vascular-specif growth factors and blood vessel formation[J].Nature,2004,07(6801):242-248.
[14]Makinen T,Veikkola T,Mustjoki S,et al.Isolated lymphatic edothelial cells transduce growth,survival and migratory signavia the VEGF-C/D receptor VEGFR-3[J].EMBOJ,2001,(17):4762-4773.
[15]Marconcini L,Marchios,Morbidelli L,et al.c-fos-induced growtfactor/vascular endothelial growth factor D induces angiogenesin vivo and in vitro[J].Proc Natl Acad Sci USA,1999,96(17):9671-9676.
[16]Nathanson SD.Insights into the mechanisms of lymph node metastasis[J].Cancer,2003,98(2):413-423.
[17]Daniel BC,Eric HJ,Ashok KS,et al.Molecular targeted thrapies for pancreatic cancer[J].Am JSurg,2008,196(3):430-441.

