P53在三阴性乳腺癌中的表达及其意义
张雁瑞 黄 犁 姜 辉 高慧军 粱冠男
南方医科大学附属深圳市妇幼保健院病理科,广东深圳 518028
乳腺癌是女性最常见的恶性肿瘤,近年来其发病率逐年上升,且呈年轻化趋势。三阴性乳腺癌(triple negative breast cancer,TNBC)是指雌激素受体(estrogen receptor,ER)、孕激素受体 (progesterone receptor,PR)及人表皮生长因子受体(human epidermal growth factor receptor-2,HER-2)均阴性的乳腺癌。这类乳腺癌有着高侵袭性,患者5年生存率低,复发风险高,预后差。笔者应用免疫组化的方法检测了三阴性乳腺癌中P53的表达以及P53在不同组织学级别乳腺癌中的表达,现报道如下:
1 资料与方法
1.1 一般资料
本研究收集深圳市妇幼保健院病理科2008年1月~2011年12月的三阴性乳腺癌(TNBC)35例,患者均为女性,年龄33~60岁,中位年龄48岁,均经术后病理及免疫组化证实,均未行辅助化疗及放疗。选取非三阴性乳腺癌(NTNBC)35例作对照。TNBC组及NTNBC组病理类型均为浸润性导管癌。
1.2 方法
所有标本均经10%中性福尔马林固定,石蜡包埋,5μm连续切片,HE染色。镜下观察,所有标本均经病理检查证实为乳腺癌,并参照WHO分级标准进行组织学分级,即按组织分化程度(以腺管形成为主要依据)、核异型性及核分裂计数将70例浸润性导管癌分为Ⅰ、Ⅱ、Ⅲ级。免疫组化染色采用SP法。P53蛋白抗体及试剂盒均购自福建迈新公司。以微波修复法进行抗原修复,DAB显色。以已知阳性片为阳性对照,以PBS代替一抗为阴性对照。免疫组化结果判定标准为:P53阳性信号定位在细胞核。
1.3 统计学方法
采用统计学软件SPSS 11.0进行多项分析和比较,计数资料组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 P53在TNBC与NTNBC组织中的表达差异分析
P53在TNBC中的表达明显高于NTNBC,差异有统计学意义(P<0.05)。见表1。

表1 P53在TNBC及NTNBC中的表达[n(%)]
2.2 TNBC及NTNBC组织学分级的差异分析
TNBC的组织学高级别者明显多于NTNBC,差异有高度统计学意义(P<0.01)。见表2。
2.3 P53在不同组织学级别乳腺癌中的表达差异分析
P53在不同组织学级别乳腺癌中的表达差异显著,差异有高度统计学意义(P<0.01)。见表3。

表2 TNBC及NTNBC组织学分级的差异[n(%)]
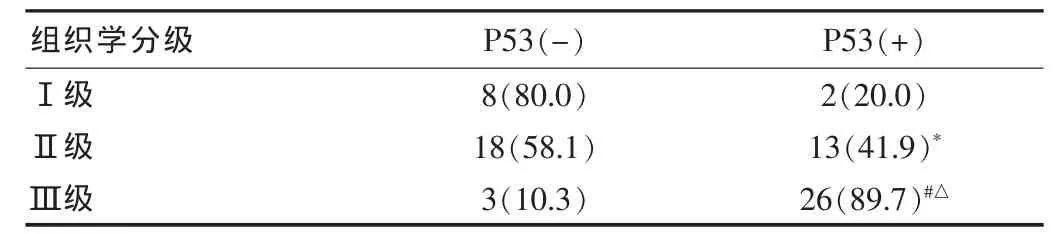
表3 P53在不同组织学级别乳腺癌中的的表达差异[n(%)]
3 讨论
乳腺癌是一类异质性明显的恶性肿瘤,在组织学形态、免疫表型、生物学行为、预后及治疗反应上存在很大差异。近年来,随着ER、PR及HER-2等基因标志物在乳腺癌病理学中的常规应用,一种根据基因表达谱分析的既能反映预后又可指导临床治疗的乳腺癌分子病理分类法形成。根据乳腺癌基因表达的不同,可将乳腺癌分成导管A型、导管B型、Her-2过表达型、基底细胞样型和正常乳腺样型5个亚型,各亚型的病理学特征、生物学行为、临床治疗和预后明显不同[1-3]。TNBC作为其中一类高危乳腺癌,已成为近年来研究的热点。这类乳腺癌主要发生于绝经前的年轻女性,尤其是那些在哺乳期使用抑泌乳药的人群中有较高的发病风险。患者多有乳腺癌家族史及乳腺癌易感基因-1(breast cancer susceptibility gene-1,BRCA-1)突变[4]。TNBC 的组织学类型绝大部分表现为导管癌,还有大汗腺癌、混合性癌、小叶癌及髓样癌等。TNBC相对于非TNBC,肿瘤的组织学分级高,侵袭性强。Tan等[5]研究发现,大多数TNBC组织学分级为三级,并推断TNBC与NTNBC在组织病理学特征方面的差异主要源于组织学级别上的差别。TNBC对内分泌治疗和Herceptin靶向治疗效果欠佳,总体预后差,易复发及转移。
P53基因是迄今发现的与人类肿瘤相关性最高的基因。野生型P53是一种抑癌基因,它定位于17号染色体短臂,在细胞周期的G1期起关键的调控作用,是细胞增殖和分化的重要调控因子,在正常细胞中可以抑制细胞增殖。P53基因发生突变后,失去了对细胞增殖、凋亡及DNA修复等的调控作用,由抑癌基因转变为癌基因,具有促进恶性转化的功能,与被激活的原癌基因起协同作用,导致细胞异常增生,最终形成恶性肿瘤[6]。绝大多数恶性肿瘤和癌前病变中存在P53基因突变。有研究发现,乳腺癌患者中50%~70%有突变型P53蛋白的表达,有家族史的乳腺癌其P53基因突变率高于散发性乳腺癌。P53基因突变是乳腺癌发生发展过程中的早期事件及重要原因。随着肿瘤的进展,P53蛋白表达的阳性率明显升高,患者复发及转移的风险增加,生存期明显缩短。因此,P53的表达可作为判断乳腺癌生物学行为、复发和预后的一项重要指标[7-8]。
本研究结果显示,P53在TNBC组中的表达明显高于NTNBC,提示TNBC细胞具有更强的增殖活性,更易发生转移及复发,预后更差,这与文献报道的结果一致[9]。有研究表明TNBC的组织学分级多为高级别。与其他类型乳腺癌相比,TNBC细胞分化差,组织学1级患者比率较小。本研究结果亦显示TNBC的组织学高级别者明显多于NTNBC。同时,P53在不同组织学分级中的表达率分别为:Ⅰ级20.0%,Ⅱ级41.9%,Ⅲ级89.7%,三组比较差异有高度统计学意义(P<0.01),提示随着组织学分级的增高,P53阳性率越高,也与文献报道的结果一致[10],提示P53可以作为判断乳腺癌细胞分化程度的一项重要指标。
[1]Perou CM,Sorlie T,Eisen MB,et al.Molecular portraits of human breast tumours[J].Nature,2000,406(6797):747-752.
[2]Sorlie T,Tibshirani R,Parker J,et al.Repeated observation of breast tumor subtypes in independent gene expression data sets[J].Proc Natl Acad Sci,2003,100(14):8418-8423.
[3]Nielsen TO,Hsu FD,Jensen K,et al.Immunohistochemical and clinical characterization of thebasal-likesubtypeof invasive breast carcinoma[J].Clin Cancer Res,2004,10(16):5367-5374.
[4]黄玥,卢崇亮.三阴性乳腺癌的研究进展[J].中国现代普通外科进展,2010,13(9):726-729.
[5]Tan DS,MarchióC,Jones RL,et al.Triple negative breast cancer:molecular profiling and prognostic impact in adjuvant anthracycline treated patient[J].Breast Cancer Res Treat,2008,111(1):27-44.
[6]Iwamb P,Crawford L.Characterization of the human p53 gene [J].Mol cell Biol,1986,6(5):1379-1385.
[7]Bidard FC,Matthieu MC,Chollet P,et al.p53 status and efficacy of primary anthracyclines/alkylating agent-based regimen according to breast cancer molecular classes [J].Ann Oncol,2008,19 (7):1261-1265.
[8]Menezes MV,Cestari AL,Almeida O,et al.Protein expression of Cerb-2 and p53 in normal ducts,ductal carcinoma in situ and invasive carcinoma of the same breast[J].Sao Paulo Med J,2006,124(3):121-124.
[9]Rakha EA,Sayed ME,Green AR,et al.Prognostic markers in triplenegative breast cancer[J].Cancer,2007,109(1):25-32.
[10]吴祥德,董守义.乳腺疾病诊治[M].2版.北京:人民卫生出版社,2009:214-215.

