高压氧对脑损伤大鼠BDNF表达的影响
张 禹 潘树义 李 航 杨 晨 潘晓雯
海军总医院高压氧科,北京 100048
脑源性神经生长因子(BDNF)是一种小分子二聚体蛋白质,在结构上与神经生长因子相关,主要由脑组织合成,在脑内主要分布在大脑和海马,对中枢神经系统的多种类型神经元的生长、发育、分化、维护和再生都具有显著作用[1]。创伤性颅脑损伤(TBI)致死率、致残率高,治疗方法有限,近年来国内临床医生逐步开始应用高压氧(HBO)治疗TBI患者,并取得了一定疗效,但其治疗机制尚未完全明确。本实验研究了HBO对侧位液压冲击脑损伤大鼠脑内皮层及海马区BNDF表达的影响,进一步阐明HBO在增强脑内BDNF表达方面的机制,并对脑创伤后开始HBO治疗的时间及疗程进行初步探讨,为临床更好地应用HBO治疗TBI提供理论依据。
1 材料与方法
1.1 试剂和仪器
BDNF兔抗鼠多克隆抗体,购自武汉博士德生物技术有限公司;HPD-1700型液压撞击仪及TDS1002数字存储示波器,由美国DRAGONFLY研究与发展公司生产;DWC150-300型透明纯氧动物实验舱,由上海701所杨园医用氧舱厂制造;韩国生产微型牙科磨钻;医用液态纯氧由北京普莱克斯实用气体有限公司提供。
1.2 动物模型的建立
1.3 实验方法
将脑损伤组及正常对照组大鼠各组内再随机分成两组,即高压氧组和常压对照组,每组8只。脑创伤高压氧组及高压氧对照组于造模后24 h进行HBO治疗,具体方法为将氧
健康雄性 Wistar大鼠 32 只,体质量(250±10)g,由军事医学科学院实验动物中心提供,批号为SCXK-(军)2007-004。将大鼠随机分为脑损伤组和正常对照组,每组16只。脑损伤组大鼠采用液压冲击硬脑膜的方式建立模型。麻醉方法为经腹腔注射10%水合氯醛(剂量0.3 mL/100 g),3 min后将大鼠俯卧位四肢固定,剪去头部鼠毛局部消毒,切开左颅顶皮肤分层剥离软组织,止血钳固定后充分暴露颅骨,用微型牙科磨钻行颅骨钻孔至硬脑膜,孔径2 mm,位于冠状缝和矢状缝左下3 mm处,暴露硬脑膜并保持完整。调试液压撞击仪的重锤高度,将液压冲击力度调整为0.3 mPa,即TDS1002示波器上显示为波峰为1.5 V的正弦波,液压冲击管连接大鼠钻孔处,连续3次液压冲击硬脑膜,造成重型闭合性颅脑损伤。完成后缝合皮肤,待麻醉复苏后放置笼中饲养。正常对照组不进行任何处理。气瓶连接动物舱,将大鼠置于舱内,关闭舱门,常压下打开进气阀及排气阀,使用纯氧洗舱5min后开始纯氧加压,加压时间5 min,加至 2.5 ATA(1 ATA=0.1 mPa)开始稳压吸氧 45 min,稳压时维持氧流量在1 L/min,保持舱内氧浓度在95%,减压时间10 min。连续HBO治疗5 d,每日1次。脑损伤常压空气组及常压空气对照组大鼠于常压室内笼中饲养。
1.4 BDNF免疫组化检测
各组大鼠在完成HBO治疗后,用10%水合氯醛麻醉,4%多聚甲醛心脏灌注固定。断头取脑,于损伤处冠状切取脑组织块,对照组大鼠同样位置切取。常规脱水、石蜡包埋、切片(厚度5μm),行常规HE染色。采用常规SP法组织化学染色,脱蜡,水化组织切片,滴加BDNF多克隆抗体(1∶200),PBS溶液冲洗2 min×3次,滴加聚合物辅助剂,DAB溶液显色,蒸馏水冲洗,复染,脱水,封片。光镜下胞浆或胞核有棕黄色颗粒者为阳性细胞,分别于皮层区及海马区计数阳性细胞数,光镜下(×200)随机选择 5个视野,取平均值,以“个/视野”来表示。
1.5 统计学方法
采用SPSS 12.0统计软件包进行统计学分析,计量资料以均数±标准差(x±s)表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠脑表面挫裂伤情况及损伤脑组织HE染色
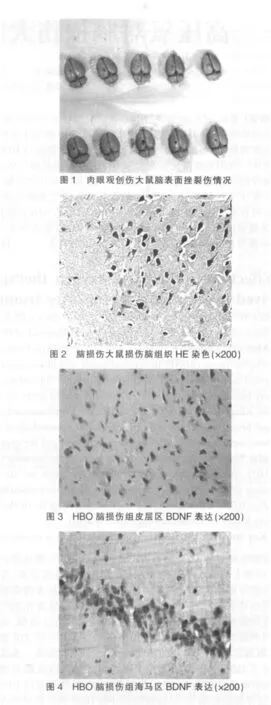
肉眼观脑创伤组大鼠脑表面沟回积血,局部硬膜下出血、脑实质出血及脑挫裂伤。HE染色后,光镜下正常对照组大鼠大脑皮层及海马区各部位结构及细胞层次清楚,细胞形态结构清晰完整,核膜完整,核仁清楚;脑损伤组皮层区及海马组织结构不清,细胞肿胀,核膜、核仁不清,部分变性坏死细胞皱缩变圆,与邻近细胞脱离接触,核固缩变圆,胞浆深染(图 1、2)。
2.2 免疫组织化学染色
光镜下BDNF免疫阳性细胞表现为神经元胞浆内呈现广泛分布的棕黄色小颗粒,胞核部分棕黄色着色(图3、4)。大脑皮层区BDNF免疫阳性细胞数见表1,海马区BDNF免疫阳性细胞数见表2。
3 讨论
BDNF是一种具有防止神经元死亡功能的蛋白质,主要由脑组织合成,在脑内主要分布在海马和皮层区域。在脑损伤后可以为受损神经元提供营养,促进其存活和修复,并直接促进轴突的生长;BDNF通过与其特异的功能受体TrkB的相互结合和作用,阻断胞内损伤因子对蛋白激酶C的失活,以防止神经元发生变性、坏死;还可通过影响转录因子结合DNA的活性来保护受损神经元免受氧化应激的进一步损害;BDNF可提高中枢神经系统对抗兴奋性氨基酸毒性损伤的能力,防止脑损伤后谷氨酸持续释放而引起的钙超载,稳定细胞内环境,从而在神经系统的损伤、修复方面发挥着重要的作用[2-4]。但外源性BDNF不易透过血脑屏障,静脉注射对损伤脑组织无明显保护作用,因此,提高内源性BDNF的表达对脑损伤后促进神经元修复尤为重要。
脑损伤后维持神经细胞正常代谢所必需的微血管系统也同样遭到破坏,难以保证组织得到有效氧供。HBO治疗可迅速提高机体肺泡气中的氧分压,从而提高血氧含量,使氧在组织的中弥散半径增大,容易弥散到深部受损脑组织,利于神经细胞的修复。近年来临床应用HBO治疗TBI患者逐步增多,目前研究发现的HBO脑保护机制主要包括:①改善脑血流,降低颅内压,减轻脑水肿。HBO通过高分压氧刺激血管平滑肌收缩,血管内皮细胞产生NO减少,减少脑组织的CO2,可以使颈动脉系统的血管收缩,阻力增加,脑血流量减少,达到降低颅内压减轻脑水肿的作用。同时HBO可促进椎-基底动脉系统血流量增加,在2.0 ATA环境下吸纯氧即可使椎动脉血流量增加18%。②纠正细胞内酸中毒,减轻钙超载。由于氧供改善,神经细胞内糖的无氧酵解终止,有机酸产生停止,蓄积的有机酸重新进入三羧酸循环继续氧化,从而纠正细胞内酸中毒。HBO可以改善细胞生物膜通透性,Ca2+泵启动,将胞浆内多余的Ca2+转运到细胞外和肌浆网,肌浆网摄取、储存Ca2+恢复,使细胞内钙超载改善。③可抑制趋化因子、黏附因子、细胞因子的表达,减少TXA2等活性物质的生成,减轻炎性损伤。④阻止神经细胞过度凋亡。HBO可减轻细胞内钙超载,改善线粒体膜通透性,恢复线粒体跨膜电位,还可通过多方面调节凋亡相关基因,可抑制脑神经元细胞凋亡,保护脑神经细胞,有利于促进神经功能恢复[5-9]。但这些理论还不能完全阐明HBO的治疗机制。

表1 大脑皮层区BDNF免疫阳性细胞数(x±s,个/视野,n=16)

表2 海马区BDNF免疫阳性细胞数(x±s,个/视野,n=16)
本研究发现,脑损伤HBO组皮层及海马BDNF免疫阳性细胞数量均多于脑损伤常压空气组及正常对照组,提示HBO治疗可通过促进脑内BDNF的生成从而促进脑损伤后肢体运动功能、学习和记忆能力的恢复。研究还发现HBO对正常大鼠皮层及海马BDNF的表达无增强作用,脑损伤后大鼠的BDNF表达有一定增强,但作用有限。脑损伤急性期脑内去甲肾上腺素、多巴胺、5-羟色胺释放增加,可激活脑内cAMP依赖的蛋白激酶。BDNF的表达受控于cAMP反应元件结合蛋白(CREB),BDNF基因含有CRE序列,是CREB的靶基因,从而促进BDNF的表达,随着5-羟色胺等分泌的减少其表达也逐步减弱。HBO治疗脑损伤时脑内有氧代谢旺盛,ATP生成增加,加之交感神经兴奋,刺激β-肾上腺素能受体,激活腺苷环化酶,使细胞内ATP形成更多的cAMP,CREB与BDNF基因CRE序列的结合增加,增强了BNDF基因的转录,从而上调脑损伤大鼠皮层及海马的BDNF表达[10]。有文献报道,脑外伤后24 h内大鼠脑内BDNF表达阳性细胞数达到高峰,之后逐渐减少,提示创伤后的自我保护机制逐步下降[11]。在不同时间脑室内注射BDNF,对大鼠局灶性脑缺血损伤有不同程度的保护作用,时间越早保护作用越明显,此作用可能与BDNF能够增加体内SOD的活性并抑制脑缺血再灌注后神经细胞凋亡等因素有关[12]。本研究HBO治疗开始时间为创伤后24 h,连续治疗5 d,通过早期HBO来促进脑内BNDF的生成,从而弥补创伤应激后脑内BDNF表达持续时间较短的不足,起到脑保护作用,为临床治疗方案的选择提供思路。
[1]Mitchell JJ,Paiva M,Walker DW,et al.BDNF and NGF afford in vitro neuroprotection against ethanol combined with acute ischemia and chronic hypoglycemia[J].Dev Neurosci, 1999,21(1):68-75.
[2]Skaper SD,Floreani M,Negro A,et al.Neurotrophins rescue cerebellar granule neurons from oxidative stress-mediated apoptotic death:selective involvement of plosphatidylinositol 3-kinase and the mitogen activated protein kinase pathway [J].JNeurochemistry, 1998,70:1859-1868.
[3]周晖,毛萌.脑源性神经营养因子对缺氧胚鼠脑皮质神经元的保护作用[J].华西医大学报, 2002,33(4):573-576.
[4]Hu Y,Russek SJ.BDNF and the diseased nervous system:a delicate balancebetweenadaptiveand pathological processesof generegulation[J].JNeurochem, 2008, 105(1):1-17.
[5]Wada K,Miyazawa T,Nomura N,et al.Preferential conditions for and possible mechanisms of induction in gerbil hippocampus [J].Neurosurgery,2001,49(1): 160-166.
[6]谭国军,赵晓云,曹翠云,等.高压氧逆转缺氧缺血性脑病大鼠脑细胞凋亡的作用及其机制的研究[J].中国神经精神疾病杂志,2003,29(5):388.
[7]赵红,陈航,曹士信.高压氧对缺血再灌注小鼠脑组织中细胞因子IL-1β、IL-8 及血脑屏障通透性的影响[J].中国医科大学学报,2008,37(6):373.
[8]Yin D,Zhou C,Kusaka I,et al.Inhibition of apoptosis by hyperbaric oxygen in rat cerebral ischemic model[J].J Cereb Blood Flow Metab,2003,23(7):855-864.
[9]李金声,郭守一,刘立,等.原癌基因在大鼠急性局灶性脑缺血再灌注损伤和高压氧治疗后表达的变化[J].中华航海医学杂志,2000,7(3):161-163.
[10]Russoneustadt AA,Beard RC,Huang YM,et al.Physical activity and antidepressant treatment potentiate the expression of specific brainderived neurotrophic factor transcripts in the rat hippocampus[J].Neuroscience,2000,101(2):305-312.
[11]王敏,邓世雄.大鼠脑外伤后BDNF的表达及其死后稳定性的研究[J].重庆医科大学学报,2009,34(11):1521-1523.
[12]谭永星,李雪梅,文素芳,等.不同时间脑室注射BDNF对大鼠脑缺血再灌注损伤氧化应激及神经细胞凋亡的影响[J].第四军医大学学报,2009,30(18):1681-1684.

