浙江镇海潮间带沉积物中可培养微生物初步研究
郑 莹,霍颖异
(1.中国大洋矿产资源研究开发协会,北京 100080;2.国家海洋局 第二海洋研究所,国家海洋局 海洋生态系统与生物地球化学重点实验室,浙江 杭州 310012)
0 引言
浙江省海域面积26万km2且海岛众多,海岸线全长6 486km,居全国首位[1]。浙江省海域属于亚热带、温带气候,利于海洋生物的繁殖和生长,是生产力较高的海域,其独特的海洋环境蕴藏着丰富的海洋微生物资源。然而目前关于浙江沿海沉积物微生物多样性的报道还较少。2008年,霍颖异 等[2]采用可培养和非培养相结合的方法调查了浙江苍南近海沉积物的细菌多样性;其他还有些相关研究报道多采用平板计数或生理生化鉴定的调查方法[3-4],未能真实反映样品中微生物的分类地位和多样性。
本研究采用纯培养方法和基于16SrRNA基因序列,调查和分析浙江省镇海潮间带沉积物的可培养细菌群落组成,不但丰富了近海海洋细菌种质资源,初步探讨了海洋细菌群落在生态系统中作用,对近海细菌资源开发也具有一定的指导意义。
1 材料和方法
1.1 样品采集
2008年6月,对浙江省镇海潮间带沉积物插管取样,将柱状沉积物样品进行1cm间隔分层分装,短期4℃阴暗保存,运抵实验室后即开展相关工作。本文采用表层0~1cm层沉积物开展研究。
1.2 菌株的分离与保藏
采用2216寡营养培养基分离并纯化海洋细菌。2216寡营养培养基配方为(L-1):NaCl 19.45g,MgCl2·6H2O 12.6g,MgSO4·7H2O 6.64g,CaCl21.8g,KCl 0.55g,NaHCO30.16g,KBr 0.08g,SrCl2·6H2O 0.057g,H3BO30.022g,Na2SiO3·9H2O 0.093g,NaF 0.002 4g,NH4NO30.002 4g,Na2HPO40.008g,蛋白胨0.5g,酵母抽提物0.1g;用5mol·L-1NaOH将pH值调至7.2。固体培养基另加20g/L琼脂粉。
取沉积物样品约0.5g,放入3mL培养基盐溶液中。振荡15min后,使其自然沉降,取上清液10倍梯度稀释,将102、103和104倍稀释的溶液涂布于平板。每个梯度涂布3块平板,分别置于25℃和37℃培养。待长出明显菌落后,挑取单菌落并反复划线纯化菌株。菌株培养液中加入20%(v/v)的甘油混匀,保藏于-80℃。
1.3 PCR扩增16SrRNA基因序列
取1mL对数生长期的菌液,以12 000r/min离心1min获得菌体,并加入200μL无菌水悬浮菌体。放置沸水浴30min,破细胞后,冰浴2min,以12 000r/min离心2min并取上清液为PCR模板。PCR扩 增 引 物 为 27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和 1492R (5’-GGTTACCTTGTTACGACTT-3’)。50μL反应体系为 H2O 41μL,10×PCR buffer 5μL,dNTP 0.5μL,引 物 27F 1μL,引物1492R1μL,模板DNA(50ng/μL)1μL,Taq酶(TaKaRa)0.5μL。PCR反应程序为:94℃预变性5min;94℃变性45s,55℃退火45s,72℃延伸90s,30个循环;72℃延伸10min。用1%(w/v)的琼脂糖凝胶电泳检测产物后,送至深圳华大基因研究院测序。
1.4 16SrRNA基因序列分析
将获得的16SrRNA基因序列通过EzTaxone[5](http://eztaxon-e.ezbiocloud.net/)在线服务进行比对,获取相似度较高的近缘物种菌株信息及序列。采用MEGA 5[6]软件中Clustal W程序进行多序列匹配排列,并基于Neighbor-Joining算法构建系统发育树。
2 结果
在25℃和37℃下培养后,细菌在2216寡营养培养基上的菌落形态表现为直径0.3~0.5mm的圆形或不规则圆形菌落,表面平整、隆起或呈脐状突起,颜色呈透明、白色、黄色、红色和橙色等。根据菌落形态特征筛选菌株并分离纯化,共获得39株细菌。
16SrRNA基因序列分子鉴定结果(表1)表明,这些菌株分别属于厚壁菌门Firmicutes(20株,51.3%)、变形杆菌门Proteobacteria(12株,30.8%)、拟杆菌门 Bacteroidetes(6株,15.4%)和放线菌门Actinobacteria(1株,2.6%)4个类群。厚壁菌门的菌株归属于芽孢杆菌属Bacillus、鸟氨酸芽孢杆菌属Ornithinibacillus和海洋芽孢杆菌属Thalassobacillus;变形杆菌门的菌株归属于α-变形杆菌纲Alphaproteobacteria的红环菌属Roseicyclus、红细菌属Rhodobacter、赤杆菌属Erythrobacter、简纳西氏菌属Jannaschia和鲁杰氏菌属Ruegeria以及γ-变形杆菌纲Gammaproteobacteria的不动杆菌属Acinetobacter和假单胞菌属Pseudomonas;拟杆菌门的菌株归属于嗜冷菌属Algoriphagus和黄杆菌科Flavobacteriaceae;而放线菌门的菌株归属于戈登氏菌属Gordonia。
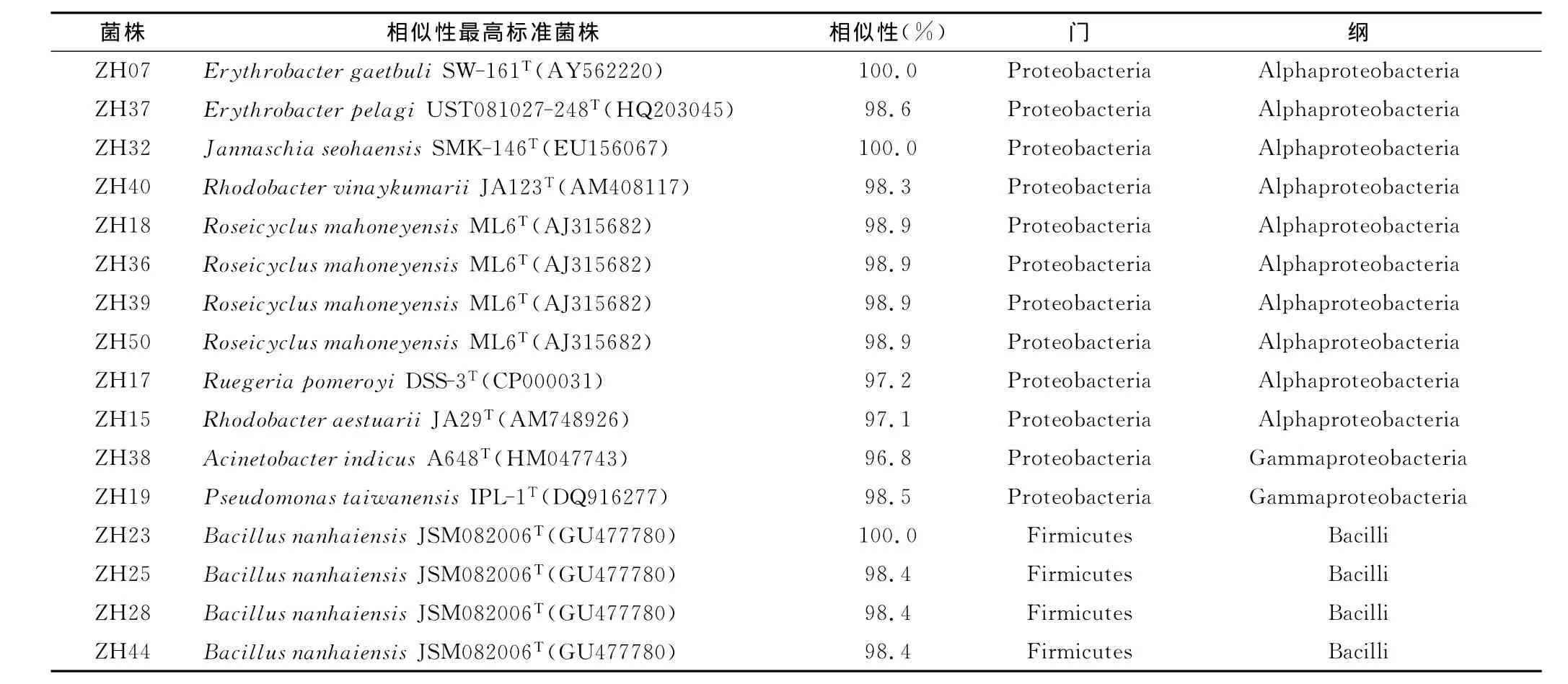
表1 镇海潮间带沉积物分离细菌16SrRNA基因序列同源性比较结果Tab.1 Homology comparison of 16SrRNA gene sequences of the bacteria isolated from the tidal flat sediment of Zhenhai

续表1
分离菌株16SrRNA基因序列的系统发育分析(图1)及同源性比较结果(表1)表明,菌株与相关已知物种标准菌株的16SrRNA基因序列相似性为93.6%~100.0%,说明部分菌株与其系统发育关系密切的相关菌株之间存在一定的遗传差异。研究发现一些菌株与已报道标准菌株间的相似度较低,如菌株ZH09与RobiginitaleabiformataHTCC2501T(93.6%)、ZH15 与RhodobacteraestuariiJA29T(97.1%)、ZH17 与RuegeriapomeroyiDSS-3T(97.2%)、ZH38 与AcinetobacterindicusA648T(96.8%),它们可能代表了一些新的分类单元。特别是菌株ZH09与已报道标准菌株的16SrRNA基因序列相似性皆小于94%,可能代表了一个新属。目前,针对这些特色菌株的新种鉴定工作正在进行,其中,已经以菌株ZH17为标准菌株建立了Ruegeria属的一个新种Ruegeriamarina[7]。
3 讨论
本研究针对采集自浙江镇海潮间带的沉积物样品,采用纯培养方法以及基于16SrRNA基因序列的分析,分离并鉴定了39株海洋细菌。分析结果表明,芽孢杆菌为镇海潮间带沉积物中可培养细菌的优势类群,占菌株总数的46.2%。芽孢杆菌为异养细菌,它们的大量出现表明该海域环境中有机质营养较为丰富。而芽孢杆菌的优势种群地位在其他近岸沉积物研究中亦有报道,如孙风芹 等[8]对南海南沙海域沉积物中可培养微生物的研究发现,在22个研究站点中,10个站点的分离菌株半数以上为芽孢杆菌;GONTANG et al[9]对西太平洋群岛沉积物的可培养微生物的研究表明,芽孢杆菌是一类可培养优势类群,占分离菌株总数的34.4%。且本研究中75%(20株中的15株)的芽孢杆菌菌株与陆源细菌而非海洋来源细菌有较近的系统进化关系(图1),说明这些近海海域的微生物可能来源于陆地。值得注意的是,菌株ZH04和ZH55与砷耐受菌株BacillusindicusSd/3T[10]的相似性为99.9%;菌株 ZH41和 ZH43与BacillussubterraneusDSM 13966T的相似性为99.7%,该菌株可还原 Fe(III)和 Mn(IV)[11];菌株ZH56与Bacillusthioparans的相似性最高,该种内菌株U3可氧化 Mn(II)并吸附Cd、Zn、Cu和Pb等重金属[12-13]。发现这些与重金属氧化还原和吸附相关的菌株,从某种程度上反映了近年来重金属废水大量排放导致的沿海海域重金属污染,也说明了陆地人类活动对近海海域生态环境的影响。这些菌株可能可以在日后应用于重金属污染的土壤修复和废水处理。
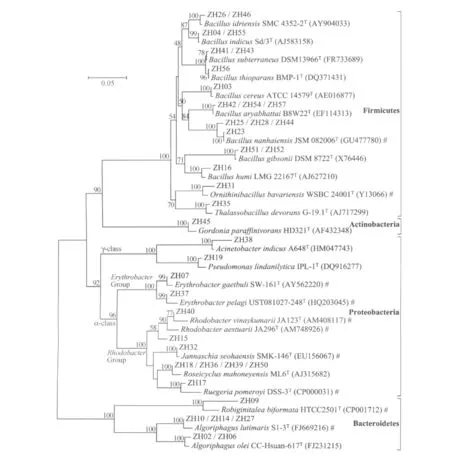
图1 镇海潮间带沉积物可培养细菌16SrRNA基因序列系统发育树Fig.1 Phylogenetic tree of 16SrRNA gene sequences of strains from the tidal flat sediment of Zhenhai
α-变形杆菌为该样品中可培养细菌的第二大优势类群,占菌株总数的25.6%,其中又以Roseobacter类群菌株为主,包括 ZH40、ZH15、ZH32、ZH18、ZH36、ZH39、ZH50和ZH17八个菌株。Roseobacter类群细菌是海洋浮游微生物中含量最为丰富的类群之一,有研究显示,大洋的表层海水中,十分之一的细菌细胞属于Roseobacter类群,而在近海海水中,该类群的比例达到五分之一[14-15]。Roseobacter类群为变形杆菌门Proteobacteriaα-变形杆菌纲 Alphaproteobacteria红杆菌目Rhodobacterales红杆菌科Rhodobacteraceae中的一些海洋浮游细菌,包括玫瑰杆菌属Roseobacter、鲁杰氏菌属Ruegeria、简纳西氏菌属Jannaschia、红环菌属Roseicyclus、柠檬胞菌属Citreicella、暗棕色杆菌属Phaeobacter、玫瑰变色菌属Roseovarius和亚硫酸盐杆菌属Sulfitobacter等17个属的40余个种。Roseobacter类群细菌因其多样的生理特征,被称为“生态泛化者”[16-18],它们在海洋沿岸生态系统的碳和硫循环中发挥着重要作用。比如,菌株ZH17与无机异养菌RuegeriapomeroyiDSS-3T有最近的系统发育关系,两者16SrRNA基因序列相似性为97.2%。菌株DSS-3T可利用一氧化碳和硫化物等无机物作为能量来源,从而减少对有机碳的消耗[17]。菌株ZH15、ZH40和以ZH18为代表的4个菌株(ZH18、ZH36、ZH39和ZH50)与紫色非硫光合细菌(Purple Non-sulfur Bacteria,PNSB)RhodobacteraestuariiJA29T[19]、RhodobactervinaykumariiJA123T[20]和RoseicyclusmahoneyensisML6T[21]有最近的 系 统发育关 系,16SrRNA 基因序列相似性分别为97.1%、98.3%和98.9%。而PNSB是一类好氧不产氧光合细菌(Aerobic Anoxygenic Phototrophic Bacteria,AAPB),因其代谢类型多样而具有重要的生态学意义和应用价值。PNSB具有光合、固氮、固碳、硝化、反硝化、产氢、硫化物氧化、降解大分子有机物等多种生理特征,且其富含蛋白质、氨基酸等多种营养物质,因此PNSB可应用于水产养殖、污水处理、能源开发、生产多聚羟基烷酸(PHA)等方面[22]。
4 小结
通过对镇海潮间带沉积物可培养细菌多样性的研究表明,浙江近海沉积物中蕴藏着丰富的微生物资源,而且它们在近海的元素地球化学循环中发挥着重要作用。然而,限于培养条件等因素,本研究获得的菌株还只是浙江近海微生物资源的很小一部分。未来可通过分子生态分析以及优化培养条件的手段,获得更全面的浙江近海微生物资源和多样性信息。
(References):
[1]Zhejiang Province Statistical Bureau.Current situation and problems of maritime economic development for Zhejiang province[J].China National Conditions and Strength,2007,5:63-64.
浙江省统计局.浙江海洋经济发展现状及问题[J].中国国情国力,2007,5:63-64.
[2]HUO Yi-ying,XU Xue-wei,WANG Chun-sheng,et al.Bacterial diversity of the sediment from Cangnan Large Fishing Bay[J].Acta Ecologica Sinica,2008,28(10):5 166-5 172.
霍颖异,许学伟,王春生,等.浙江苍南近海沉积物细菌物种多样性[J].生态学报,2008,28(10):5 166-5 172.
[3]DU Ai-fang.Bacterial analysis in the water samples from the seacoast of Zhejiang Province[J].Jounal of Zhejiang University:Agric & Life Sci,2003,29(5):523-528.
杜爱芳.浙江近岸海域细菌学分析[J].浙江大学学报:农业与生命科学版,2003,29(5):523-528.
[4]HUANG Bei,MIN Huai,TANG Jing-liang,et al.Study of the microorganism community in Zhejiang offshore[J].Environmental Monitoring in China,2009,25(2):44-47.
黄备,闵怀,唐静亮,等.浙江沿海海洋微生物群落的研究[J].中国环境监测,2009,25(2):44-47.
[5]CHUN J,LEE J H,JUNG Y,et al.EzTaxon:a web-based tool for the identification of prokaryotes based on 16Sribosomal RNA gene sequences[J].International Journal of Systematic and Evolutionary Microbiology,2007,57(10):2 259-2 261.
[6]TAMURA K,PETERSON D,PETERSON N,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary sistance,and maximum parsimony methods[J].Molecular Biology and Evolution,2011,28(10):2 731-2 739.
[7]HUO Ying-Yi,XU Xue-wei,LI Xue,et al.Ruegeriamarinasp.nov.,isolated from marine sediment[J].International Journal of Systematic and Evolutionary Microbiology,2011,61(2):347-350.
[8]SUN Feng-qin,WANG Bao-jiang,LI Guang-yu,et al.Diversity of bacteria isolated from the South China Sea sediments[J].Acta Microbiologica Sinica,2008,48(12):1 578-1 587.
孙风芹,汪保江,李光玉,等.南海南沙海域沉积物中可培养微生物及其多样性分析[J].微生物学报,2008,48(12):1 578-1 587.
[9]GONTANG E A,FENICAL W,JENSEN P R.Phylogenetic diversity of Gram-positive bacteria cultured from marine sediments[J].Applied and Environmental Microbiology,2007,73(10):3 272-3 282.
[10]SURESH K,PRABAGARAN S R,SENGUPTA S,et al.Bacillusindicussp.nov.,an arsenic-resistant bacterium isolated from an aquifer in West Bengal,India[J].International Journal of Systematic and Evolutionary Microbiology,2004,54(4):1 369-1 375.
[11]KANSO S,GREENE A C,PATEL B K C.Bacillussubterraneussp.nov.,an iron-and manganese-reducing bacterium from a deep subsurface Australian thermal aquifer[J].International Journal of Systematic and Evolutionary Microbiology,2002,52(3):869-874.
[12]GREEN-RUIZ C,RODRÍGUEZ-TIRADO V,GÓMEZ-GIL B.Cadmium and zinc removal from aqueous solutions byBacillus jeotgali:pH,salinity and temperature effects[J].Bioresource Technology,2008,99(9):3 864-3 870.
[13]RODRÍGUEZ-TIRADO V,GREEN-RUIZ C,GÓMEZ-GIL B.Cu and Pb biosorption onBacillusthioparansstrain U3in aqueous solution:Kinetic and equilibrium studies[J].Chemical Engineering Journal,2012,181-182:352-359.
[14]DELONG E F.Microbial community genomics in the ocean[J].Nature Reviews Microbiology,2005,3(6):459-469.
[15]GONZÁLEZ J M,MORAN M A.Numerical dominance of a group of marine bacteria in the alpha-subclass of the class Proteobacteria in coastal seawater[J].Applied and Environmental Microbiology,1997,63(11):4 237-4 242.
[16]MORAN M A,BELAS R,SCHELL M A,et al.Ecological genomics of marine Roseobacters[J].Applied and Environmental Microbiology,2007,73(14):4 559-4 569.
[17]MORAN M A,BUCHAN A,GONZÁLEZ J M,et al.Genome sequence ofSilicibacterpomeroyireveals adaptations to the marine environment[J].Nature,2004,432(7 019):910-913.
[18]POLZ M F,HUNT D E,PREHEIM S P,et al.Patterns and mechanisms of genetic and phenotypic differentiation in marine microbes[J].Philosophical Transactions of the Royal Society B:Biological Sciences,2006,361(1 475):2 009-2 021.
[19]VENKATA RAMANA V,ANIL KUMAR P,SRINIVAS T N R,et al.Rhodobacteraestuariisp.nov.,aphototrophic alphaproteobacterium isolated from an estuarine environment[J].International Journal of Systematic and Evolutionary Microbiology,2009,59(5):1 133-1 136.
[20]SRINIVAS T N R,ANIL KUMAR P,SASIKALA C,et al.Rhodobactervinaykumariisp.nov.,a marine phototrophic alphaproteobacterium from tidal waters,and emended description of the genusRhodobacter[J].International Journal of Systematic and Evolutionary Microbiology,2007,57(9):1 984-1 987.
[21]RATHGEBER C,YURKOVA N,STACKEBRANDT E,et al.Roseicyclusmahoneyensisgen.nov.,sp.nov.,an aerobic phototrophic bacterium isolated from a meromictic lake[J].International Journal of Systematic and Evolutionary Microbiology,2005,55(4):1 597-1 603.
[22]IMHOFF J.The phototrophic Alpha-Proteobacteria[M]//DWORKIN M,FALKOW S,ROSENBERG EUGENE,et al.The Prokaryotes.New York:Springer,2006:41-64.

