中肋骨条藻蛋白质双向电泳样品制备方法的比较
王秀秀,陈纪新,黄邦钦
(福建省陆海界面生态环境重点实验室,厦门大学 环境与生态学院,福建 厦门 361005)
0 引言
随着藻类全基因组测序物种的增多,赤潮藻蛋白质组学的发展也更加蓬勃[1-2]。蛋白质双向电泳样品提取方法是蛋白质组学研究的重要内容之一,但由于不同藻类细胞内生化组成的差别较大,故已经广泛应用的植物蛋白提取方法并不适用于藻类[3-4],而目前尚没有一种通用的藻类蛋白提取方法,针对于每一种藻的蛋白提取方法都需优化[5]。蛋白的提取是蛋白质组学的关键步骤,但在不同的物种中的蛋白提取最适方法差异很大,如铜绿微囊藻Microcystisaeruginosa的最适提取条件为Triton X-100提取法[6],亚历山大藻Alexandriumsp.的最适提取法为Triton X-100-尿素提取法[7],无菌塔玛亚历山大藻Alexandriumtamarense的最适藻类蛋白提取条件为裂解液法[8]。CHAN et al[9]认为,直接 TCA-丙酮沉淀法的效果与Tris缓冲液提取法的效果相当,但都比裂解液提取法的效果要好。原雅纬 等[8]则认为,裂解液结合TCA-丙酮沉淀法比直接TCA-丙酮沉淀法提取蛋白得到的双向电泳图谱要好。
中肋骨条藻Skeletonemacostatum是一种世界性的在沿海和海洋水域起着重要生态作用的物种,它能支持较高初级生产力,是我国长江口赤潮高发区的常见肇事种[10-12],但这一物种的双向电泳样品制备方法目前尚未见报道。裂解液法和直接三氯乙酸(TCA)-丙酮沉淀法是广泛使用的藻细胞蛋白提取方法,本文比较了这两种方法提取中肋骨条藻的双向电泳结果,并优化了这一物种的蛋白制备最适条件,为后续的进一步研究提供科学依据。
1 藻种的培养及收集
实验所用的中肋骨条藻S.costatum由厦门大学近海海洋环境科学国家重点实验室海洋微型生物保种中心提供,分离自长江口赤潮高发区,经18SrDNA鉴定为中肋骨条藻。培养基为f/2培养基,实验所用的海水为南海海盆区海水,将盐度调整为28后使用。培养温度为(20±1)℃,光照强度为5 000lx,光暗周期为14∶10(光∶暗)。当生长达到对数期后,在Beckman高速冷冻离心机中离心收集,条件为8 000 r/min,4℃,离心时间为20min。藻细胞沉淀后用经高温、高压灭菌的海水洗涤并重悬沉淀,按照相同的细胞数分装在4个离心管中,再次离心收集(条件同上)。藻细胞沉淀后立即用于提取蛋白。
2 蛋白的提取方法及双向电泳实验方法
众多藻类蛋白提取方法中裂解液法和直接三氯乙酸(TCA)-丙酮沉淀法是目前最广为使用的方法。由于不同藻类最适提取方法的差异性,本文实验中着重比较了裂解液法和直接TCA-丙酮沉淀法提取中肋骨条藻蛋白的效果。
2.1 裂解液法
裂解液法是双向电泳蛋白制备中的常用方法,是根据不同原理去除藻类细胞内干扰物,提取藻类全细胞蛋白的一种方法,其中主要有裂解液-超滤管法(Lysis buffer & microcon法,LM 法)、裂解液-试剂盒法(Lysis buffer &2-D clean-up kit法,L-Kit)和裂解液-TCA-丙酮沉淀法(Lysis buffer & TCA-acetone法,LAC)。裂解液-超滤管法是根据超滤管基于分子量来截留蛋白质的原理,利用离心强行使水和其他小分子的盐类、核酸、多酚、多糖类物质通过半透膜将蛋白质截留在半透膜上的方法。裂解液-试剂盒法是使用GE Healthcare公司研发的杂质去除试剂盒(即2-D clean-up kit)去除胞内杂质的方法,该试剂盒使用去污剂和共沉淀剂酸性沉淀蛋白,对酸性端蛋白和碱性端蛋白都有较好的富集作用[13-14]。裂解液-TCA-丙酮沉淀法是根据TCA在酸性条件下与蛋白形成不溶性盐、并作为蛋白质变性剂使蛋白质构象发生变化,使之聚集沉淀的原理富集蛋白质[15]。
按照CHAN et al[9]的超速离心方法操作,超声波破碎缓冲液为0.5mL裂解液。裂解液配方为:浓度为7mol/L的尿素(Bio-Rad公司生产),浓度为2mol/L的硫脲(Bio-Rad公司生产),质量分数为4%的3-[3-(胆 酰 胺 丙 基 )二 甲 氨 基 ]丙 磺 酸 内 盐(CHAPS,Fluka公司生产),浓度为40mmol/L 的Tris,pH值为8.7。使用超声细胞破碎仪(型号为Branson Sonifier S-450D),冰浴超声波破碎藻细胞,直到镜检99%的藻细胞均没有细胞结构后停止。在Beckman高速冷冻离心机中,4℃条件下,12 000r/min离心20min,取上清液。将上清液加入到3KD超滤管(GE Healthcare公司生产)里层套管中,按照超滤管说明书操作制备蛋白样品,保存在-80℃冰箱中备用。
2.1.2 L-Kit法
缓冲液和超声波条件与LM法相同,冰浴超声波破碎藻细胞后离心取上清液。将上清液按照双向电泳去除试剂盒(2-D clean-up kit,GE Healthcare公司生产)的说明书操作制备蛋白样品,沉淀保存在-80℃冰箱中备用。
2.1.3 LAC 法
缓冲液和超声波条件与LM法相同,冰浴超声波破碎藻细胞后离心取上清液。在上清液中加入9倍体积的质量分数为10%的TCA-丙酮溶液(含有体积分数为0.07%的β-巯基乙醇,Amresco公司生产),-20℃下静置过夜后14 000r/min条件下离心20min,倒去上清液,在蛋白沉淀中加入含体积分数为0.07%的β-巯基乙醇的丙酮,再次超声波破碎1min。超声结束后用含有体积分数为0.07%的β-巯基乙醇的丙酮重复洗涤5次后直至上清液无色,将沉淀的蛋白质样品冷冻离心干燥成粉末状,保存在-80℃冰箱中备用。
2.2 直接三氯乙酸(TCA)-丙酮沉淀法
直接TCA-丙酮沉淀法是文献中经常报道的方法,这种方法在去除色素和富集蛋白的方面很有优势,特别是丙酮对色素的溶解能力强,且对微量蛋白具有富集作用[11],因此是提取藻类细胞蛋白的一种重要方法。
2.2.1 TCA 丙酮沉淀法-1(TA-1)
按照原雅纬 等[8]的直接TCA-丙酮沉淀法操作,超声破碎缓冲液为0.5mL预冷的质量分数为10%的TCA-丙酮溶液,冰浴超声破碎后直接加入9倍体积的质量分数为10%的TCA-丙酮溶液,-20℃下静置30min之后14 000r/min条件下离心20min,倒去上清液,在沉淀物中加入含有体积分数为0.07%的β-巯基乙醇的丙酮洗涤5次,直至上清液无色后将沉淀的蛋白质样品冷冻离心干燥成粉末状,保存在-80℃冰箱中备用。
高校所处外部政治经济环境不断变化,自身在不断发展中面临的风险和问题也在不断变化。而部分高校内控仅仅是流于形式的“一次性建设“,并没有根据高校内外部环境的变化进行改进和调整,内部控制措施和框架存在滞后性和不适应性。同时,高校内控缺乏长期规划性,缺乏相应的内控固化措施。
2.2.2 TCA-丙酮沉淀法-2(TA-2)
超声破碎藻细胞的条件和TA-1相同,参考陈富成 等[16]的方法,将-20℃沉淀时间延长到12h之后4℃条件下14 000r/min离心20min,倒去上清液,沉淀结束后用含有体积分数为0.07%的β-巯基乙醇的丙酮清洗5次,直至上清液无色后将沉淀冷冻离心干燥成粉末状,保存在-80℃冰箱备用。
2.2.3 TCA-丙酮沉淀法-3(TA-3)
超声波破碎的条件和TA-1相同,在-20℃沉淀12h。沉淀结束后在4℃条件下14 000r/min离心20min,取沉淀。加入0.5mL含有体积分数为0.07%的β-巯基乙醇的丙酮(预冷),参考董明国等[17]的方法,再次超声洗涤1min,超声结束后离心,去上清液,取沉淀用。用含有体积分数为0.07%的β-巯基乙醇的丙酮洗涤5次,直至上清液无色后将沉淀冷冻离心干燥成粉末状,保存在-80℃冰箱备用。
2.3 蛋白定量
使用相同体积的双向电泳水化液重新溶解蛋白后,用碧云天生物技术有限公司生产的Bradford蛋白定量试剂盒测定。
2.4 双向电泳
使用pH值范围为3~10的IPG胶条(GE Healthcare公司生产),蛋白上样量为100μg;使用pH值范围为4~7的IPG胶条(GE Healthcare公司生产),蛋白上样量为120μg。等电聚焦仪型号为Ettan IPGphor 3(GE Healthcare公司出品),双向电泳条件按照CHAN et al[9]方法设置,一向等电聚焦结束后,每根胶条都需要分别在平衡缓冲液中平衡。基础平衡缓冲液配方为:浓度为50mmol/L的Tris,pH值为8.8,浓度为6mol/L的尿素,体积分数为30%的甘油,质量分数为2%的十二烷基硫酸钠(SDS,Bio-Rad公司生产),质量分数为1%的二硫苏糖醇(DTT,Amresco公司生产)。平衡共分两步,在平衡液I(含有质量浓度为2mg/L DTT的基础平衡液)中平衡15min后,将胶条转移至平衡缓冲液Ⅱ(含有2.5mg/L碘乙酰胺的平衡液基础溶液,碘乙酰胺为Fluka公司生产)中再平衡15min。将经平衡后的胶条转移至交联度为12.5%的聚丙烯酰胺凝胶(SDSPAGE)上进行第二向垂直电泳,所需的丙烯酰胺-甲叉双丙烯酰胺溶液及浓度为1.5mol/L的Tris-Hcl溶液(pH值为8.8)、垂直电泳槽、扫描仪均为Bio-Rad公司的产品。第二向电泳跑到底部后停止电泳并染色。
2.5 凝胶染色
采用银染法进行凝胶染色[9],脱色摇床为北京六一仪器厂的产品。
2.6 图像分析
采用Umax magicscan软件扫描凝胶图像,并用PDQuest软件进行图像分析。
3 结果
3.1 中肋骨条藻蛋白样品全范围双向电泳图谱
图1为中肋骨条藻蛋白样品(pH值为3~10)全范围双向电泳图谱。由图1可见,中肋骨条藻的蛋白点从大分子量到较小分子量分布有序,但大部分集中在酸性端大约pH值为4~7的范围内,且存在高丰度蛋白,碱性端聚焦的蛋白点比较少,因此之后的蛋白提取方法比较中,皆使用pH 4~7的IPG胶条进行实验。

图1 中肋骨条藻蛋白样品全范围双向电泳图(pH值为3~10)Fig.1 2-DE protein profiles of S.costatum protein samples(pH 3~10)
3.2 裂解液法双向电泳图谱比较
图2为不同原理裂解液法去除胞内干扰物质所得双向电泳图。由图2可见,LM法的双向电泳图谱的背景最干净,对高分子量和低分子量的蛋白点分离效果良好,共得到136个蛋白点,有竖纹且碱性端蛋白缺失严重;用L-Kit法得到的双向电泳图谱蛋白数目明显增多,蛋白点增加到354个,较小分子量的蛋白点聚焦良好,高分子量的蛋白偏少;用LAC法双向电泳图谱得到462个蛋白点,酸性蛋白、碱性蛋白、大分子量和小分子量的蛋白点分布均匀,但是大分子量蛋白的横纹和竖纹比较严重。
3.3 直接TCA-丙酮沉淀法双向电泳图谱比较
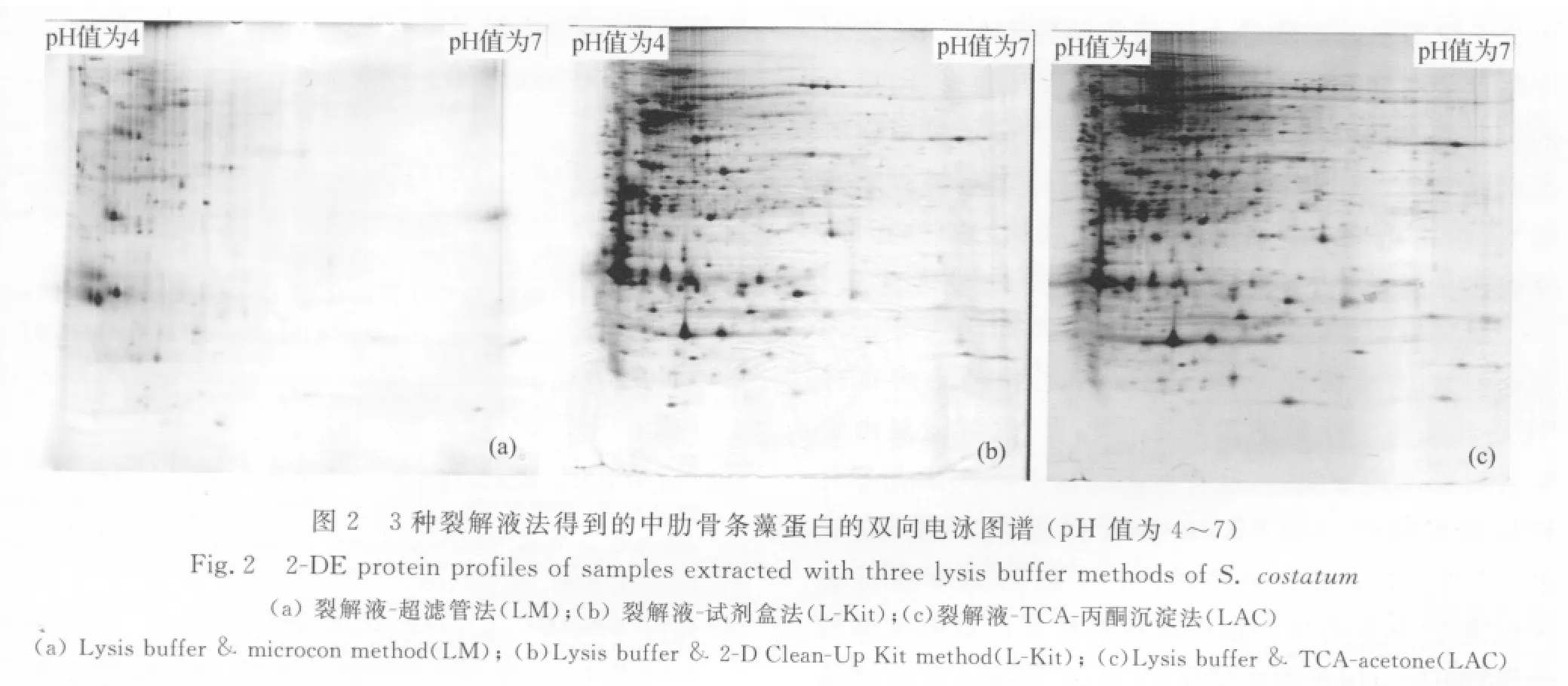
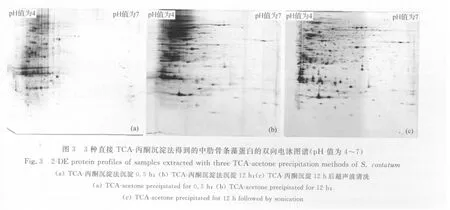
图3为3种直接TCA-丙酮沉淀法的双向电泳图谱。由图3可见,3种直接TCA-丙酮沉淀法的提取效果大不相同。经过比较后发现,TA-1方法双向电泳图谱中的蛋白点较少,共280个点,横纹和竖纹均有;TA-2方法双向电泳图谱中的酸性端的蛋白拖尾现象严重,几乎全部是横纹,得到148个蛋白点,但偏碱性端的蛋白点数量较TA-1方法有所提高;TA-3方法双向电泳图谱上基本没有横纹,较小分子量的高丰度蛋白有轻微竖向拖尾现象,可得到干净的背景、清晰的蛋白点,蛋白点的数目较多,共得到了601个蛋白点,且酸性蛋白、碱性蛋白、大分子量和小分子量的蛋白分布均匀,是TCA-丙酮沉淀法中效果最好的一种。
4 讨论
双向电泳是蛋白质组学的核心技术之一,样品制备特别是蛋白提取的质量是双向电泳成功与否的关键。由于藻类细胞内生化组成成分的较大差别,目前并没有一种通用的藻类蛋白提取方法[5]。本文对中肋骨条藻的蛋白提取方法进行了优化,为后续的研究提供实验参考。
比较3种裂解液方法提取中肋骨条藻全蛋白双向电泳结果发现(图2),LM法、L-Kit法和LAC法提取得到的藻类蛋白的蛋白分布非常相似。LM法的双向电泳图谱中的横、竖纹较多,虽去除细胞内杂质的效果非常显著,但是蛋白点数量少,可能是由于去除杂质的同时一些小分子量蛋白也有可能流失。实验中使用的超滤管的孔径为3KD,为最小孔径的商业化超滤管,可见这种方法还有待改善。L-Kit法(2-D clean-up kit)提取到的蛋白点数量比较多,但是大分子量的蛋白点聚焦效果不好,可能是由于试剂盒对大分子量蛋白的提取能力比较差所导致。LAC法对中肋骨条藻细胞内干扰物质的去除效果最好,图谱上的蛋白点数量最多,尤其是碱性端和大分子量蛋白的提取量提高,碱性端的蛋白点也大量增加,但可能是由于裂解液中的促溶成分使得干扰物的溶解性增加,导致存在高分子蛋白点聚焦仍然不完全的问题。
研究表明,在酸性条件下TCA可能渗入分子内部而使之较难被完全除去[18],因此不同藻的直接TCA-丙酮沉淀法最适提取条件各异,这可能是由于实验材料不同造成的,也有可能是由于不同研究者对样品沉淀时间不同(从30min到过夜不等)造成的[8,13,16]。有学者研究表明,使用 TCA-丙酮沉淀法时沉淀24h并且加上超声波清洗后蛋白双向电泳的效果较好[17],因此本文优化了TCA-丙酮直接沉淀法的实验条件,将沉淀时间从30min延长到12h。从3种直接TCA-丙酮沉淀法得到的中肋骨条藻蛋白的双向电泳图谱中可见(图3),将沉淀时间延长到12h后,中肋骨条藻蛋白图谱碱性端和小分子量蛋白点大量增加(图3b),但碱性端和小分子量蛋白点在大量增加的同时,也会造成与蛋白结合的TCA更加难于洗涤[18],使得酸性端蛋白等电聚焦失败。为解决上述问题,本文增加了在丙酮洗涤时的超声波洗涤过程(图3c),这一过程极大地解决了蛋白中TCA残留的问题,不仅得到了干净的背景、清晰的蛋白点,而且蛋白点的数目较多,酸性端蛋白、碱性端蛋白以及较大分子量和较小分子量的蛋白提取效果均良好,蛋白点在胶面上分布均匀。
将LAC法和TA-3法得到的双向电泳图谱进行比较发现,TA-3方法提取得到的高分子量蛋白的聚焦更完全,且高分子量蛋白区域的背景更干净,横纹和竖纹基本没有,且TA-3方法提取得到的蛋白点最多,因此本文认为TA-3的方法为中肋骨条藻的最适蛋白提取方法。
5 结论
比较了裂解液法和直接三氯乙酸(TCA)-丙酮沉淀法中肋骨条藻细胞蛋白样品的制备方法,结果表明:直接TCA-丙酮沉淀法是中肋骨条藻最适的蛋白制备法,若沉淀蛋白时间为12h,且在丙酮洗涤时增加超声波洗涤过程则效果为最好。这一方法可得到干净的背景、清晰的蛋白点,且蛋白点的数目较多,酸性端蛋白、碱性端蛋白以及较大分子量和较小分子量的蛋白提取效果良好,蛋白点在胶面上分布均匀。
(References):
[1]CARVALHO R N,LETTIERI T.Proteomic analysis of the marine diatomThalassiosirapseudonanaupon exposure to benzo(a)pyrene[J].BMC Genomics,2011,12:159-169.
[2]LI C,WANG D Z,DONG H P,et al.Proteomics of a toxic dinoflagellateAlexandriumcatenellaDH01:Detection and identification of cell surface proteins using fluorescent labeling[J].Chin Sci Bull,2012,57(1):1-8.
[3]HIPPLER M,KLEIN J,FINK A,et al.Towards functional proteomics of membrane protein complexes:analysis of thylakoid membranes fromChlamydomonasreinhardtii[J].The Plant Journal,2001,28:595-606.
[4]CONTRERAS L,RITTER A,DENETT G,et al.Two-dimensional gel electrophoresis analysis of brown algal protein extracts[J].Journal of Phycology,2008,44:1 315-1 321.
[5]MAGDELDIN S.Gel electrophoresis-advanced techniques[M].Croatia:InTec,2012:21-50(2012-04-04)[2012-08-06].http:∥www.intechopen.com/books/gel-electrophoresis-advanced-techniques.
[6]QIAN Fang.Differential proteomics study ofMicrocystisaeruginosain diverse N/P concentrations[D].Xiamen:Xiamen University,2006:22-29.
钱方.不同氮磷浓度条件下铜绿微囊藻差异蛋白质组学的研究[D].厦门:厦门大学,2006:22-29.
[7]WANG D Z,LIN L,CHAN L L,et al.Comparative studies of four protein preparation methods for proteomic study of the dinoflagellateAlexandriumsp.using two-dimensional electrophoresis[J].Harmful Algae,2009,8:685-691.
[8]YUAN Ya-wei,ZHENG Wei,LI Shao-jing,et al.Comparison of three protein extraction methods for proteomic analysis ofAlexandriumtamarensewith two-dimensional electrophoresis[J].Acta Microbiologica Sinica,2011,51(8):1 113-1 118.
原雅纬,郑伟,李少菁,等.塔玛亚历山大藻双向电泳蛋白的三种提取方法比较[J].微生物学报,2011,51(8):1 113-1 118.
[9]CHAN L L,LO S C,HODGKISS I J.Proteomic study of a model causative agent of harmful red tide,ProrocentrumtriestinumI:optimization of sample preparation methodologies for analyzing with two-dimensional electrophoresis[J].Proteomics,2002,2(9):1 169-1 186.
[10]WANG Xiu-Lin,SUN Xia,HAN Xiu-Rong,et al.Comparison in macronutrient distributions and composition for high frequency HAB occurrence areas in East China Sea between summer and spring 2002[J].Oceanologia et Limnologia Sinica,2004,35(4):323-331.
王修林,孙霞,韩秀荣,等.2002年春、夏季东海赤潮高发区营养盐结构及分布特征的比较[J].海洋与湖沼,2004,35(4):323-331.
[11]LUAN Qing-shan,SUN Jun,SONG Shu-qun,et al.Phytoplankton assemblage in Changjiang estuary and its adjacent wa-ters in autumn 2004[J].Advances in Marine Science,2008,26(3):364-371.
栾青杉,孙军,宋书群,等.2004年秋季长江口及其邻近水域浮游植物群集[J].海洋科学进展,2008,26(3):364-371.
[12]ZHOU M J,SHEN Z L,YU R C.Responses of a coastal phytoplankton community to increased nutrient input from the Changjiang(Yangtze)River[J].Continental Shelf Research,2008,28:1 483-1 489.
[13]WANG Ming-juan,JI Kong-shu.The study of protein extraction fromBuxussinicavar.parvifoliaLeaves[J].Genomics and Applied Biology,2009,28(1):105-108.
王明娟,季孔庶.珍珠黄杨叶片的蛋白质提取方法探讨[J].基因组学与应用生物学,2009,28(1):105-108.
[14]GONZÁLEZ A,BES M T,PELEATO M L,et al,Unravelling the regulatory function of FurA inAnabaenasp.PCC 7120 through 2-D DIGE proteomics analysis[J].Ecology of Harmful Algae Ecological Studies,2006,189(E):299-309.
[15]LEE F W,LO S C.The use of trizol reagent(phenol/guanidine isothiocyanate)for producing high quality two-dimensional gel electrophoretograms(2-DE)of dinoflagellates[J].Journal of Microbiological Methods,2008,73(1):26-32.
[16]CHEN Fu-cheng,QI Jian-min,XU Jian-tang,et al.Optimization of extraction method and two-dimensional electrophoresis conditions for proteome analysis of jute functional leaf[J].Acta Agronomica Sinica,2011,37(2):369-373.
陈富成,祁建民,徐建堂,等.圆果种黄麻功能叶总蛋白提取方法及双向电泳体系的优化[J].作物学报,2011,37(2):369-373.
[17]DONG Ming-guo,YANG Ming-jian.Effectiveness analysis of trichloroacetic acid/acetone precipitation method in extraction of microalbumin in urine[J].Jilin Medical Journal,2010,31(36):6 691.
董明国,杨明建.TCA/丙酮沉淀对尿液标本中微量蛋白效果分析[J].吉林医学,2010,31(36):6 691.
[18]GUO Li-an,YAN Zhe,ZHANG Xiao-nan,et al.Effect of trichloroacetic acid on the stability of protein structures[J].Journal of the Fourth Military Medical University,2001,22:22.
郭立安,阎哲,张晓楠,等.三氯乙酸对蛋白质结构稳定性的影响[J].第四军医大学学报,2001,22:22.

