鲈鱼FBP基因的克隆和表达分析
童彩环,钱云霞,郑伟贤,韩 柳
(宁波大学 生命科学与生物工程学院,应用海洋生物技术教育部重点实验室,浙江 宁波 315211)
0 引言
果 糖-1,6-二 磷 酸 酶 (fructose-1,6-bisphosphatase,FBP,EC 3.1.3.11)糖异生途径中的关键酶之一,可催化果糖-1,6-二磷酸(fructose-1,6-bisphosphate)水解成果糖-6-磷酸(fructose-6-phosphate)和无机磷酸盐(inorganic phosphate,Pi)[1]。FBP是一个同源四聚体,由4个结构相同的单体组成,其催化作用需镁、锰、钴或锌等2价阳离子参与[2],所以FBP除底物结合位点外还有金属离子结合位点。FBP以活性形式和非活性形式存在[3],果糖-2,6-二磷酸(fructose-2,6-bisphosphate)和 腺 嘌 呤 核 糖 核 苷 酸(adenosine monophosphate,AMP)都能抑制FBP的催化活性,其中果糖-2,6-二磷酸是直接与活性位点结合进行抑制,而AMP是通过变构调节进行抑制,即AMP结合于变构位点,影响FBP与金属离子的结合,从而抑制FBP的催化活性。除哺乳动物外,FBP广泛存在于细菌、鸟类、甲壳动物、鱼类和两栖类[4-5]。而在哺乳动物中发现有2种编码FBP的基因存在,一种称肝脏型FBP(FBP1),最早发现于葡萄糖异生作用的组织中,如肝脏,肾脏和消化道;另一种称为肌肉型FBP(FBP2),仅在骨骼肌中表达,主要参与乳酸盐类物质的糖异生作用[6-7]。
由于FBP参与调控糖异生途径,抑制FBP的活性可以治疗小鼠二型糖尿病,因而FBP对葡萄糖的动态平衡至关重要[8]。在鱼类尤其是肉食性鱼类中,增强肝脏和消化道中的糖异生作用是食物缺乏时防止血糖波动的有利途径[9]。FBP作为糖异生作用的三大关键酶之一,其编码序列已在彩虹胡瓜鱼Osmerusmordax、斑马鱼Daniorerio、异育银鲫Caras-siusgibelio和大西洋鲑Salmosalar等少数几种鱼类中被分离和鉴定。
鲈鱼Lateolabraxjaponicus,也叫海鲈、花鲈、七星鲈,属于鲈形目,是一种广盐性的肉食性鱼类,也是我国海水网箱养殖的重要鱼类之一。现实验室已经克隆了鲈鱼糖异生途径中的另外2种关键酶:葡萄糖-6-磷酸酶(glucose-6-phosphatase,G6Pase)和磷酸烯醇丙酮酸羧激酶(phosphoenolpyruvate carboxykinase,PEPCK)基因[10-11]。本实验分离了鲈鱼 FBP基因,对其cDNA和氨基酸序列进行了分析,并对其组织表达特性进行了研究,为进一步研究鲈鱼FBP的生物学功能奠定基础。
1 材料和方法
1.1 试验材料
实验所用二龄鲈鱼购于宁波水产品大世界。
引物由上海捷瑞生物工程有限公司合成。MS-222为sigma公司产品;Trizol试剂为Invitrogen公司产品;逆转录试剂PrimeScriptTM1st Strand cDNA Synthesis Kit、Taq酶和pMD-18T载体等均为Takara公司产品(大连);SMARTTMRACE cDNA Amplification Kit购自Clontech公司。大肠杆菌EscherichiacoliDH5α由本实验室保存。其它试剂为国产分析纯试剂。
1.2 总RNA的提取和cDNA第一条链的合成
鲈鱼经MS-222麻醉后取其肝脏,参照Trizol试剂操作提取总RNA,经NanoDrop 1000Spectrophotometer检测RNA的浓度和纯度,用1.2%(w/v)的琼脂糖凝胶电泳检测总RNA的完整性。取1μg总RNA参照PrimeScriptTM1st Strand cDNA Synthesis Kit试剂操作说明书反转录合成肝脏cDNA第一条链。
1.3 FBP全长cDNA扩增
根据其他动物的FBP cDNA序列在保守区分别设计兼并引物FBP-F/R克隆核心片段,引物序列见表1。以上述肝脏cDNA为模板,用FBP-F/R扩增FBP核心片段。FBP核心片段的扩增条件为:预变性94℃,3min;94 ℃、30s,58~55 ℃、30s,72℃、1min,共进行36个循环(前4个循环退火温度每循环下降1℃);最后72℃延伸5min。PCR产物用1.2%的琼脂糖凝胶电泳检测,割胶回收后与pMD18-T载体连接,连接产物转化感受态细胞DH5α,经PCR检测后将阳性克隆送上海英骏生物工程公司进行测序。
在测序得到的核心序列的基础上,分别设计FBP的5’RACE和3’RACE特异性引物,序列见表1。参照SMARTTMRACE cDNA Amplification Kit说明书,取鲈鱼肝脏总RNA分别合成5’Ready和3’Ready cDNA,用于5’和3’末端cDNA的克隆。PCR产物纯化、克隆和测序方法同上。最后对所获得的序列进行拼接,获得FBP全长cDNA序列。
1.4 FPB的同源性分析与系统进化分析
应用BioEdit软件进行氨基酸序列推导,并将鲈鱼FBP与彩虹胡瓜鱼、斑马鱼、人Homosapiens和小鼠Musmusculus的肝脏型FBP进行氨基酸序列比对分析。并对鲈鱼FBP与其它已知动物的FBP作同源性分析。使用 MEGA 4.0软件,通过邻接法(Neighbor Joining,NJ)对鲈鱼FBP和GenBank中已收录的其它物种的FBP氨基酸序列进行分子进化树聚类分析。
1.5 FBP在组织中的表达分析
以18S为内参基因,检测FBP在不同组织中的表达特点。提取鲈鱼肝脏、肌肉、脾脏、心脏、眼、肾脏、肠、脂肪、鳃和大脑等10个组织的RNA,各取1 μg参照PrimeScriptTM1st Strand cDNA Synthesis Kit说明书反转录合成cDNA。根据得到的FBP序列,设计组织表达引物FBP-RT-F/R,序列见表1。

表1 PCR扩增用引物列表Tab.1 Primers used in PCR
2 结果
2.1 FBP cDNA的克隆及序列分析
用兼并引物FBP-F和FBP-R进行PCR克隆到鲈鱼FBP的核心片段741bp,在此基础上利用引物FBP-5RACE-1/2和 FBP-3RACE-1/2分别进行2轮5’RACE和3’RACE PCR,得到5’末端序列724bp和3’末端序列810bp,与核心序列分别有545bp和350bp的重叠。进行拼接后得到鲈鱼FBP cDNA的全长为1 357bp,5’非翻译区和3’非翻译区分别为42bp和301bp,开放阅读框为1 014bp,共编码337个氨基酸(图1),预测蛋白质分子量约为36.7kD,理论pI为6.90。
2.2 FBP的同源性分析与系统进化分析
经同源性分析发现鲈鱼FBP基因与裸盖鱼Anopiopomafimbria(ACQ58743)、彩虹胡瓜鱼、斑马鱼、异育银鲫和大西洋鲑的同源性分别为94.3%,90.8%,89.3%,88.1%和84.1%,与哺乳动物中的人、牛BosTaurus、猪Susscrofa和小鼠的肝脏型FBP同 源 性 分 别 为 78.9%,77.8%,77.8% 和75.4%,与人、牛、猪和小鼠的肌肉型FBP的同源性分别为74.9%,75.5%,68.7%和73.7%。
将鲈鱼FBP与人、斑马鱼、小鼠和彩虹胡瓜鱼的氨基酸序列进行比对分析发现,鲈鱼FBP也具有AMP结合位点、金属结合位点、活性位点和底物结合位点等功能位点(图2)。

图1 鲈鱼FBP cDNA及其推导的氨基酸序列(*为终止子)Fig.1 The cDNA and deduced amino acid sequences of the Lateolabrax japonicus FBP gene(*indicates terminator)

图2 鲈鱼、人、斑马鱼、小鼠和彩虹胡瓜鱼FBP氨基酸序列的多重比对Fig.2 Multiple alignment of amino acid sequences of FBP of Lateolabrax japonicus,Homo sapiens,Danio rerio,Mus musculus and Osmerus mordax
用MEGA 4.0软件的邻接法对鲈鱼和其它鱼类、甲壳类、昆虫类、鸟类和哺乳动物的2种FPB型的氨基酸序列构建进化树。通过进化树可以发现,本实验克隆的鲈鱼FBP与其它鱼类的肝脏型FBP成簇后再与哺乳动物的肝脏型FBP聚成一支,然后才与哺乳动物的肌肉型FBP汇成簇(图3)。
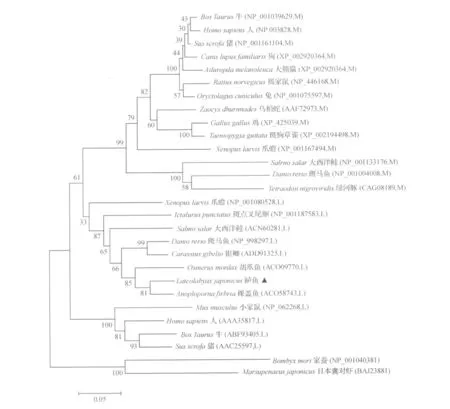
图3 鲈鱼和其他物种FBP的氨基酸序列系统分析Fig.3 Phylogenetic analysis of FBP amino acid sequences of Lateolabrax japonicus and other species
2.3 FPB的组织表达分析
用RT-PCR检测鲈鱼FPB基因的组织表达特点,所检测3尾鲈鱼的10个组织包括肝脏、鳃、心脏、肾脏、大脑、眼、肠、脾脏、肌肉和脂肪等。结果表明FPB仅在肝脏、肠和肾脏这3个组织中有明显表达(图4)。
3 讨论与结论
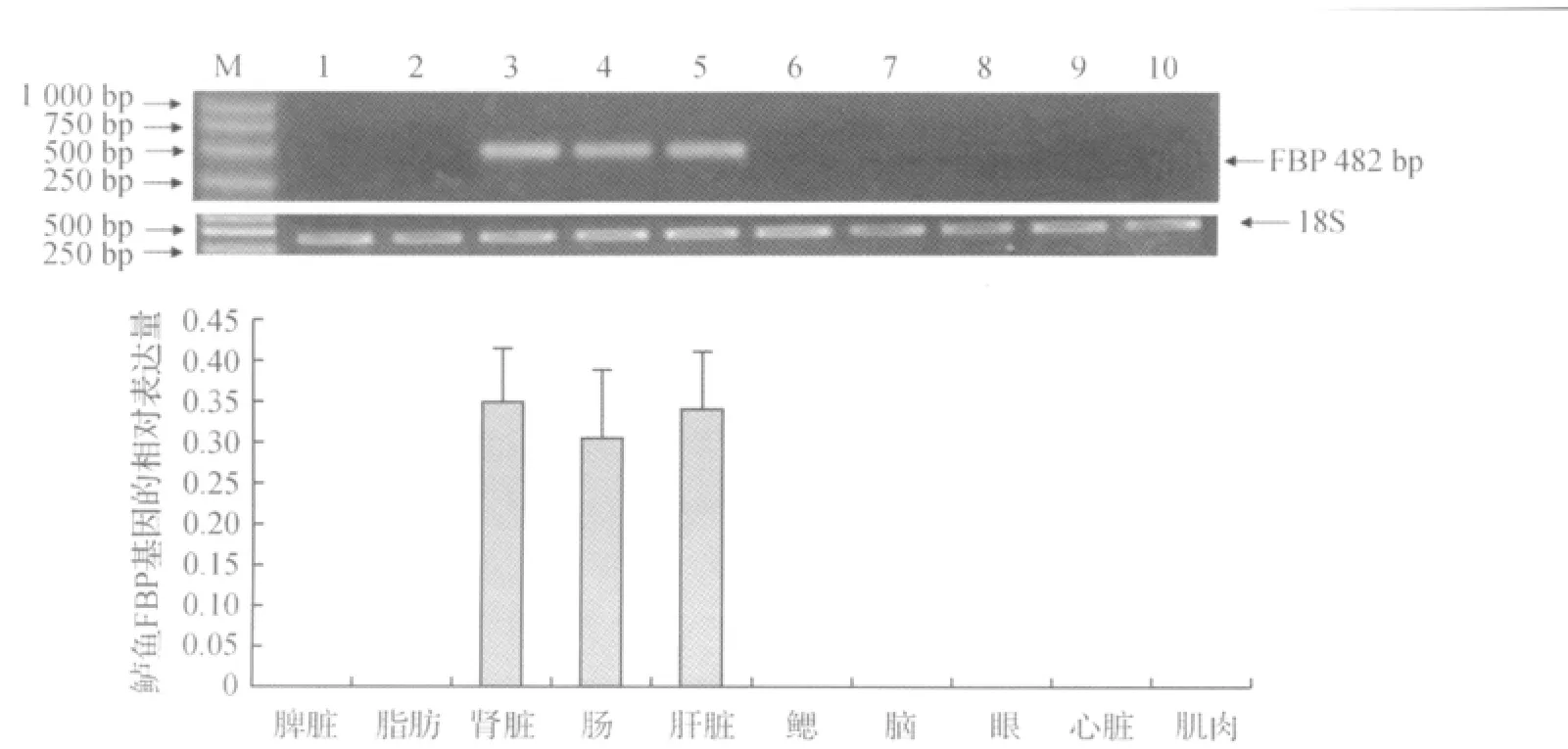
图4 鲈鱼FPB组织表达结果Fig.4 Expression of Lateolabrax Japonicus RXRα,RXRβand RXRγin various tissues
本实验从鲈鱼肝脏cDNA中分离得到FBP的全长cDNA序列共1 357bp,该序列包含1个1 014bp的完整开放阅读框,可编码337个氨基酸组成的蛋白。序列分析表明,鲈鱼FBP含有AMP结合位点、底物结合位点、金属结合位点和活性位点,其中活性位点和底物结合位点有数处重叠且较在其他物种间更为保守,但AMP结合位点略有变化,比如AMP结合位点的第2个氨基酸小鼠为Q,而鲈鱼的为E且和彩虹胡瓜鱼、斑马鱼及人的氨基酸相同。已有研究表明,肌肉型FBP和肝脏型FBP对钙离子和AMP二种抑制物的敏感程度不同,但二者的AMP结合位点和金属结合位点的氨基酸差异并不大[12-13]。
在哺乳动物中,糖异生作用主要发生在肝脏中,消化道和肾脏也参与糖异生过程,是鱼类糖异生过程发生的3个主要组织[14-15]。本实验对鲈鱼糖异生过程的关键酶FBP的组织特异性表达研究发现,该基因只在肝脏、肾脏和肠这3个组织中表达,和糖异生作用发生的组织特异性基本吻合。我们前期的研究结果表明,鲈鱼的另2种糖异生途径关键酶PEPCK基因和 G6P也主要在这3个组织中表达[10-11],该结果也和虹鳟鱼Oncorhynchusmykiss3种关键限速酶的组织表达特点一致[9],但银鲫的FBP基因(肝脏型)在肝脏、脑、心脏、脾脏、肾脏、肠、肌肉和卵巢等组织中都有表达,以肝脏表达量最高[16]。
FBP是糖异生过程的关键酶之一,在哺乳动物中存在2个编码FBP的基因,一个为肝脏型,主要表达于肝、肾﹑肺和消化道中;另一个为肌肉型,仅表达于骨骼肌中。比较肝脏型和肌肉型FBP的一级结构和二者间的突变积累推测FBP复制成肝脏型大概发生在3亿年前,且用RT-PCR的方法没有检测到鱼类肌肉中存在肌肉型FBP这一基因,因此有人推测在鱼类中没有肌肉型 FBP[4,17]。但是,从 GenBank数据库中搜索发现大西洋鲑和斑马鱼都存2种FBP序列,从同源性分析和进化树结果看,这2个基因分别与哺乳动物的肌肉型的FBP和肝脏型的FBP聚合。王锐 等[16]也证实鱼类至少存在肝脏型和肌肉型2种类型的FBP,但至今未见关于鱼类肌肉型FBP的报道。本实验克隆所得到的FBP与肝脏型的FBP聚为一支,且表达的组织也与肝脏型的表达特点一致,推测该基因为鲈鱼肝脏型FBP,关于鲈鱼中是否还存在另一种肌肉型FBP还有待研究。
(References):
[1]PILKIS S J,CLAUS T H.Hepatic gluconeogenesis/glycolysis:regulation and structure/function relationships of substrate cycle enzymes[J].Annu Rev Nutr,1991,11:465-515.
[2]RAKUS D,MACIASZCZYK E,WAWRZYCKA D,et al.The origin of the high sensitivity of muscle fructose1,6-bisphosphatase towards AMP[J].FEBS Letters,2005,579(25):5 577-5 581.
[3]LU G,STEC B,GIROUX E L,et al.Evidence for an active T-state pig kidney fructose 1,6-bisphosphatase:Interface residue Lys-42is important for allosteric inhibition and AMP cooperativity[J].Protein Science,1996,5(11):2 333-2 342.
[4]TILLMANN H,BERNHARD D,ESCHRICH K.Fructose-1,6-bisphosphatase genes in animals[J].Gene,2002,291(1/2):57-66.
[5]SOULIMANE T.Thermus thermophilus encodes an archaeal-like fructose-1,6-bisphosphatase:Purification of native and recombinant protein for structural studies[J].Protein Expression and Purification,2010,74(2):175-180.
[6]SKALECKI K,RAKUS D,WISNIEWSKI J R,et al.cDNA sequence and kinetic properties of human lung fructose (1,6)bisphosphatase[J].Arch Biochem Biophys,1999,365(1):1-9.
[7]AL-ROBAIY S,ESCHRICH K.Rat muscle fructose-1,6-bisphosphatase:Cloning of the cDNA,expression of the recombinant enzyme,andexpression analysis in different tissues[J].Biol Chem,1999,380(9):1 079-1 085.
[8]HEBEISEN P,HAAP W,KUHN B,et al.Orally active aminopyridines as inhibitors of tetrameric fructose-1,6-bisphosphatase[J].Bioorganic & Medicinal Chemistry Letters,2011,21(11):3 237-3 242.
[9]KIRCHNER S,PANSERAT S,LIM P L,et al.The role of hepatic,renal and intestinal gluconeogenic enzymes in glucose homeostasis of juvenile rainbow trout[J].J Comp Physiol B,2008,178(3):429-438.
[10]QIAN Yun-xia,YANG Sun-xiao,TONG Li-juan,et al.Low salinity induces cytosolic PEPCK expression in Sea Perch(Lateolabraxjaponicus)[J].Chinese Journal of Biochemistry and Molecular Biology,2006,26(7):651-658.
钱云霞,杨孙孝,童丽娟,等.低盐度可诱导鲈鱼胞浆型PEPCK基因表达[J].中国生物化学与分子生物学报,2006,26(7):651-658.
[11]QIAN Yun-xia,ZHENG Wei-xian,SONG Juan-juan.Cloning and sequence analysis ofLateolabraxjaponicusGlucose-6-phosphatase Catalytic Subunit(G6PC)cDNA and its 5’-flanking region[J].Journal of Agricultural Biotechnology,2011,19(4):606-615.
钱云霞,郑伟贤,宋娟娟.鲈鱼6-磷酸葡萄糖酶催化亚基(G6PC)cDNA和5’侧翼序列的克隆及分析[J].农业生物技术学报,2011,19(4):606-615.
[12]GIZAK A,MAJKOWSKI M,DUS D,et al.Calcium inhibits muscle FBPase and affects its intracellular localization in cardiomyocytes[J].FEBS Lett,2004,576(3):445-448.
[13]RAKUS D,TILLMANN H,WYSOCKI R,et al.Different sensitivities of mutants and chimeric forms of human muscle and liver fructose-1,6-bisphosphatases towards AMP[J].Biol Chem,2003,384(1):51-58.
[14]MITHIEUX G,GAUTIER-STEIN A,RAJAS F,et al.Contribution of intestine and kidney to glucose fluxes in different nutritional states in rat[J].Comp Biochem Physiol B Biochem Mol Biol,2006,143(2):195-200.
[15]SUAREZ R K,MOMMSEN T P.Gluconeogenesis in teleost fishes[J].Can J Zool,1987,65:1 869-1 882.
[16]WANG Rui,XIAO Qing,GUI Jian-fang.Molecular cloning and expression analysis of fructose-1,6-bisphosphatase in gibel carp[J].Acta Hydrobiologica Sinica,2010,34(6):1 130-1 135.
王锐,肖青,桂建芳.银鲫果糖-1,6-二磷酸酶的分子克隆与表达分析[J].水生生物报,2010,34(6):1 130-1 135.
[17]TILLMANN H,STEIN S,LIEHR T,et al.Structure and chromosomal localization of the human and mouse muscle fructose-1,6-bisphosphatase genes[J].Gene,2000,247(1/2):241-253.

