新基因hSSB1逆转录病毒载体的构建、鉴定和稳定株的筛选*
张如华,徐双兵,武远众,康铁邦
(华南肿瘤学国家重点实验室∥中山大学肿瘤防治中心实验研究部,广东 广州 510060)
细胞周期是一个复杂的过程,其精确调控是维持基因组稳定性以及细胞正常功能的必要条件[1]。已有研究表明很多种调节蛋白参与调控细胞周期的进程,包括cyclins(细胞周期素),CDKs(Cyclin-dependent kinase 周期素依赖性激酶)以及 CDK 抑制分子[2,3]。为确保细胞周期正常运行,细胞内自发形成了许多的调控机制。细胞周期检测点就是其中重要的一种调控机制,如果其激活缺陷就会导致细胞周期的紊乱,从而有可能导致肿瘤的发生[4]。
hSSB1是最近发现的一种单链DNA结合蛋白,是参与调控细胞周期检测点的一个重要分子[5]。缺失hSSB1的细胞表现为细胞检测点的激活缺陷,放射敏感性增加以及基因组的不稳定性[5]。本课题组前期研究结果发现hSSB1可以和p21相互作用从而调控细胞周期检测点的运行,而且hSSB1在人类肝癌组织中呈高表达[6],但其高表达后对肿瘤生物学行为的影响目前并不清楚。在本研究中,拟构建hSSB1高表达的逆转录病毒载体pBABE-hSSB1,并进行高表达稳定株的筛选,为进一步研究hSSB1的功能奠定基础。
1 材料和方法
1.1 材料和试剂
HeLa,HepG2和HEK293T细胞由中山大学肿瘤防治中心保存。pBABE-puro逆转录病毒载体(含有嘌呤霉素抗性基因)为中山大学公共卫生学院陈雯教授馈赠。PIK病毒包装质粒由中山大学肿瘤防治中心曾木圣教授馈赠。BamH I、SalI内切酶以及逆转录试剂盒均为MBI Fermentas公司产品,T4 DNA Ligase购自Takara公司,质粒小提试剂盒和切胶回收试剂盒均购自Qiagen公司,2×Taq PCR MasterMix 购自北京天根公司。Trizol试剂和脂质体转染试剂Lipofectamine2000购自Invitrogen公司。兔抗人hSSB1多克隆抗体为Bethyl公司产品,鼠抗人HSP70 抗体购自Santa Curz 公司,感受态细胞DH5α以及HRP羊抗兔和鼠二抗均购自北京鼎国生物技术有限公司。Polybrene和puromycin均购自Sigma公司。
1.2 实验方法
1.2.1 HeLa细胞总RNA 的提取 按照Trizol 试剂说明书步骤提取总RNA。收集所培养的HeLa细胞,6孔板中每孔加入1 mL Trizol 试剂,室温静置5 min。加入氯仿0.2 mL,充分混匀,室温静置2~3 min 后,4 ℃ 12 000 r/min离心15 min。将上清转移到一个新的无RNA酶的EP管中,加入500 μL的异丙醇,充分混匀,室温静置10 min。4 ℃,12 000 r/min离心10 min。弃上清,加入φ=75%乙醇1 mL,4 ℃ 7 500 r/min 离心5 min。弃上清,室温干燥5~10 min,加入20 μL DEPC 处理水,58 ℃水浴10 min,得到的RNA保存于- 80 ℃。
1.2.2 引物设计 根据GenBank 的基因序列(NM_024068),设计扩增hSSB1编码区cDNA上、下游引物。上、下游引物中分别引入BamHI、SalI酶切位点。GAPDH引物序列同前[7]。所有引物均由Invitrogen公司合成。引物序列见表1。

表1 扩增基因所需的引物
1.2.3 逆转录聚合酶链反应(RT-PCR) RNA用分光光度计测浓度后行逆转录反应,选用MBI Fermentas 公司的RevertAid First Strand cDNA Synthesis Kit.按试剂说明书操作。合成的cDNA置于-20 ℃保存。取 1.5 μL cDNA进行PCR 反应,反应条件:94 ℃预变性5 min; 94℃变性30 s,58 ℃退火30 s, 72 ℃延伸1 min,共30个循环。再于72 ℃ 延伸10 min。PCR产物经w=2%琼脂糖凝胶电泳鉴定,然后切胶回收。胶回收根据Qiagen公司的胶回收试剂盒说明书进行。
1.2.4 pBABE-hSSB1重组逆转录病毒载体构建
1)目的基因片段和载体双酶切:用BamH I、SalI酶分别双酶切回收的hSSB1目的片段以及载体pBABE,37 ℃酶切30 min。
2)切胶回收:双酶切后的产物经切胶回收,按试剂说明书操作。
3)目的片段与pBABE表达载体的连接:将回收的目的基因hSSB1片段以及载体pBABE在T4 DNA 连接酶作用下连接,16 ℃水浴反应过夜。
4)质粒转化: 各取5 μL过夜连接产物转化感受态细胞DH5α,分别涂布于含氨苄抗性的LB 平板上,37 ℃恒温箱培养过夜。从每个培养皿上各挑取3个单克隆菌落接种于6 mL 含氨苄抗性的LB 培养液中,37 ℃恒温摇床培养过夜。
5)质粒提取与酶切鉴定:按照质粒小提试剂盒说明书提取质粒,并分别用BamHI、SalI酶做酶切鉴定,同时也做PCR扩增验证。酶切产物和PCR产物行w=1.5% 琼脂糖凝胶电泳。
6)测序鉴定:将酶切及PCR扩增鉴定正确的克隆送Invitrogen公司测序分析。
1.2.5 制备病毒上清液 转染前1 d,10 cm平皿铺板HEK293T包装细胞,待细胞密度达到30%~50%左右时进行转染。转染对照载体pBABE-vector或pBABE-hSSB1和病毒包装质粒PIK,操作按Lipofectamine2000说明书进行。转染后将细胞置于37 ℃,φ=5% 的CO2的培养箱中培养,48 h后,收集病毒上清液,用0.45 μm过滤器过滤病毒上清,-80 ℃保存。
1.2.6 稳定细胞株的建立 铺板HeLa和HepG2细胞于6孔板中,培养过夜。待细胞密度达到50%时开始感染病毒。每孔加入2 mL病毒液(含8 μg/mL polybrene),37 ℃培养箱中培养。4 h后换另外2 mL病毒液继续感染细胞。再过4 h后,弃去病毒液,换正常培养基过夜。感染24 h后,用puromycin(0.8 μg/mL)筛选5 d后,收集细胞提取蛋白,Western blot检测目的蛋白表达。
1.2.7 Western blotting 检测 收集HeLa和HepG2对照组和转染组细胞,提取蛋白,用Bradford法测定蛋白浓度并定量,用w=10% 聚丙烯酰胺凝胶进行电泳,电泳结束后转膜200 mA,2 h,用含w=5% 脱脂奶粉的TBST 室温封闭1 h,孵育hSSB1一抗(1∶2 000)和HSP70(1∶1 000)4 ℃过夜;TBST 洗涤3次,每次10 min,加入辣根过氧化物酶标记的二抗,室温孵育1.5 h;TBST 洗涤同前,X光片压片,显影、定影。
2 结 果
2.1 目的基因hSSB1的扩增
从HeLa细胞中提取RNA,经过逆转录后得到其cDNA。以该cDNA为模板,经RT-PCR 扩增出目的基因hSSB1和GAPDH基因的条带。扩增产物电泳结果可见在300 bp左右的条带(图1),为GAPDH的扩增条带,说明所抽提的RNA是完整的。同样在500~750 bp处也有一特异性扩增条带(图1),与预期扩增的hSSB1片段大小相符。
2.2 重组质粒的酶切和PCR鉴定
将PCR扩增的目的基因片段用BamHI、SalI双酶切后与同样经双酶切的逆转录病毒载体pBABE-puro连接,连接产物经转化后挑菌,并提取质粒。重组质粒经双酶切鉴定,琼脂糖凝胶电泳显示得到了约650 bp 的目的片段和约5 100 bp的载体片段(图2中第2泳道)。同时将得到的重组质粒进行PCR扩增,可得到很明显的目的条带(图2中第3泳道)。说明得到的阳性克隆质粒是正确的。
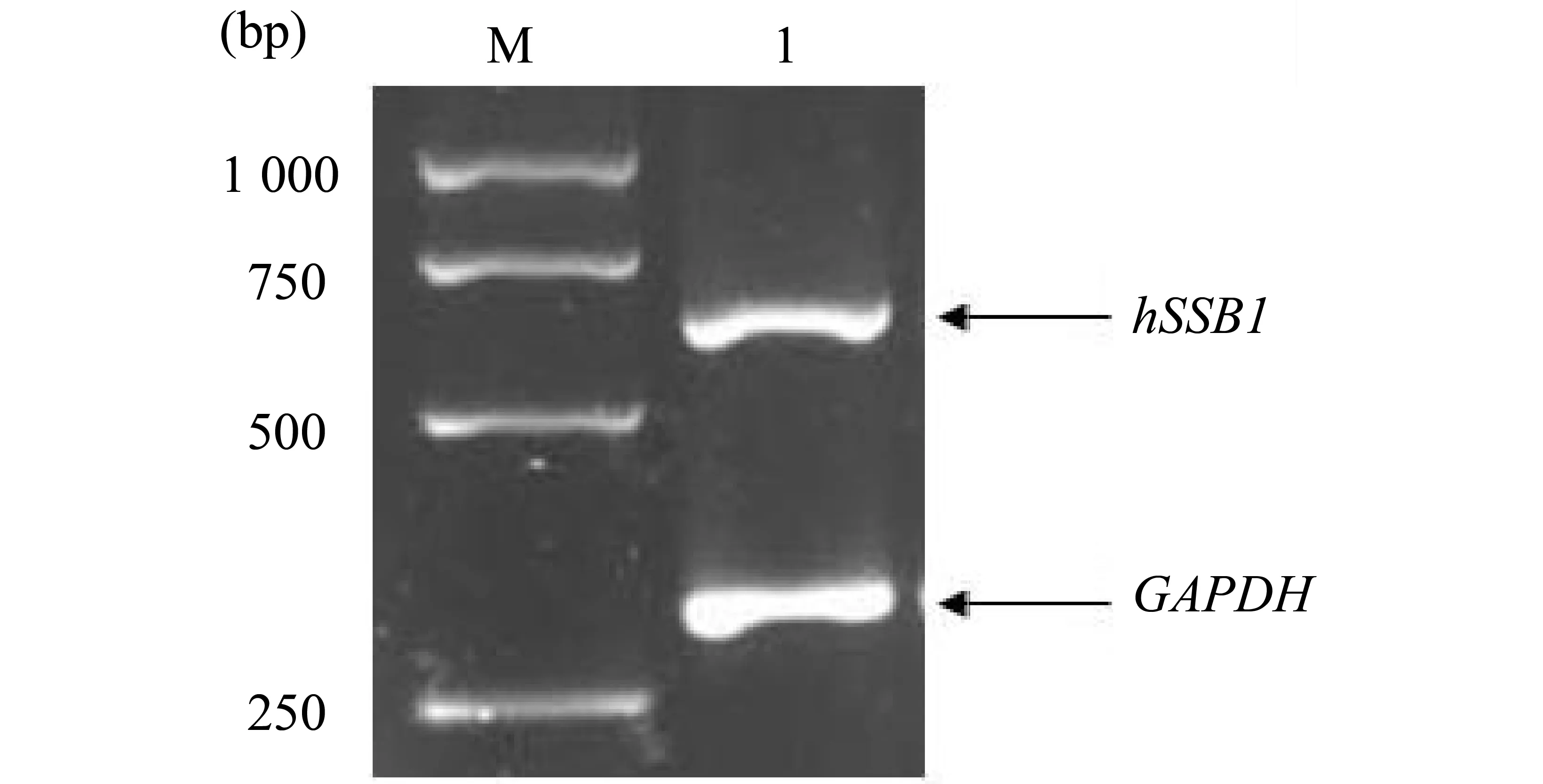
图1 RT-PCR 扩增获得的hSSB1编码区的电泳结果
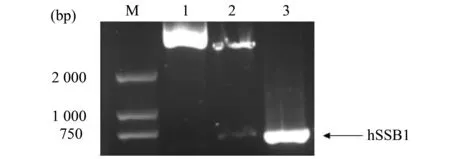
图2 重组质粒经BamHI、SalI酶切及PCR扩增后的电泳结果
2.3 重组质粒的测序鉴定
将酶切和PCR鉴定正确的质粒送去Invitrogen公司测序,测序结果表明克隆的hSSB1片段已成功插入pBABE中的指定位点,而且阅读框架也正确无误,其序列与基因文库中完全一致,未见有碱基突变(图3,框示为hSSB1的起始密码子)。
2.4 Western blotting 检测HeLa和HepG2细胞中hSSB1的表达
将包装好的pBABE-hSSB1和对照病毒液感染人肿瘤细胞系HeLa和HepG2细胞,经嘌呤霉素(0.8 μg/mL)筛选后,得到了稳定表达目的蛋白的阳性细胞株。筛选后的细胞提取蛋白做Western blotting鉴定。结果表明:hSSB1转染的HeLa 和HepG2细胞中均可见到hSSB1特异性条带,且hSSB1的表达明显高于对照组(图4)。证实稳定筛选得到的HeLa和HepG2细胞株中有hSSB1蛋白的持续高表达。
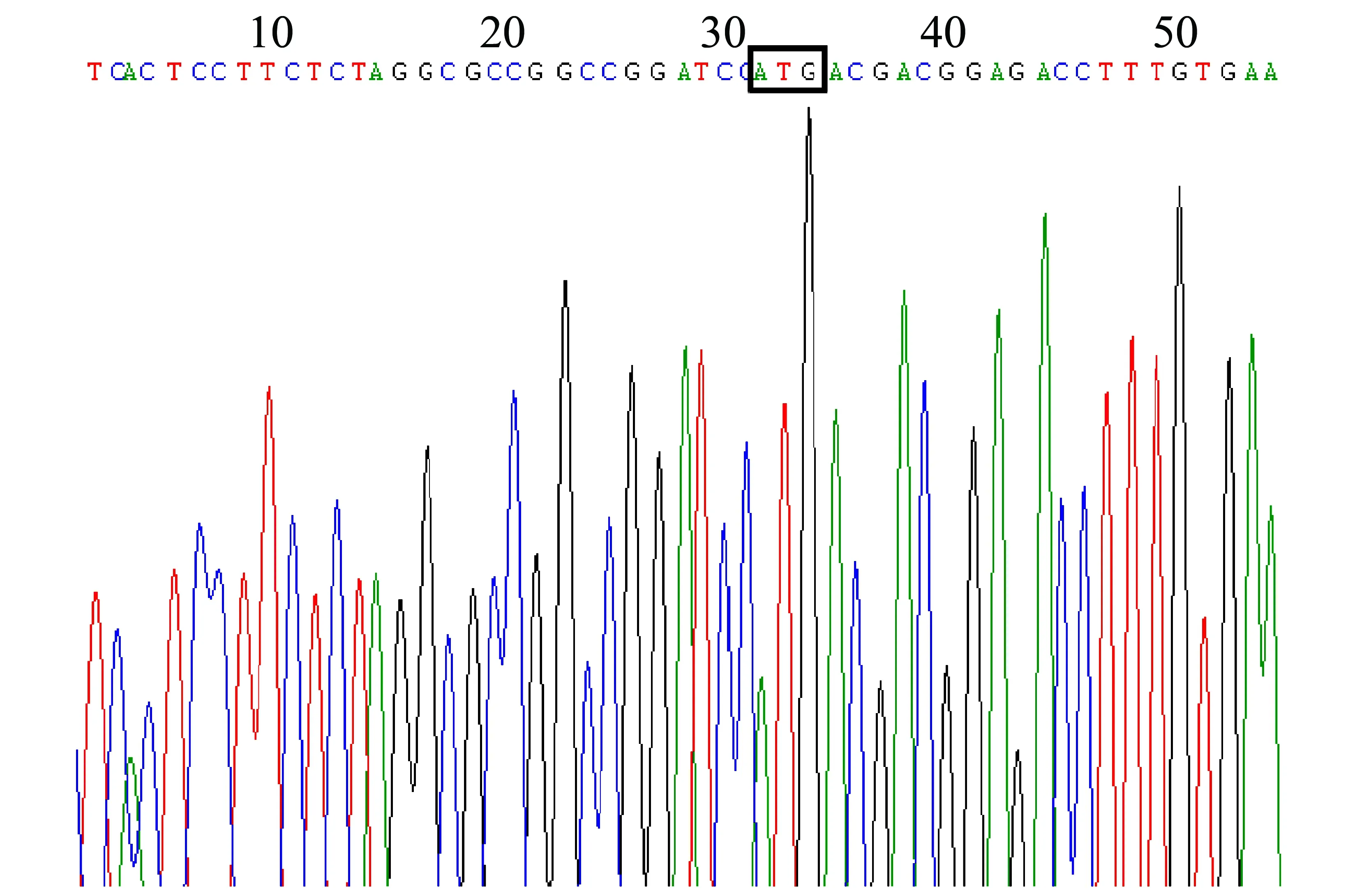
图3 pBABE-hSSB1的测序结果:框中所示为hSSB1的起始密码子
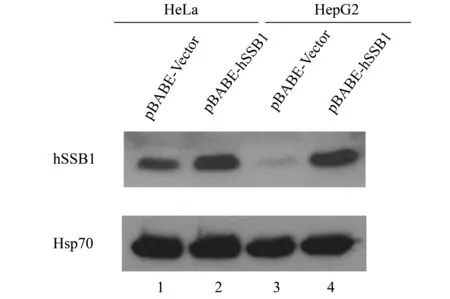
图4 Western blotting 检测 hSSB1基因表达情况
3 讨 论
hSSB1是一编码211个氨基酸残基,相对分子质量为33 000 的新蛋白质[5]。已有研究发现hSSB1可以招募MRN复合物到双链DNA断裂位点,激活ATM所依赖性的信号通路[8]。此外,hSSB1还可以和MRN复合物中的NBS1直接结合,从而增强MRN复合物的核酶内切酶活性[9]。运用串联亲和纯化的方法筛选出了一个与hSSB1相互作用的蛋白INTS3,进一步的研究发现INTS3可以通过调控hSSB1从而参与DNA损伤反应[10-13]。因此hSSB1在DNA损伤应答中发挥着重要的功能。
逆转录病毒载体能有效地将外源基因整合进宿主细胞基因组并可以稳定表达外源基因,而且其病毒包装过程简单,因此成为构建稳定表达株最常用载体之一。在本实验中我们将hSSB1基因构建在逆转录病毒载体pBABE-puro,经限制性核酸内切酶酶切和PCR鉴定以及测序证实目的基因hSSB1序列正确,成功构建了重组子pBABE-hSSB1。然后将所构建的含hSSB1基因的重组质粒以及对照质粒转染到HeLa和HepG2 细胞,并用嘌呤霉素筛选稳定转染细胞株。由于逆转录病毒载体pBABE-puro上含有嘌呤霉素抗性基因,加入嘌呤霉素后阳性克隆细胞才会存活,通过进一步扩大培养,筛选出稳定表达株。为了鉴定hSSB1基因是否已经转染到HeLa和HepG2 细胞中,我们通过western blot的方法检测转染对照质粒和pBABE-hSSB1的细胞中hSSB1蛋白的表达,结果发现转染了hSSB1基因的HeLa和HepG2细胞中,其hSSB1目的条带比转染了对照质粒的细胞在蛋白水平表达量均明显增加,表明hSSB1基因已经转染到HeLa和HepG2 细胞中并且有此蛋白的过量表达。本实验中我们成功构建hSSB1高表达的病毒载体,为今后进一步研究hSSB1的生物学功能奠定了良好的实验基础。
参考文献:
[1]NAKANISHI M,SHIMADA M,NIIDA H.Genetic instability in cancer cells by impaired cell cycle checkpoints [J].Cancer Sci,2006,97(10): 984-989.
[2]FISHER R P.CDKs and cyclins in transition(s)[J].Curr Opin Genet Dev,1997,7(1): 32-38.
[3]SHERR C J,ROBERTS J M.CDK inhibitors: positive and negative regulators of G1-phase progression [J].Genes Dev,1999,13(12): 1501-1512.
[4]HARTWELL L H,KASTAN M B.Cell cycle control and cancer [J].Science,1994,266(5192):1821-1828.
[5]RICHARD D J,BOLDERSON E,CUBEDDU L,et al.Single-stranded DNA-binding protein hSSB1 is critical for genomic stability [J].Nature,2008,453(7195): 677-681.
[6]XU S,FENG Z,ZHANG M,et al.hSSB1 binds and protects p21 from ubiquitin-mediated degradation and positively correlates with p21 in human hepatocellular carcinomas [J].Oncogene,2011,30(19): 2219-2229.
[7]LIU X H,XU S B,YUAN J,et al.Defective interleukin-4/Stat6 activity correlates with increased constitutive expression of negative regulators SOCS-3,SOCS-7,and CISH in colon cancer cells [J].J Interferon Cytokine Res,2009,29(12): 809-816.
[8]RICHARD D J,SAVAGE K,BOLDERSON E,et al.hSSB1 rapidly binds at the sites of DNA double-strand breaks and is required for the efficient recruitment of the MRN complex [J].Nucleic Acids Res,2011,39(5):1692-1702.
[9]RICHARD D J,CUBEDDU L,URQUHART A J,et al.hSSB1 interacts directly with the MRN complex stimulating its recruitment to DNA double-strand breaks and its endo-nuclease activity [J].Nucleic Acids Res,2011,39(9): 3643-3651.
[10]HUANG J,GONG Z,GHOSAL G,et al.SOSS complexes participate in the maintenance of genomic stability[J].Mol Cell,2009,35(3): 384-393.
[11]LI Y,BOLDERSON E,KUMAR R,et al.HSSB1 and hSSB2 form similar multiprotein complexes that participate in DNA damage response [J].J Biol Chem,2009,284(35): 23525-23531.
[12]SKAAR J R,RICHARD D J,SARAF A,et al.INTS3 controls the hSSB1-mediated DNA damage response [J].J Cell Biol,2009,187(1): 25-32.
[13]ZHANG F,WU J,YU X.Integrator3,a partner of single-stranded DNA-binding protein 1,participates in the DNA damage response [J].J Biol Chem,2009,284(44): 30408-30415.

