鲤IGF2b基因内含子的克隆、基因组序列分析及慢病毒载体构建*
苏胜彦,董在杰,3,袁新华,梁政远,曲疆奇,张建桥, 刘 伟, 马良骁,徐 跑
(1.南京农业大学无锡渔业学院,江苏 无锡214081; 2.中国水产科学研究院淡水渔业研究中心∥农业部淡水渔业和种质资源利用重点实验室,江苏 无锡214081;3.南京农业大学动物科技学院,江苏 南京 210095)
建鲤作为经国家审定的我国第一个人工育成的水产养殖品种,其生长速度快,抗病力强。然而经过十几年的推广,迫切需要进一步的遗传改良,进行水产养殖品种的更新。而杂交育种是目前成效比较显著的鲤育种方法之一[1-2],建鲤、丰鲤、荷元鲤等就是杂种优势利用的成功典范[3]。国家现代农业产业技术体系建设专项资金项目和国家“十一五”科技支撑计划项目等都将建鲤的遗传改良列入其中,并在2010年获得福瑞鲤水产良种。而建鲤生长速度的分子标记,尤其是是改良过程中超显性优势相关分子标记,已成为提高建鲤选育效率的重要途径。
IGF2(类胰岛素生长因子2,Insulin-like growth factorⅡ,IGFⅡ)是一种促细胞分裂多肽,其结构与胰岛素相类似[4],在所有胰岛素的靶细胞中发挥类胰岛素的功能。除此之外,更为重要的是其可作为生长激素的中间信使,传递生长激素,对机体的生长和发育起作用[5]。在动物上,IGF2 的表达水平与动物骨骼肌的发育调控有关[6],是影响猪产肉性能的主要功能基因之一。
在鱼上,虹鳟的IGF2 cDNA被首次克隆出来的[7],此后,鲷[8],澳洲肺鱼[9],罗非鱼[10],杜父鱼[11],斑马鱼[12],河豚[13],大菱鲆[14],大麻哈鱼[15]等多种硬骨鱼类和软骨鱼类的IGF-2被全部或部分克隆。2002,Tse等[16]克隆了鲤鱼IGF2序列,并对其组织表达做了分析。对于鱼类的IGF2基因结构,大麻哈鱼[15],澳洲肺鱼[9]和河豚(基因库新No.AL021880)已经确定。大麻哈鱼,澳洲肺鱼和河豚的IGF-2基因由4个外显子和3个内含子构成,分别跨越约7.9、5.5、4.2 kb染色体DNA。
IGF-2基因在未成熟的和成熟的硬骨鱼的肝组织和非肝组织中充分表达,包括鲤鱼[16],虹鳟鱼[17],斑马鱼[12],杜父鱼[11],罗非鱼[18],鲷[19]及河豚[13]。在虹鳟鱼的肝,肠道组织(体内)和培养的肝细胞(体外)[20]以及在鲤鱼的脑,鳃,肠,肾,肝,肌肉[16]中用GH处理,可增加IGF2 mRNA含量。Chen等[21]用重组IGF2腹腔注射罗非鱼5周后,体质量和体长分别较对照组增加了72%和34%。这些说明,IGF2基因表达量与鱼类生长速度密切相关,这就为建鲤高生长速度的特性提供研究途径。
慢病毒载体( lentiviral vector)源于HIV1[22-23],是以慢病毒基因组为基础,除去其复制所需的基因,以治疗性基因和选择性标记物构建而成,转移基因片段容量大,无毒性且不易诱发宿主免疫反应,安全性较好,不仅能感染分裂细胞,且能转染终末分化细胞和非分裂细胞(如神经细胞、干细胞、肌纤维细胞、视网膜和肝细胞等),整合于靶细胞基因组的目的基因能够长期、稳定表达[24]。慢病毒载体常常用于研究基因表达的调控[25]、转基因动物的制作[26]、疾病机理与治疗[27]等。其中,慢病毒载体用于基因功能的研究[28-30],功能基因用于疾病治疗、转基因动物的生产[31]、农业上提高生产性能[32-33]等方面成为其应用的热点。因此,通过注射IGF2基因慢病毒载体将是研究IGF2基因体内、体外过表达的重要手段。
本研究利用PCR扩增的方法,根据斑马鱼IGF2基因序列的剪切方式,在鲤IGF2b基因mRNA序列上设计4对引物,首次克隆测序了鲤该基因的全部内含子,并推断出鲤IGF2b基因的结构;分析了该基因序列的CpG岛和重复序列,并构建了IGF2基因的慢病毒载体,为研究IGF2b基因在鲤生长发育、产肉性能等方面奠定基础。
1 材料及方法
1.1 实验材料
建鲤取自中国水产科学研究院淡水渔业研究中心宜兴试验基地。试验所用细胞株为293T细胞,为贴壁依赖型成上皮样细胞,细胞生长所需培养基为DMEM+10%FBS(w),使用的质粒载体为pLenti6.3- IRES-EGFP质粒。
1.2 总DNA提取和PCR扩增,测序
鲤基因组总DNA提取采用Takara全血基因组试剂盒,后进行凝胶电泳检测提取DNA的质量,用分光光度计测算DNA浓度。根据鲤IGF2基因的cDNA序列(AF402958)设计引物(见表1)。

表1 鲤IGF2b cDNA和DNA扩增所需引物
PCR 反应体系为 25 μL,包括 10×buffer 15 μL,Mg2+(25 m mol/L)1 μL, dNTPs(各 2 mmol/L )1 μL, 上下游引物(10 mmol/L )各1 μL模板 DNA 1 μL, TaqDNA聚合酶(Promega)1 U,补dd H2O至反应体系,扩增反应均在TAKARA公司梯度PCR仪上完成,PCR 反应程序为: 94 ℃预变性3 min;94 ℃ 变性20 s,退火温度48~58 ℃ 20 s,72 ℃延伸30 s,28个循环;72 ℃ 延伸10 min 将反应后的 PCR 产物用w=8%非变性聚丙烯酰胺凝胶电泳结合goldview显色进行检测,溴酚蓝为上样液(w=0.25%溴酚蓝,w=40%蔗糖水溶液),UVP扫描仪扫描成像,拍照,送往公司测序。
1.3 慢病毒载体的构建
1.3.1 RNA提取和反转录 每50~100 mg组织加入1 mL Trizol,用匀浆器进行匀浆,直至匀浆液无颗粒透明状,将裂解液转移至离心管中,在室温下放置5 min,使得核酸蛋白复合物完全分离。4 ℃ 12 000 r/min离心15 min,然后小心吸取上清,并转移至新的无RNase的离心管中。每管加入200 μL氯仿,用手上下颠倒ep管15 s,室温静置15 min,4 ℃,12 000 r/min,离心15 min。吸取上清移至新的1.5 mL ep管,加入等体积-20 ℃预冷的异丙醇,混匀后-20 ℃沉淀10 min。4 ℃,12 000 r/min离心10 min后,去上清,加入至少1 mL 4 ℃预冷的φ=75%乙醇,洗涤沉淀,4 ℃,10 000 r/min离心5 min,弃上清。吸水纸吸去残液,室温干燥。加入20 μL RNase-free水,至完全溶解,紫外分析测定所抽提RNA的浓度。根据Fermentas公司的M-MLV 操作说明书进行反转录。
1.3.2IGF2b基因CDS区扩增 针对鲤IGF2b基因(AF402958)的CDS(Coding domain sequence )区序列设计并合成PCR 引物(序列见表2),并在目的基因的5’端添加BamHI酶切位点,3’端添加NheI酶切位点。
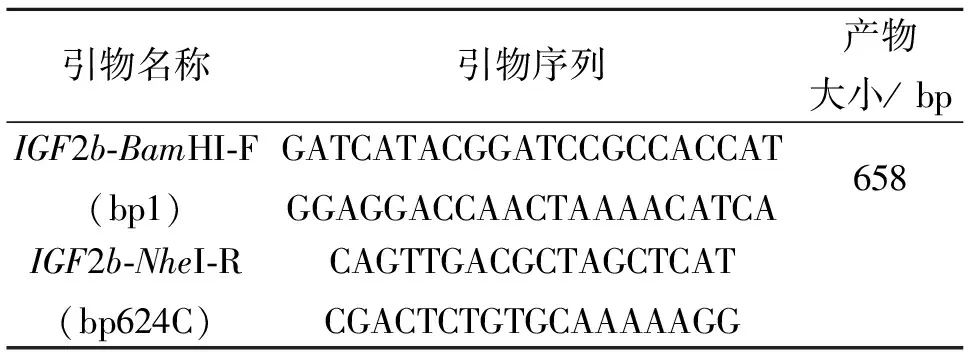
表2 扩增IGF2b基因编码区全长的引物序列
PCR 反应体系为50 μL,包括 10×buffer 5 μL,Mg2+(25 m mol/L)2 μL, dNTPs(各 2 mmol/L )1 μL,上下游引物(10 mmol/L )各1 μL模板 DNA 1 μL, TaqDNA聚合酶(Promega)1 U,补dd H2O至扩增反应体系,在TAKARA公司梯度PCR仪上完成,PCR 反应程序为: 94 ℃预变性3 min;94 ℃变性20 s,退火温度58 ℃ 20 s,72 ℃延伸30 s,28个循环;72 ℃延伸10 min 将反应后的 PCR 产物用w=8%非变性聚丙烯酰胺凝胶电泳结合goldview显色进行检测,溴酚蓝为上样液(w=0.25%溴酚蓝,w=40%蔗糖水溶液),UVP扫描仪扫描成像,拍照,然后用T载体连接,后将菌落PCR呈阳性的质粒进行酶切鉴定,酶切体系如下:10×Buffer Tango 2 μL,重组质粒1 μg,限制性内切酶BamH 10.25 μL,限制性内切酶NheⅠ 0.25 μL,补ddH20至20 μL。将菌落PCR和酶切鉴定均呈阳性的克隆送测序,并进行序列比对。
1.3.3 慢病毒表达载体pLenti6.3-IGF2b-IRES-EGFP的构建 与上述方法类似,以T-IGF2b载体为模板,PCR扩增目的片段,在目的片段两端添加酶切位点BamHI和NheI。PCR反应体系和循环体系参照上文所述。回收PCR产物,用BamHI和NheI双酶切PCR回收产物及载体pLenti6.3- IRES-EGFP,将酶切回收的目的基因IGF2b片段与pLenti6.3- IRES-EGFP连接,室温连接4 h。取10 μL连接液转化DH5α感受态细胞,挑取单菌落进行菌落PCR,后将菌落PCR鉴定呈阳性的质粒进行酶切鉴定,将菌落PCR和酶切鉴定均呈阳性的克隆送测序,并进行序列比对,保留测序验证正确的质粒。
1.3.4 慢病毒包装、转染193T细胞 将测序正确的pLenti-IGF2b-IRES-EGFP及对照质粒pLenti-EGFP 菌液划线培养,并测定质粒浓度:质粒DNA 最终溶于除菌的TE 中,以Thermo Nanodrop仪器测定质粒浓度及纯度,保证抽提质粒的浓度在1 μg/μL左右。
转染时(细胞状态良好,贴壁牢,密度在50-70%时可用于转染),向无菌的1.5 mL离心管中加入750 μL Opti-MEM,然后向其中加入所制备的各DNA 溶液,慢病毒表达质粒6 μg,包装质粒Packaging Mix 6 μg,混合均匀,在室温下温育5 min。同时,在另一无菌的1.5 mL离心管中加入750 μL Opti-MEM,向其中加入POLOdelivererTM3000 Transfection Reagent 24 μL ,轻轻混匀,室温下温育5 min。把稀释后的DNA 与稀释后的POLOdelivererTM3000 Transfection Reagent混合,轻轻地颠倒混匀,不要振荡。此步必须在5 min之内混合,混匀后,在室温下温育20 min,以便形成DNA 与POLOdelivererTM3000 Transfection Reagent 的复合物。取1.5 mL DNA与POLOdelivererTM3000 Transfection Reagent混合液均匀地滴加在293T 细胞的培养液中,前后左右摇匀,于37 ℃,φ=5% CO2细胞培养箱中培养。
转染后 48 h(转染即可为0 h计起),收集293T 细胞上清液(第1次收液)。细胞更换新鲜的完全培养基,继续培养至72~80 h,收集病毒上清,与第1次收集的混合,共20 mL。于 4 ℃,3 000 r/min 离心10 min,除去细胞碎片,每管装1 mL病毒,-80 ℃保存。
1.3.5 慢病毒滴度测定(荧光显微镜观察法)感染前1 d,用胰蛋白酶消化细胞并计数,准备5×105细胞/mL 的293T细胞接种24孔板,每孔0.5 mL。细胞接种后第2天,根据病毒的预期滴度,准备3个无菌的EP管,10倍倍比稀释慢病毒浓缩液。
13 μL 慢病毒原液 + 117 μL DMEM → 10-1病毒液
13 μL 10-1病毒液 + 117 μL DMEM → 10-2病毒液
细胞换液,每孔内加入500 μL无抗生素的DMEM+10%FBS(w)培养液,除control组外其余各孔均加入polybrene至终浓度为8 μg/mL。各感染孔内分别加入相应稀释度的病毒液及病毒原液100 μL,放入37 ℃、φ=5% CO2的培养箱内。感染24 h后,换液,每孔内加入500 μL DMEM + 10% FBS(w)+ 1% Pen-Strep(w),继续放回培养箱内进行孵育。感染72 h后观察荧光表达情况,选取合适的稀释度对应的孔,对GFP阳性的细胞进行计数,并依此计算待测慢病毒的滴度。
计算滴度:
计算感染形成单位(ifu/mL):
1.3.6 病毒液目的基因检测 将处于对数生长期的目的细胞进行胰酶消化,制成细胞悬液。将细胞悬液(细胞数约为5×104)接种于24-well 中,37 ℃φ=5%CO2培养箱培养待细胞融合度达到约80%。分别加入50 μL目的及对照病毒液,同时加入终质量浓度为8 μg/mL的Polybrene促进感染。感染24 h后,换液,每孔内加入500 μL DMEM + 10% FBS(w)+ 1% Pen-Strep(w),继续放回培养箱内进行孵育。感染48 h后观察慢病毒上报告基因GFP的表达情况,并拍照记录感染结果。后收集细胞用于RNA提取。此时荧光率应该大于80%者,若感染效率低于80%的实验组,重新进行感染实验。弃细胞上清,每孔加入1 mL Trizol裂解细胞,抽提RNA,经DNaseI处理后将RNA反转录成cDNA,实时荧光定量PCR检测IGF2b基因表达。
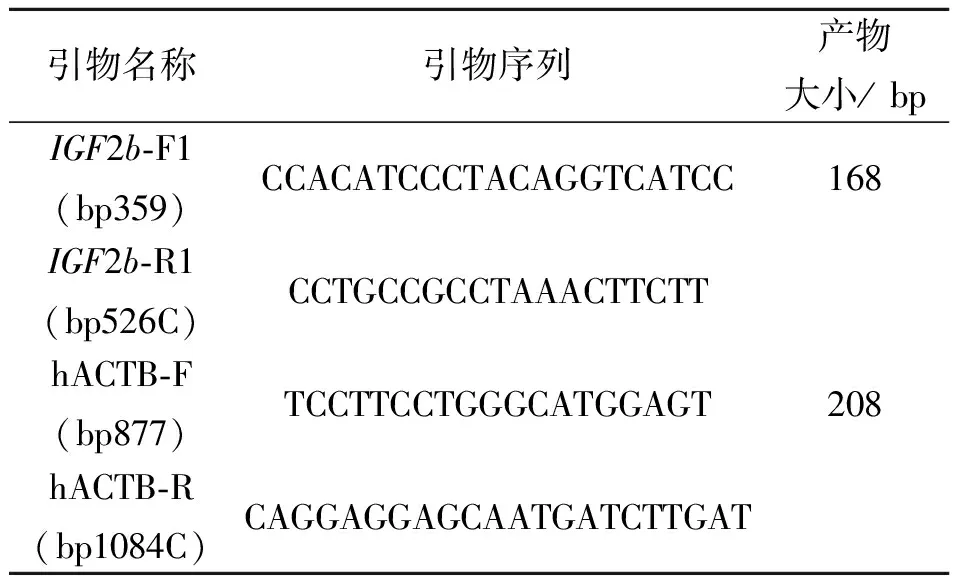
表3 荧光定量PCR所需引物
1.4 数据分析
序列比对通过NCBI数据库中Blast进行,CpG岛预测通过在线软件MethPrimer进行,重复序列预测采用RepeatMasker进行;试验数据在Microsoft Excel表中初步整理后,使用SAS8.0分析。
2 结 果
2.1 IGF2b基因组DNA序列
依据鲤IGF2基因的cDNA序列(AF402958)设计引物(表1),从鲤基因组DNA中获得的扩增片段回收测序,获得5 173 bp长度的基因组DNA序列(图1)。本序列已提交给GenBank(Accession No.HM755899)。从图1可以看出,鲤IGF2b基因的基因有内含子为3个,长度分别为1 275、1 825、878 bp。
GGGGAAACTAAACCGACATTCTTAACCAAATACAACAACAC
AGCATTTTTTTCCCTTTTTTTTCTTTTTTCTTTTTCTTTTTTTTT
ATGTTGACATGGAGGACCAACTAAAACATCATTCTTTGTGC
CATACTTGTTTGAGAACAGACAGTGTCATAAATAAGGTaaaga
aagacttttttacaacctttacggaatcttggacatatctgcgatgagtgcaatagttaagctct
cttaaacagaaaaaaaaaactcgtttttatagacttgcaaaaatagaatcgtatttttaaaat
gagaaattgacatgatcggaaacgataagatttttagacgcattttctcttgcacgagcgatt
cgcgtaatgcattggagatgtttttgtcactctaaattcattacagtttcacagcactgaacttct
aaataaggtctatacgccattgtaaacatttaccctatgcatttctgcgaagctgctttgaaact
gtgtgtattttgaaaagcgctttccaaatgaaaactgacttgacactttattctggatacgcgc
gagcaggagaaagaagctacgcaagggggcgacagcactttaaatggtctggatttaag
gaaattatatgctgagttgtgaggaataagatagctgggtattttgagcagtcttgcaacttg
ctgaacgttgtgtaagagtgtaaagaagctctttgataacaattcatcctctagcgttaagca
gataatcaaaaagtcgatgcatgcatgtagaattccaatgtatttgaagaattgcgttgacg
aatttaatgcactagaggaacgaggttgaggataattgatcagcagttcgaccttaaagca
tcatatttacggttaaaaattacttgcataattgaaaaagctggaggtcatgcatgcatacaa
attctcagaatgtataaagaactgcatagaagaaatcagtgcattgaagaaacaaattac
agttcctcaagatctgaccaacaacactgcaatttaagttaaaaatgtttagtattattaatca
gcagatatatggctcttgctcttgcattatattgcacaaatagtgcattttatagcctactttgac
aaaattgtgaactataatgcatgctttccaggtcatgaagacacgcttttccatagtgtaaatt
gacatgctgattttgaccatgtaatcaggcatataattgaaaaatcgatggccatgcatgcac
acactgaaggattgcattactgaattcaatgcctcgaggaagctaataatagttacttaagg
aaaacgttcagtattaagttcaggtatacatgggatcttcataaaaacaaaaaaaacagca
gctttatatattgaaaatgaaatgcacaagttaaaactgtctaaactaactaaaacacgttat
ctccgcaggtCATAAAGATGTACTGGTCCATACGAATGCCCATAT
GCATACTCTTTTTAACCCTGTCTGCCTTCGAAGTGGCTTCAGC
TGAAACATTATGTGGCGGAGAGCTGGTGGACGCGCTACAGT
TTGTGTGTGAAGATAGAGGTTTCTATTTCAGTaagtacatttgcacat
cgtattttctttgcttttgcttaggagttggaaacccttgccaattgtatgtcacgaatgaccaga
gttacgagcggagtctcagcagattgtgctgacttggcgcattctctcgcgatatctgtgattgc
atatgaaagggatgcaaaattagccacaatggcctggttgtttacttgcacattccgtcaggg
aaagtaatagtacccaagtggcattccattcacctctccagaaatgttcccaggctacactca
attgaaaaaaaagttgtttgtcctcttacacggctggatggattgagacagcttcattactagt
ttagcgtaacagatactaaccaatacgttcaatacagtgcttgccaatagtacaatccgaatc
aagatacatctgctggttgtacaccactcgcatgcaaggagggggtcgagagcacaactttt
taaatatttgtcgtcttcctcacgccagcactgacacacagacaaggcctttgtgttcttttggcc
gcagaagcctaactaccccgaaagatcattatccaatttgggccagtgcagattttcccccctc
tatccaccagatccactcttgttcaatgtttcccatcctacaatcaagaactccctttcagaacatt
gcgactgtgagaagcgaaaatcgttcgtggtatatttgactgaaaatcaattgttccttcctttt
cccagtccggctccctcccctccattactgtgtcctgtatctttgctctttcgtgccaagtctgttcttc
cacccctcccccttcctctctttcatgctctctttatctctgctgagctggcaaaggacaaggtcaa
aggatatccaccatttactcatccaaacagaagcgaagacttttgccctttaactctcacgctgt
cttatttgcagactttcacgttcctgggaacgtgctgccggcgaattcttcgaaaactatttcaa
acagctcaattagacggcaaaacaaaatcagtccgggtgaaaaaaaaactccattttatgc
cacagatttgggctttattatactccgcaattgcgtcccagtcaaaacccaatggattgataat
gaaatctgctttgacaattgaatcagaccactgtagcttgatttacattgacttgttagtagggt
ttgttgaacgtgtttgcatgtttgatgatgactgattagacagtttaagacaaatctttttcttgct
ataacagctcaaacaagctagtttcctagtcttagtttcctggtttaagattgtcttccagcatgg
ctattttggtgttccggtattagttcttttttccacttttcagctagtcactctggatgtctagctaga
cacccagataaacaccaacttggccgggcttggagactagcttaaaacaggaatgactag
caaaccagcttagggttgtttacccaggatttttcagtagagttagctggtcatacagctcttct
ccgaacttgactagttgacccaaaagaagcaaaatctgtcaacatttactctcccttatgtcctt
ccaaagctgtatatcttttttctgaggatcaagatactttgaagaacataggaactgtccacgc
aacaaaagtcaaattcaatggtgttcaaaacaatgactttcattgcctggacaaaaaatgg
tttgaaacacatgtttggaattgagagtgagtaaataatgagggagttgagtgattttgtctg
aaatgtaaccagaacaatactaaagtgtcttgaactcatgatcctcatttgtatctctgcaggt
CGACCAACTAGCAGGTTGAGCAGTCGACGTTCTCAAAATCGT
GGGATTGTGGAAGAGTGTTGTTTTAACAGTTGTAACCTAGCT
CTTCTAGAACAGTACTGCGCTAAACCTGCCAAGTCAGAGAG
GGACGTTTCAGCCACATCCCTACAGGTCATCCCGGTGATGCC
CACATTAAAACAGGtacgttggctgtgagaaacaacaaaaactctccagcacttt
atcacgctcaccatcttgatcgtcctgttctttctgctgaacttgtgcatactggcatgtgggttaa
agaaaacagtcagcctgagtaaggaactagtaagcaagtattgccccaatactgctgacc
aagtggaaaatgatatgatagaaaaggtcatacatagtttgaaattttcctgttgatttgaca
tcacatggattgggttacaaaaccagtctctcaaaatggcctggatgttgactagatggttgt
acactggggacaaatggaactgccattaccccctacttatcattctccattttgagttttcattga
gttttgctctgttagtatgtttaatatatgcttaagagatagtttgcccaaaattcatcatttcctca
ccatcatgttcttccaaaactttacgactttcttctgtggagcacaaaagaaggtattttaatta
atttttcaacttttttttgtccatacaaagaaagacattggggtccaaaacaacaatgaaccc
cactgagtttcactgtatggataaaaaacaaaacaaaaaacaaaactaggaaactatttg
aaggtatatgagggtgagaaactgatcaaagaattgtattttttaggtgaactaacccttta
aggaatatgagaattgggcaagagaaattcaagtggatgctcaagttgttgtcttggtgga
tttttgcstatttttgacaaaatatctgcaaagtcatttacagaagtttgagttttatagggtcatc
cagtagaatctgtgagaattctgacctttctctagagtcagttcctaacgttattgttattcttgca
acaggAGGTCCCAAGAAAACATGTGACCGTGAAATATTCCAA
ATACGACATGTGGCAACGAAAGGCYGCCCAGAGGCTACGGA
GGGGCGTCCCCGCCATCCTGCGGGCCAAGAAGTTTAGGCGG
CAGGCGGAGAGAATCAGGGCCCAAGAGCAACTGCACCACCA
CAGGCCTCTCATCACGCTTCCCAGCAAGCTCCCGCCCATCCT
TTTTGCACAGAGTCGATGAAAAAAGACCAGGGGATCAAAGC
TTTTTGTCTCTGACG TCATTTCTGTGGCAGTCCTCAACAACC
CTTCTTCCTTCCCCACCAGACGTGCTCACGCGCTCTTCCAGTT
ACTATTCTTGCTGTTTCGTTCATCAACAAAAATGCACATCAC
AAACGAGAGGAACACAATTCAGGTGAAGAAGCAAAGGAAA
GAACAAAGAAGCCGCAGAGCGCCGAATGTTTCACTGGTTTG
GAGGACATCGGCGCGCGAGGAACAGCTTGAGCTAGCATGAA
AGAACCCATTCCACTGCATTCTCCCGAGACAAAAGTATCTCT
CTTTTAGTCCTTTTACATACTAGTTTGCACCTGTAACTATAAA
GGGACATCCACACTGTAAGGAATTGTTGTAAAATTAGATTCC
TGTTCCAGCACCTTGTAATCACAAATGAAAAGCAGAGAAGA
ATCTGCGAATTGCACATCGCCACGGATTACGTCCAAGT
图1IGF2b基因的DNA序列
Fig.1 DNA sequence forIGF2bgene(斜体小写字母表示内含子序列)
2.2 DNA序列分析
鲤IGF2bDNA序列在GeneBank上比对,发现与斑马鱼IGF2b基因(NW_003041001.1)相比,相似性为88%;都有3个内含子,其长度不同。通过在线软件MethPrimer软件进行该序列的CpG岛预测发现,在区域4 497-4 504和 4 878-4 979上有2个CpG岛,全部位于3‘非翻译区。通过在线软件RepeatMasker预测其重复序列,发现在区域46-86上存在(T)n重复。
2.3 慢病毒载体的构建
2.3.1 鲤IGF2b基因的ORF(open reading frame)克隆和重组克隆的菌落PCR鉴定 根据基因库鲤IGF2b基因序列,设计引物,扩增其CDS区,用连接PCR产物后的T载体做模板,扩增IGF2b基因电泳图见图1,而进行慢病毒载体包装后的质粒载体做模板获得的电泳图见图2。从图1和图2中可以看出,2次获取的基因片度长度是一致的,而且重复性也好。经过测序与已知序列一致。
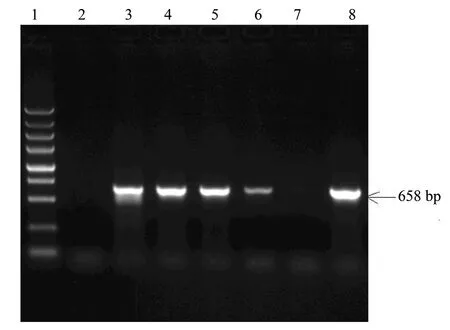
图2 T-IGF2b重载体菌落PCR产物鉴定
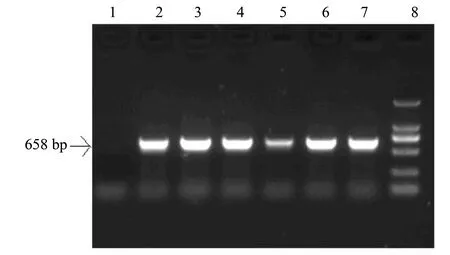
图3 pLenti6.3-IGF2b-IRES-EGFP重组载体菌落PCR鉴定
2.3.2 慢病毒表达质粒及包装质粒共转染293T细胞 构建的IGF2b基因慢病毒载体感染193T细胞后在荧光显微镜下观察图如下:从图中可以看出,对照和含有IGF2b基因的质粒均有GFP表达,说明包装没有问题,但IGF2b的表达还需进行收毒、实时荧光定量PCR检测。
2.3.3 慢病毒滴度测定 为了确定构建的慢病毒载体的浓度,并能为下步慢病毒感染细胞、活鱼做基础,我们用荧光显微镜进行了滴度测定。本文从20倍物镜×10倍目镜下,从10-2孔内各随机选取3个视野,加入病毒液的体积=100 μL,获得了pLenti-IGF2b的滴度为:ifu/mL =5.54 ×106,而阴性对照Lenti-EGFP NC滴度为:3.04 ×106。
2.3.4IGF2基因在293T细胞中表达的检测 为了检测构建的慢病毒载体对细胞的感染能力,本文通过RealtimePCR技术检测了IGF2b基因在293T细胞中的表达情况(图4-6),图5为IGF2b基因以及内参基因hACTB的扩增曲线,图6为这2基因的溶解曲线,从图中可以看出扩增曲线为光滑的S形曲线,溶解曲线为单一峰值,故特异性和扩增量都满足要求。从图7可以看到,用构建的IGF2b基因慢病毒载体感染293T细胞后,检测到了IGF2b基因的表达,从而证明了构建的IGF2b基因慢病毒载体是成功的。

图7 Lenti-IGF2b感染293T的表达检测
3 讨 论
3.1 鲤IGF2基因的结构
本文通过基因库中Blast检测鲤IGF2基因的序列的同源性,发现其更接近于斑马鱼IGF2b基因。因此,本文选用建鲤作为试验材料,以该基因在斑马鱼上的剪切方式设计引物,扩增鲤鱼IGF2b基因的内含子。同时本课题组以斑马鱼IGF2a基因设计引物,扩增出了IGF2a序列。因此,本文扩增出的内含子是鲤IGF2b基因的内含子。
鲤IGF2b基因的基因有内含子为3个,长度分别为1 275、1 825、878 bp。这个结果与大麻哈鱼[15],澳洲肺鱼[9]和河豚(基因库新No.AL021880)已经确定的IGF2基因结构一致。另外,在鲤IGF2b3′非翻译区域存在2个CpG岛,内含子中没有检测到CpG岛。通过在线软件RepeatMasker预测其重复序列,发现在区域46-86上存在(T)n重复,位于5′非翻译区。
3.2 鲤Lenti-IGF2b-IRES-EGFP载体
目前,普遍使用的载体系统包括病毒载体和非病毒载体两类,其中非病毒载体安全性较高,但是转染效率低[34],而病毒载体应用较为普遍[25-26,32,35]。与其它病毒载体相比,慢病毒载体最大的特点就是强大的穿透性[36],并能感染非分裂期细胞从而实现目的基因稳定表达,因此越来越受到神经科学、基因功能研究、基因表达、转基因动物、农业生产的重视[25-26,28,32,37]。因此本文采用分子克隆的方法成功构建了一种新型的慢病毒载体质粒Lenti-IGF2b-IRES-EGFP,并利用质粒共转染的方法产生了完整的慢病毒载体。Lenti-IGF2b-IRES-EGFP载体含有GFP报告基因,具有很强的实用性,同时GFP报告基因以CMV启动子启动,其表达效率高,能达到95%以上,观察结果方便快捷,为后续研究,尤其是研究IGF2基因过表达对鲤生产性能的作用奠定基础。
参考文献:
[1]BAKES J,GORDA S.Genetic improvement of common carp strains using intraspecific hybridization[J].Aquaculture,1995,129:183-186.
[2]LINHART O,GELA D,RODINA M,et al.Top-crossing with paternal inheritance testing of common carp(CyprinuscarpioL.)progeny under two altitude conditions[J].Aquaculture,2002,204: 481-491.
[3]楼允东.鱼类育种学[M].北京:中国农业出版社,1999:40-107.
[4]RINDERNECHT E,HUMBEL R E.The amino acid sequence of human insulin like growth factor 1 and its structural homology with proinsulin[J].J Biol Chem,1978,253(8):2769-2776.
[5]VASILATOS Y R,SCANES CG.Growth hormone and insulin-like growth factor in poultry growth: required,optimal or ineffective[J].Poultry Sci,1991,70: 1764-1780.
[6]FLORINI J R ,EWTON D Z ,MCWADE F J.IGFs,muscle growth ,and myogenesis[J].Diabetes Rev,1995,3:73-92.
[7]SHAMBLOTT M J,CHEN T T.Identification of a second insulin-like growth factor in a fish species [J].Proc Natl Acad Sci USA,1992,89:8913-8917.
[8]DUGUAY S J,LAI-ZHANG J,STEINER D F,et al.Developmental and tissue-regulated expression of IGF-I and IGF-II mRNAs in Sparus aurata[J].J Mol Endocrinol,1996,16: 123-132.
[9]COLLET C,CANDY J,RICHARDSON N,et al.Organization,sequence,and expression of the gene encoding IGFII from Barramundi(Teleostei; Lates calcarifer)[J].Biochem Genet,1997,35: 211-224.
[10]CHEN J Y,CHANG C Y,CHEN J C,et al.Production of biologically active recombinant tilapia insulin-like growth factor-II polypeptides in Escherichia coli cells and characterization of the genomic structure of the coding region[J].DNA Cell Biol,1997,16: 883-892.
[11]LOYNG-CUENI D,SCHMID A C,REINECHE M.Molecular cloning and tissue expression of the insulin-like growth factor II prohormone in the bony fish Cottus scorpius[J].Gen Comp Endocrinol,1999,113: 32-37.
[12]MAURES T,CHAN S J,XU B,et al.Structural,biochemical,and expression analysis of two distinct insulin-like growth factor I receptors and their ligands in zebrafish[J].Endocrinology,2002,143: 1858-1871.
[13]AYSON F G,DE-JESUS E G,MORIYAMA S,et al.Differential expression of insulin-like growth factor I and II mRNAs during embryogenesis and early larval development in rabbitfish,Siganus guttatus[J].Gen Comp Endocrinol,2002,126: 165-174.
[14]DUVAL H,ROUSSEAU K,ELIES G,et al.Cloning,characterization,and comparative activity of turbot IGF-I and IGF-II[J].Gen Comp Endocrinol,2002,126: 269-278.
[15]PALAMARCHUK A,GRITSENKO O,HOLTHUIZEN E,et al.Complete nucleotide sequence of the chum salmon insulin-like growth factor II gene[J].Gene,2002,295: 223-230.
[16]TSE M C,VONG Q P,CHENG C H,et al.PCR-cloning and gene expression studies in common carp(Cyprinus carpio)insulin-like growth factor-II[J].Biochim.Biophys.Acta,2002,1575: 63-74.
[17]AEGERTER S,JALABERT B,BOBE J.Messenger RNA stockpile of cyclin B,insulinlike growth factor I,insulin-like growth factor II,insulin-like growth factor receptor Ib,and p53 in the rainbow trout oocyte in relation with developmental competence[J].Mol Reprod Dev,2004,67: 127-135.
[18]CAELERS A,SCHMID A C,HRUSOVSKY A,et al.Insulin-like growth factor II mRNA is expressed in neurones of the brain of the bony fish Oreochromis mossambicus,the tilapia[J].Eur J Neurosci,2003,18: 355-363.
[19]PERROT V,MOISEEVA E B,GOZES Y,et al.Insulin-like growth factor receptors and their ligands in gonads of a hermaphroditic species,the gilthead seabream(Sparus aurata): Expression and cellular localization[J].Biol Reprod,2000,63: 229-241.
[20]SHAMBLOTT M J,CHENG C M,BOLT D,et al.Appearance of insulin-like growth factor mRNA in the liver and pyloric ceca of a teleost in response to exogenous growth hormone[J].Proc Natl Acad Sci USA,1995,92: 6943-6946.
[21]CHEN J Y,CHEN J C,CHANG C Y,et al.Expression of recombinant tilapia insulin-like growth factor 1 and stimulation of juvenile tilapia growth by injection of recombinant IGFs polypeptides[J].Aquaculture,2000,181: 347-360.
[22]WONG L F,GOODHEA L,PRAT C,et al.Lentivirus-mediated gene transfer to the centralnervous system: therapeutic and research applications[J].Hum GeneTher,2006,17(1): 1-9.
[23]JAKOBSSON J,LUNDBERG C.Lentiviral vectors for use in the central nervous system[J].Mol Ther,2006,13(3): 484
[24]COCKRELL A S,KAFRI T.Gene delivery by lentivirus vectors[J].Mol Biotechnol,2007,36(3):184-204.
[25]CHUMAKOV S P,KRAVCHENKO J E,PRASSOLOV V S,et al.Ef?cient downregulation of multiple mRNA targets with a single shRNA-expressing lentiviral vector[J].Plasmid,2010,63: 143-149.
[26]RAMOS O S,CARRATALA Y P,PUERTA S G,et al.Dual promoter lentiviral vector generates transgenic mice expressing E2-CSFV glycoprotein in their milk,but impairs early identi?cation of transgenic embryos[J].Theriogenology,2011.
[27]WITCHER M,EMERSON B M.Epigenetic Silencing of the p16INK4a Tumor Suppressor Is Associated with Loss of CTCF Binding and a Chromatin Boundary[J].Molecular Cell,2009,34,271-284.
[28]ZHANG L,PROCUIK M,FANG T,et al.Functional analysis of the quantitative expression of a costimulatory molecule on dendritic cells using lentiviral vector-mediated RNA interference[J].Journal of Immunological Methods,2009,344: 87-97.
[29]刘真,甄艳,于晓黎,等.人NESG1基因慢病毒载体的构建及其在293FT细胞中的表达[J].南方医科大学学报,2011,31:65-68
[30]汤展毅,严云勤,高学军,等.牛myf6基因真核表达载体的构建及在成肌细胞中的表达[J].中国农业科学,2010,43(13):2793-2799.
[31]MOTONO M,YAMADA Y,HATTORI Y,et al.Production of transgenic chickens from purified primordial germ cells infected with a lentiviral vector[J].Journal of Bioscience and Bioengineering,2010,109: 315-321.
[32]KEEN J E,HUNGERFORD L L,LITTLEDIKE E T,et al.Effect of ewe ovine lentivirus infection on ewe and lamb productivity[J].Preventive Veterinary Medicine,1997,30: 155-169.
[33]BLASCO A.The role of genetic engineering in livestock production[J].Livestock Science,2008,113: 191-201.
[34]沈媛,彭辉,冯敏,等.构建HMGB1/PEI非病毒载体介导高效基因传递的研究[J] .中山大学学报:自然科学版,2009,48(5):91-96.
[35]钟建辉,银巍,藏林泉,等.腺病毒载体介导的大鼠DNA多聚酶p重组体的构建及其在PC12细胞中的表达[J] .中山大学学报:医学科学版,2005,6(26):622-625.
[36]AZZOUZ M,KINGSMAN S M,MAZARAKIS N D.Lentiviral vectors for treating andmodeling human CNS disorders[J].J GeneMed,2004,6(9): 951-962.
[37]VERCAMMEN L,VAN DERPERREN A,VAUDANO E,et al.Parkin protects againstneurotoxicity in the 6-hydroxydopamine ratmodel forParkinson’s disease[J].MolTher,2006,14(5): 716-723.

