抗肿瘤化合物6-溴代吲哚-3-甲醇的设计合成*
陶炳志,陈河如,2
(1.暨南大学药学院中药及天然药物研究所,广东 广州 510632;2.广东省中药药效物质基础及创新药物研究重点实验室,广东 广州 510632)
吲哚-3-甲醇(indole-3-carbinol,I3C)是从十字花科蔬菜中分离得到的活性成分,对癌细胞具有很好的抑制活性。1978年,Wattenberg和Loub首次报道了吲哚-3-甲醇可以抑制多环芳烃诱导的大鼠肿瘤,还证实了I3C具有抑制自发形成的或由化学物质诱导产生的癌症的作用[1]。研究表明,吲哚-3-甲醇对人体的肺癌、子宫颈癌和乳腺癌有显著的抑制活性[2],有可能成为一种新型的防癌药物。
实验结果揭示,吲哚-3-甲醇在酸性环境中会发生聚合反应,形成二聚物、三聚物和环状聚合物,这些聚合物正是I3C在体内产生抗肿瘤作用的真正实体分子[3-4],这阐明了为什么I3C口服有效,而腹腔注射无效的内在原因。目前认为,吲哚-3-甲醇之所以对肿瘤细胞具有抑制作用在于其对体内致癌物的代谢解毒作用以及对各种解毒酶如AFB1-8,9-环氧化酶、苯并芘羟化酶(BPOH)、环氧水合酶(EH)等的影响[5-8]。

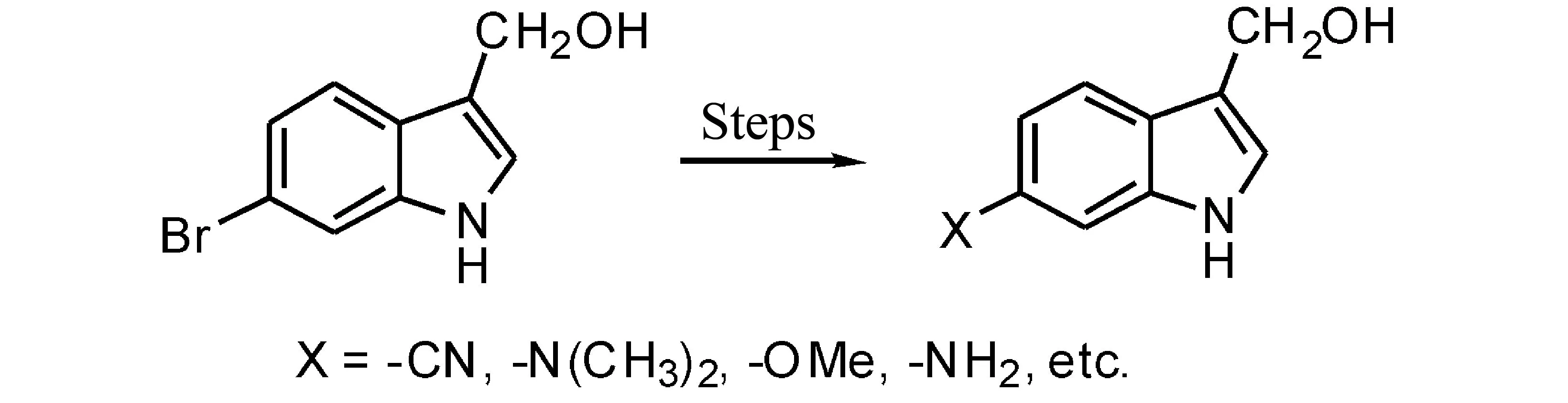
图1 由6-溴代吲哚-3-甲醇转换为吲哚-3-甲醇衍生物
1 仪器与试剂
Bruker Advance 400核磁共振仪(Brucker Biospin公司,瑞士,TMS为内标); Finnigan LCQ Advantage MAX质谱仪(Thermo Finnigan公司,美国);柱色谱用硅胶(青岛海洋化工厂);硅胶GF254薄层预制板(烟台化学工业研究所);邻硝基甲苯、1,3-二溴-5,5-二甲基咪唑-2,4-二酮和浓H2SO4购自天津化工厂,N,N-二甲基甲酰胺(DMF)、二甲基胺的DMF溶液(DMA/DMF)、TiCl3/HCl溶液、三氯氧磷(POCl3)和硼氢化钠(NaBH4)购自国药集团;DMF经CaH2回流干燥、减压重蒸。
2 实验方法
2.1 4-溴-2-硝基甲苯(1)的合成
准确称取10.0 g(72.9 mmol)邻硝基甲苯,用25 mL的浓硫酸溶解,并置于冰浴中搅拌;另称取21.0 g(72.9mol)1,3-二溴-5,5-二甲基咪唑-2,4-二酮,分批多次加入到反应混合物中,加料完毕后,室温下继续搅拌反应过夜。之后将反应混合物缓慢倒入冰水混合物中,待黄色固体充分析出并冷却后,充分过滤,得到黄色固体粗产物,硅胶柱层析(V石油醚∶V乙酸乙酯= 30 ∶ 1~20 ∶ 1)纯化得到固体化合物14.9 g,收率95.0%。1H NMR(400 MHz,CDCl3)δ∶ 2.34(s,3H),7.38(m,1H),8.24(m,1H),8.45(s,1H);13C NMR(106 MHz,CDCl3)δ∶ 18.3,119.6,126.6,132.1,132.4,137.6,151.5; ESI-MSm/z∶ 216[M+H]+。
2.2 N,N-二甲基-4-溴-2-硝基苯乙烯胺(2)的合成
称取14.9 g(69.3 mmol)化合物1,用25.0 mL DMF溶解,并加入16.5 g(138.6 mmol)的DMF/DMA,在130℃下加热回流搅拌3 h。趁热加入少量的蒸馏水,待反应混合物充分冷却重结晶后,用布氏漏斗充分抽滤,得到深红色针状晶体,冷冻干燥得固体化合物15.5 g,收率82.8%。1H NMR(400 MHz,CDCl3)δ∶ 3.04(s,6H),5.93(m,1H),7.53(m,1H),7.65(m,1H),7.94(m,1H),8.52(s,1H);13C NMR(106 MHz,CDCl3)δ∶ 41.6,106.5,108.6,121.5,126.3,129.8,137.5,146.2; ESI-MSm/z∶ 271[M+H]+。
2.3 6-溴代吲哚(3)的合成
称取15.5 g(57.4 mmol)化合物2,用10 mL甲醇溶解,并加入80.0 mL的TiCl3/HCl溶液,室温下搅拌2 h;冰浴下将40.0 mL(2.0 mmol/L)氢氧化钠溶液加入到反应混合物中,充分混合,把不溶的紫色沉淀过滤掉,并用乙酸乙酯充分洗涤滤饼;合并有机溶液,旋蒸除掉有机溶剂。分别加入10 mL甲醇和10 mL溴乙酸乙酯,室温下搅拌过夜,接着加入10 mL饱和碳酸氢钠水溶液,加热回流反应20 min。用饱和氯化铵水溶液淬灭反应,旋蒸除掉有机溶剂,乙酸乙酯萃取(20.0 mL×3),合并有机层并用饱和食盐水洗涤、无水Na2SO4干燥,旋蒸除掉有机溶剂,硅胶柱层析(V石油醚∶V乙酸乙酯=10∶ 1)得白色固体7.05 g,收率63.0%。1H NMR(400 MHz,CDCl3)δ∶ 6.40(m,1H),7.29(m,1H),7.24(m,1H),7.55(m,1H),8.08(m,1H);13C NMR(106 MHz,CDCl3)δ∶ 102.5,114.3,114.6,121.0,123.2,124.3,127.2,138.8; ESI-MSm/z∶ 196[M+H]+。
2.4 6-溴代吲哚甲醛(4)的合成
称取7.05 g(36.2 mmol)化合物3,用20.0 mL DMF溶解,备用。往250 mL圆底烧瓶中加入20.0 mL DMF,搅拌并置于冰浴中,待其充分冷却后,滴加10 mL的三氯氧磷,控制滴加速度,以便三氯氧磷产生的热量能充分散发出去。三氯氧磷滴加完毕后,把溶有化合物3的DMF溶液加入到反应体系中,然后恢复至室温,并在室温下搅拌1 h,加入适量的碎冰,缓慢加入25.0 mL(2 mol/L)NaOH水溶液;加热至沸腾,随后冷却、结晶,抽滤收集固体化合物,冷冻干燥得浅黄色晶体6.91g,收率85.6%。1H NMR(400 MHz,CDCl3)δ∶ 7.3(m,1H),7.58(s,1H),7.75(m,1H),7.86(m,1H),9.74(s,1H),10.3(s,1H);13C NMR(106 MHz,CDCl3)δ∶ 114.4,114.9,118.2,123.2,123.3,125.3,137.7,138.2,184.8; ESI-MSm/z∶ 224[M+H]+。
2.5 6-溴代吲哚-3-甲醇(5)的合成
称取6.9 g(30.9 mmol)化合物4,用甲醇溶解,加入1.76 g(46.0 mmol)的NaBH4,60 ℃下加热回流反应4 h。随后加入饱和氯化铵溶液淬灭反应,乙酸乙酯萃取(20 mL×3),合并有机层,并用饱和食盐水洗涤,无水Na2SO4干燥,旋蒸除掉有机溶剂,硅胶柱层析(V石油醚∶V乙酸乙酯= 4 ∶ 1)纯化得白色固体化合物4.35 g,收率62.5%。1H NMR(400 MHz,CDCl3)δ∶ 3.65(s,1H),4.5(s,2H),7.18(s,1H),7.35(m,2H)7.51(m,1H),10.1(s,1H);13C NMR(106 MHz,CDCl3)δ∶ 56.8,112.1,114.4,114.9,121.0,123.0,123.2,126.5,137.2; ESI-MSm/z∶ 226[M+1]+。
3 结果与讨论
6-溴代吲哚-3-甲醇(化合物5)的合成路线如图2所示。
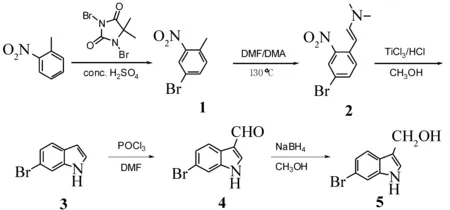
图2 6-溴代吲哚-3-甲醇的合成
本实验中,6-溴代吲哚-3-甲醇的合成以邻硝基甲苯为原料,通过多步有机反应而得。首先,利用苯环上硝基和甲基的协同定位效应,以浓硫酸作为反应溶剂,在苯环的4-位上引入溴原子,收率达到95%。由于化合物1中苯环2,4-位上都是吸电子共轭效应基团,使得苯环甲基上的H很活泼,在DMA作用下可产生碳负离子,与DMF发生类似于羟醛缩合的反应;后处理只需趁热加入少量水以淬灭活泼中间体,之后冷却重结晶即得化合物2,收率可达85.2%。在由化合物2经关环反应合成化合物3的实验过程中,曾分别尝试用Pd/C、PtO2和Raney Ni催化氢化硝基为氨基,进而关环获得目标产物的方法。不过本实验发现,在此条件下,溴原子会从环上脱落;后来选择以TiCl3/HCl为反应试剂,先把-NO2还原为-NHOH,随后在溴乙酸乙酯和NaHCO3溶液的共同作用下,成功转变为化合物3,收率达63.0%。化合物4的合成通过Vilsmeier-Haack甲酰化反应实现。其反应机理是DMF先与三氯氧磷生成活泼加合物,接着解离成碳正离子中间体,然后进攻吲哚环,生成芳香烯胺盐后很快水解成芳香醛(4)。吲哚环的亲电取代反应一般发生在β位,这样有利于过渡态正离子保留苯环的稳定结构。由化合物3合成4的收率达85.6%。目标化合物5的合成由化合物4在硼氢化钠的作用下还原而得,收率为62.5%。
综上所述,本实验以邻硝基甲苯为原料,经过5步反应,以总收率26.5%合成了6-溴代吲哚-3-甲醇。以该化合物为结构框架,通过如Stille反应、Songashira反应、Miyaura-Suzuki反应等过程可以很容易在6-位引入系列药效基团(见图1),从而筛选出类药性更好的吲哚-3-甲醇类衍生物。
参考文献:
[1]QIAN X,MELKAMU M,UPADHYAYA P,et al.Indole-3-carbinol inhibited tobacco smoke carcinogen-induced lung adenocarcinoma in A/J mice when administered during the post-initiation or progression phase of lung tumorigenesis [J].Cancer Letts,2011,311(1): 57-65.
[2]张建革,哈耶特,闻韧.食物防癌剂——吲哚-3-甲醇的研究进展[J].中国基层医药,2002,9(3): 268-269.
[3]HWANG I,LEE J,LEE D G.Indole-3-carbinol generates reactive oxygen species and induces apoptosis [J].Biol Pharm Bull,2011,34(10): 1602-1608.
[4]CHRISTENSEN J G,LEBLANC G A.Reversal of multidrug resistance in vivo by dietary administration of the phytochemical indole-3-carbinol [J].Cancer Res,1996,56(3): 574-581.
[5]MATES J M,SEGURA J A,ALONSO F J,et al.Anticancer antioxidant regulatory functions of phytochemicals [J].Curr Med Chem,2011,18(15): 2315-2338.
[6]JEONG Y M,LI H,KIM S Y,et al.Indole-3-carbinol inhibits prostate cancer cell migration via degradation of beta-catenin [J].Oncol Res,2011,19(5): 237-243.
[7]BEDI A,BARBER J B,BEDI G C,et al.BCR-ABL-mediated inhibition of apoptosis with delay of G2/M transition after DNA damage: a mechanism of resistance to multiple anticancer agents [J].Blood,1995,86(3): 1148-1158.
[8]CHENG L,ZHOU X J.Review on anticancer mechanism of some plant alkaloids [J].Chin Trad & Herb Drugs,2004,35(2): 216-221.
[9]王兴旺.抗癌药筛选模型与筛选方法的研究[J].中国医药工业杂志,1997,28(1): 39-43.
[10]张岐,尹学琼.抗癌化疗药物的研究进展简介[J].中国药物化学杂志,2001,11(5): 298-302.

