一株红树内生真菌Nigrospora sp.中次级代谢产物及其细胞毒活性研究*
魏美燕,李尚德,袁宁宁,梁丽萍,佘志刚,林永成
(1.广东医学院药学院,广东 东莞 523808;2.广州工程技术职业学院,广东 广州 510075;3.中山大学化学与化学工程学院,广东 广州 510275)
红树林为分布于热带亚热带潮间带的木本植物群落,是海洋环境中特有的高等植物。由于红树林具有独特的生理生态,使其具有独特的代谢过程,代谢产物和独特的共生菌,这些共生菌同样能产生极其丰富的新的活性次级代谢产物,红树林内生真菌已经被证明是活性海洋天然产物的重要来源[1]。本研究小组在开展红树林内生真菌活性物质研究的近十几年来,已经对中国南海红树林内生真菌进行了系统的研究,从中分离获得了一系列结构新颖的或药理活性良好的海洋天然化合物[2-8]。
海洋黑孢属Nigrosporasp.真菌是产生活性次级代谢产物的重要来源之一,目前已经从中分离获得了一系列活性化合物。如,从Nigrosporasp.PSU-F5发现的Epoxydons and Pyrone类化合物[9],从Nigrosporasp.(strain No.1403)中获得的griseofulvin类衍生物[10],从Nigrosporasp.YB-141中发现的抗真菌活性化合物solanapyrones[11],以及从Nigrosporaoryzae中分离获得的抗细菌活性化合物Nigrosporins A and B[12]。
在研究红树内生真菌次级代谢产物中,对一株湛江红树内生真菌Nigrosporasp.在实验室进行人工培养发酵150 L。本文首次研究了该菌的次级代谢产物,从培养液的乙酸乙酯提取物中分离得到3个单体化合物,通过波谱解析以及文献对照,分别鉴定为Griseofulvin(1),Vermixocin B(2),Tenellic acid A(3),见图1。化合物1的结构还通过X射线单晶衍射进一步确定其绝对构型,见图2。体外细胞毒活性测试表明,化合物1具有中等的细胞毒活性,对人口腔表皮样癌(鳞癌)细胞KB,人口腔鳞癌多药耐药细胞KBV200,和人肺腺癌细胞A549的细胞毒活性IC50分别为8.23,9.10,和14.26 μmol/L。
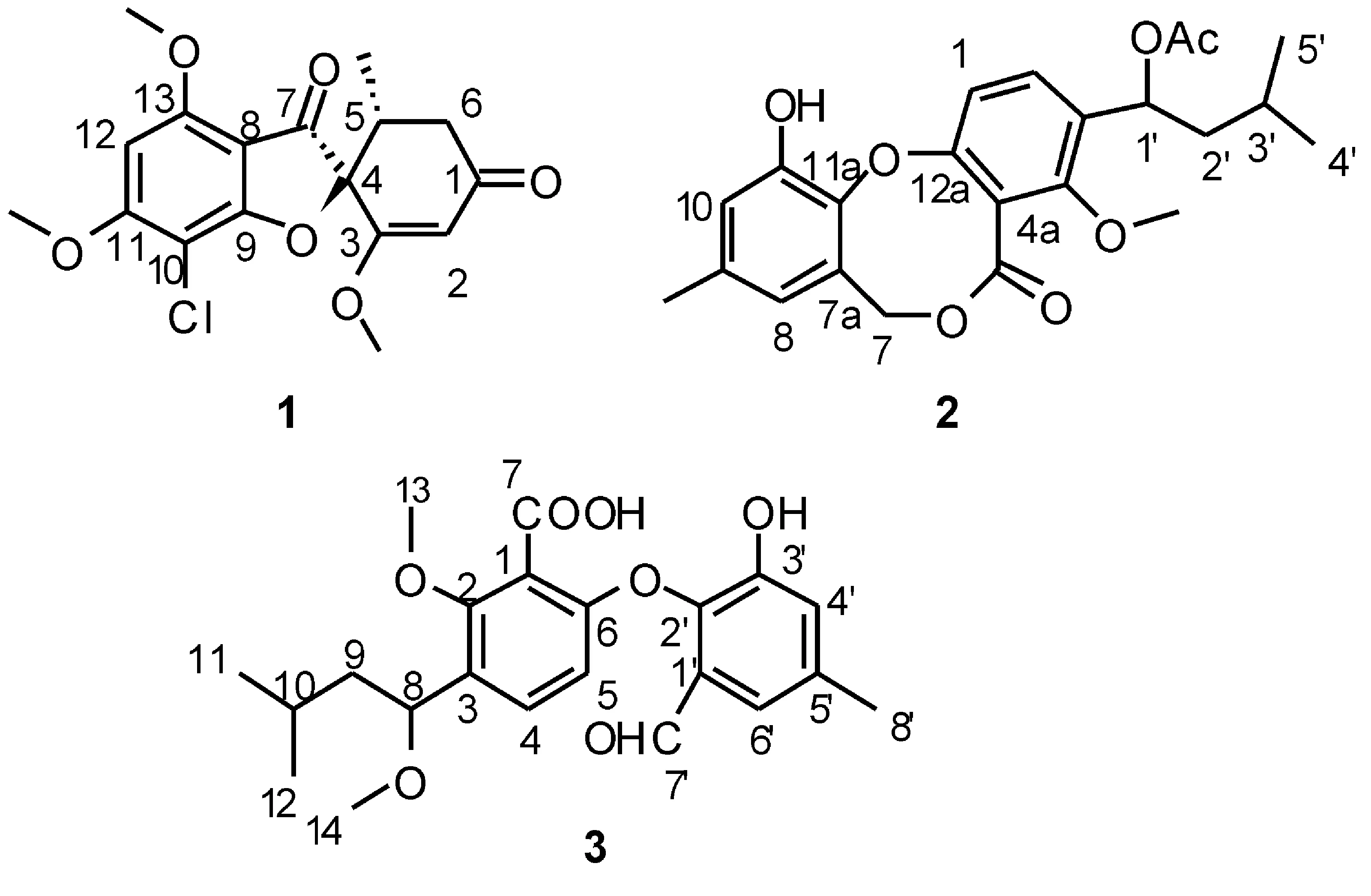
图1 化合物1,2,3的结构式
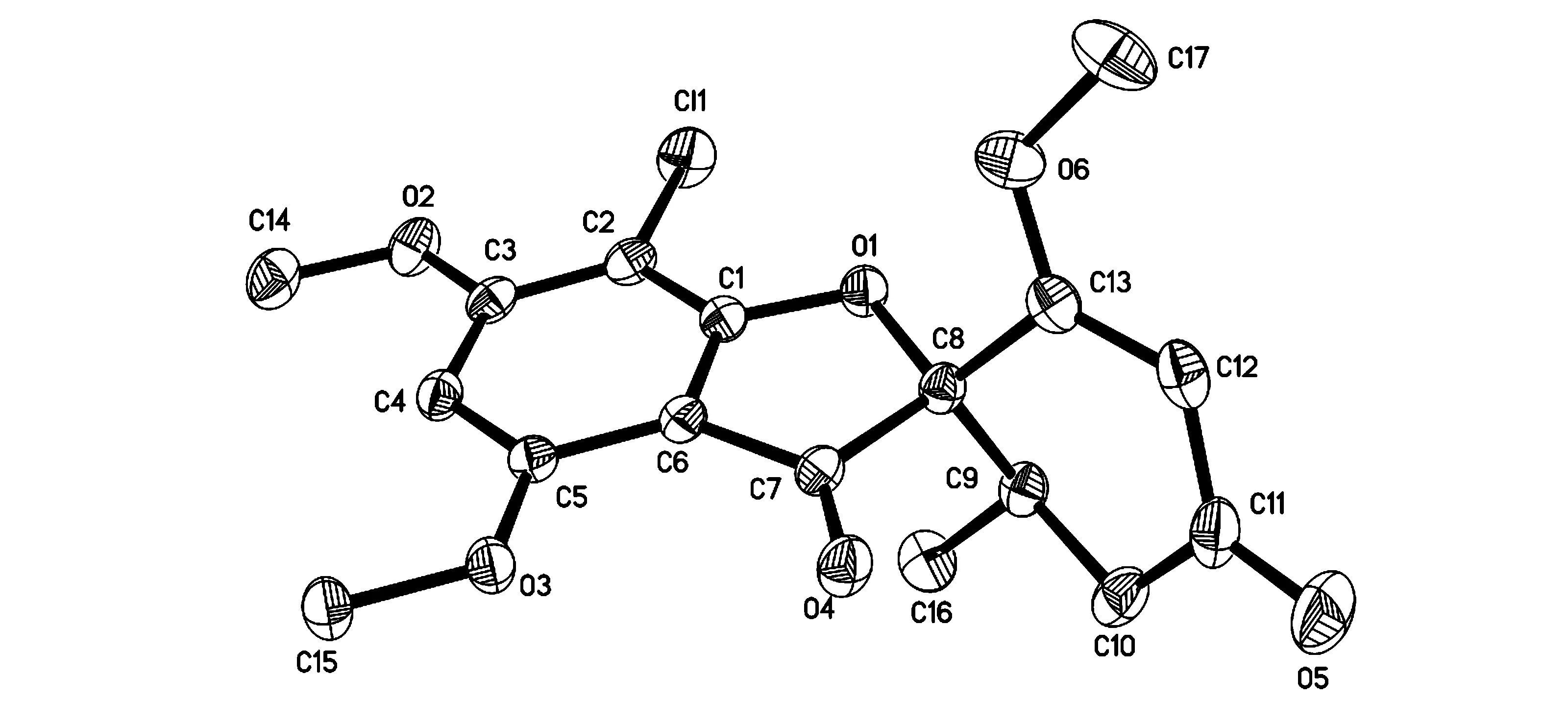
图2 化合物1的单晶衍射结构图
1 实验部分
1.1 试剂与实验仪器
美国Varian公司INOVA 300NB超导核磁共振仪;英国VG公司ZAB-HS质谱仪;美国Thremo公司LCQ DECA XP质谱仪;北京泰克仪器公司的X-4数字显示显微熔点测试仪;德国Bruker公司SMART 1000 CCD X-单晶衍射仪测定。所用试剂均为广州化学试剂厂生产,化学纯溶剂经重蒸后使用。柱层析硅胶为青岛海洋化工厂生产的200 ~ 300目硅胶,硅胶H,薄层硅胶GF254。
1.2 菌种及其保存条件
海洋真菌Nigrosporasp.从湛江红树林植物中分离得到,菌种由中山大学化学与化学工程学院提供,保存在4℃下的玉米海水琼脂营养基中。
1.3 菌种发酵培养
采用悬浮培养方式:发酵培养基(w)为葡萄糖1.0%,蛋白胨0.2%,酵母膏0.1%,粗海盐0.25%,pH 7.0。500 mL三角瓶,内装培养液300 mL,经121 ℃(0.1 MPa)高温灭菌25 min后在超净工作台上接种,共接种150 L,28 ℃静置培养30 d。
1.4 提取分离
发酵液用纱布过滤,菌体和培养液分别收集,培养液由150 L浓缩至3 L后,用相同体积的乙酸乙酯提取。乙酸乙酯提取液浓缩后所得浸膏进行硅胶柱层析,以石油醚—乙酸乙酯—甲醇梯度淋洗。收集各组分再经反复柱层析,制备薄层层析和重结晶纯化后得到化合物1(62.5 mg),2(30.6 mg),3(5.3 mg)。
1.5 细胞毒活性测定
化合物的细胞毒活性测定按照MTT法进行测定[13]。
1.6 化合物的X-ray 单晶衍射测定
晶体的X射线衍射数据采用德国Bruker公司SMART 1000 CCD X-单晶衍射仪测定,以石墨单色化的Mo-Kα辐射(λ=0.071 073 nm)在294(2)K收集数据。在3.17°<θ<27.54°范围内收集衍射点,衍射强度数据应用经验吸收校正。结构用Siements SHELXTL97程序计算,以直接法解析,以差值傅立叶合成法定出非氢原子坐标,并以各向异性热参数用全矩阵最小二乘法对其进行修正。氢原子坐标由理论方法获得,并参与结构因子计算。
2 化合物的实验数据
2.1 化合物的物理和波谱数据
化合物(1):白色固体,θmp224 ℃。FABMSm/z353 [M+1]+,355 [M+2+1]+。1H NMR(CDCl3,300 MHz)δH∶6.11(1H,s),5.51(1H,s),4.02(3H,s),3.97(3H,s),3.62(3H,s),3.01(1H,dd,16.2,4.5),2.44(1H,m),2.40(1H,dd,16.2,4.5),0.96(3H,d,6.6);13C NMR(CDCl3,75 MHz)δC∶ 196.9(C),192.4(C),170.7(C),169.5(C),164.6(C),157.7(C),105.5(CH),104.8(C),97.2(C),90.7(C),89.4(CH),57.0(CH3),56.6(CH3),56.3(CH3),40.0(CH2),36.5(CH),14.2(CH3)。单晶结构为四方晶系,空间群为P4(1),a= 0.897 56(4)nm,b=0.897 56(4)nm,c=1.989 70(17)nm,α= 90°,β= 90°,γ= 90°,C17H16Cl O6,Mr= 351.75,V = 1.602 93(17)nm3,Z= 4,Dc= 1.458 Mg/m3,F(000)= 732,μ= 0.269 mm-1,R1 = 0.0353,wR2 = 0.0928, 5360个可观察衍射点(I> 2σ(I))。以上数据与文献[14]数据基本吻合,确定化合物(1)为Griseofulvin。
Vermixocin B(2): 无色油状,ESI-MSm/z: [M-H]-413.2。1H NMR(CDCl3,300 MHz)δH: 6.87(1H,d,J= 8.7 Hz,H-1),7.44(1H,d,J= 8.7 Hz,H-2),5.10(1H,brd,H-7),5.01(1H,d,J= 14.2 Hz,H-7),6.37(1H,d,J= 1.4 Hz,H-8),6.84(1H,d,J= 1.4 Hz,H-10),4.02(3H,s,4-OCH3),2.23(3H,s,9-CH3),2.06(3H,s,-OCOCH3),6.11(1H,dd,J= 9.6,4.6 Hz,H-1’),1.76(1H,ddd,J=14.2,9.6,5.5 Hz,H-2’),1.49(1H,ddd,J=13.3,8.2,4.1 Hz,H-2’),1.63(1H,m,H-3’),0.94(3H,d,J= 6.4 Hz,H-4’),0.94(3H,d,J= 6.4 Hz,H-5’);13C NMR(CDCl3,75 MHz)δC: 117.8(CH,C-1),130.9(CH,C-2),134.4(-C,C-3),154.8(-C,C-4),69.2(CH2,C-7),121.0(CH,C-8),135.3(-C,C-9),117.9(CH,C-10),147.5(-C,C-11),167.4(-C,C-4a),126.0(-C,C-7a),141.4(-C,C-11a),151.7(-C,C-12a),121.0(-C,C-4a),68.9(CH,C-1’),170.5(-C,C-6’),62.9(CH3,C-4-OCH3),45.5(CH2,C-2’),25.1(CH,C-3’),23.3(CH3,C-4’),22.1(CH3,C-5’),21.4(CH3,9-CH3),21.0(CH3,C-7’)。以上数据与文献[15]数据基本吻合,确定化合物(2)为Vermixocin B。
Tenellic acid A(3):无色晶体,ESI-MSm/z:[M-H]-401.3。1H NMR(Acetone-d6,300 MHz)δH: 7.33(d,8.6,H-4),6.49(d,8.6,H-5),4.56(dd,9.1,3.9,H-8),1.61(ddd,14,9.1,5.2,H-9),1.32(ddd,14,8.6,3.9,H-9),1.78(m,H-10),0.94(d,6.6,H-11),0.90(d,6.6,H-12),3.93(s,H-13),3.14(s,H-14),7.17(m,H-4’),7.21(m,H-6’),10.2(s,H-7’),2.36(s,H-8’).13C NMR(Acetone-d6,75 MHz)δC: 119.5(C-1),156.8(C-2),131.8(C-3),129.8(C-4),111.5(C-5),156.1(C-6),167.6(C-7),76.0(C-8),47.8(C-9),25.6(C-10),23.7(C-11),22.2(C-12),63.2(C-13),56.7(C-14),130.8(C-1’),143.0(C-2’),151.2(C-3’),124.8(C-4’),137.8(C-5’),120.2(C-6’),189.8(C-7’),20.9(C-8’)。以上数据与文献[16]数据基本吻合,确定化合物(3)为 Tenellic acid A
2.2 化合物的细胞毒活性
对化合物进行了细胞毒活性测试。结果表明,化合物1具有中等的细胞毒活性,对人口腔表皮样癌(鳞癌)细胞KB,人口腔鳞癌多药耐药细胞KBV200和人肺腺癌细胞A549的细胞毒活性IC50分别为8.23,9.10 和14.26 μmol/L。
3 结 论
本文首次研究了一株红树内生真菌Nigrosporasp.的次级代谢产物。从该菌培养液的乙酸乙酯相中分离获得3个聚酮类化合物:Griseofulvin(1),Vermixocin B(2),和Tenellic acid A(3)。细胞毒活性测试发现化合物1具有中等强度的细胞毒活性。化合物Griseofulvin曾作为多种真菌的代谢产物报道过,最近也有报道从Nigrosporasp.中发现。化合物2有报道从真菌Guignardiasp.和Penicilliumsimplicissimum中发现过,化合物3曾作为真菌Dendrosporatenella的代谢产物报道过,这两个化合物均为首次从真菌Nigrosporasp.中发现。红树林区具有丰富的内生微生物,对红树内生微生物次级代谢产物进行研究,从中筛选结构新颖的活性化合物,可成为海洋药物开发以及药物先导化合物发现的基础和源泉。
参考文献:
[1]BLUNT J W,COPP B R,MUNRO M H.G,et al.Marine natural products [J].Natural Product Reports,2011,28(2): 196-268.
[2]LI,H X,HUANG H B,SHAO C L,et al.Cytotoxic norsesquiterpene peroxides from the endophytic fungus Talaromyces flavus isolated from the mangrove plant Sonneratia apetala [J].Journal of Natural Products,2011,74(5): 1230-1235.
[3]SHAO C L,WANG C Y,WEI M Y,et al.Aspergilones A and B,two benzylazaphilones with an unprecedented carbon skeleton from the gorgonian-derived fungus Aspergillus sp[J].Bioorganic & Medicinal Chemistry Letters,2011,21(2): 690-693.
[4]WEI M Y,WANG C Y,LIU Q A,et al.Five sesquiterpenoids from a marine-derived fungusAspergillussp.isolated from a gorgonianDichotellagemmacea[J].Mar.Drugs2010,8: 941-949.
[5]魏美燕,邵长伦,谭倪,等.南海海洋真菌Penicilliumsp.(386#)次级代谢产物再研究[J].中山大学学报:自然科学版,2010,49(4): 77-80.
[6]WEN L,CAI X L,XU F,et al.Three metabolites from the mangrove endophytic fungusSporothrixsp.(#4335)from the South China Sea[J].Journal of Organic Chemistry,2009,74(3): 1093-1098.
[7]SHAO C L,WANG C Y,WEI M Y,et al.Structure elucidation of two new xanthone derivatives from the marine fungusPenicilliumsp.(ZZF 32#)from the South China Sea[J].Magnetic Resonance in Chemistry,2008,46(11): 1066-1069.
[8]LIN Y C,WU X Y,FENG S,et al.Five unique compounds: xyloketals from nangrove fungusXylariasp.from the South China Sea coast[J].Journal of Organic Chemistry,2001,66(19): 6252-6256.
[9]KONGKIAT T,VATCHARIN R,YAOWAPA S,et al.Epoxydons and a pyrone from the marine-derived fungusNigrosporasp.PSU-F5[J].Journal of Natural Products,2008,71(8):1323-1326.
[10]XIA X K,LI Q,LI J,et al.Two new derivatives of griseofulvin from the mangrove endophytic fungusNigrosporasp.(strain No.1403)fromKandeliacandel(L.)druce[J].Planta Medica,2011,77(15):1735-1738.
[11]WU S H,CHEN Y W,SHAO S C,et al.Two new solanapyrone analogs from the endophytic fungusNigrosporasp.YB-141 ofAzadirachtaindica[J].Chemistry & Biodiversity,2009,6(1):79-85.
[12]TANAKA M,FUKUSHIMA T,TSUJINO Y,et al.Nigrosporins A and B,new phytotoxic and antibacterial metabolites produced by a fungusNigrosporaoryzae[J].Bioscience,Biotechnology,and Biochemistry,1997,61(11):1848-1852.
[13]Mosmann T.Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays [J].J Immunol Meth,1983,65: 55-63.
[14]姜广策,林永成,周世宁,等.中国南海红树林内生真菌No.1403次级代谢物的研究[J].中山大学学报:自然科学版,2000,39(6):68-72.
[15]XIA X K,LIU F,SHE Z G,et al.1H and13C NMR assignments for 6-demethylvermistatin and two penicillide derivatives from the mangrove fungusGuignardiasp.(No.4382)from the South China Sea[J].Magnetic Resonance in Chemistry,2008,46(7):693-696.
[16]OH H,KWON T O,GLOER J B,et al.Tenellic acids A-D: new bioactive diphenyl ether derivatives from the aquatic fungusDendrosporatenella[J].Journal of Natural Products,1999,62(4): 580-583.

