分子病理指导下脑恶性胶质瘤个体化治疗的临床疗效研究
王耀伍,尹春丽*,张志勇,张宏义,张 坤,廖 珩,张志民
(1.河北省唐山市工人医院神经外科,河北唐山 063000;2.河北省石家庄以岭医院神经外科,河北石家庄 050000)
分子病理指导下脑恶性胶质瘤个体化治疗的临床疗效研究
王耀伍1,尹春丽1*,张志勇1,张宏义1,张 坤1,廖 珩1,张志民2
(1.河北省唐山市工人医院神经外科,河北唐山 063000;2.河北省石家庄以岭医院神经外科,河北石家庄 050000)
目的观察对比在分子病理指导下脑恶性胶质瘤的个体化治疗与凭经验治疗的临床疗效。方法选择2008年1月—2010年1月凭经验治疗的胶质瘤患者60例为对照组,2010年1月—2012年1月在分子病理指导下治疗的脑恶性胶质瘤患者60例为治疗组,根据WHO推荐标准分别观察有效率、无进展生存时间及总生存时间,并进行统计学分析。结果治疗组有效率为56.67%,对照组有效率为36.67%,2组差异有统计学意义(P<0.01)。第6周期末治疗组的未进展存活率为86.67%,是对照组的1.24倍,2组差异有统计学意义(P<0.05)。生存质量(Kamofsky score,KPS)评分治疗组平均值是(86.83±12.66)分,对照组是(74.02±11.81)分,2组之间差异有统计学意义(P<0.01)。结论分子病理指导下的个体化治疗较凭经验治疗有更高的有效率,生存时间长。
神经胶质瘤;药物疗法;治疗结果
脑瘤中胶质瘤最常见,占颅内肿瘤的40%~50%,脑胶质瘤的发病率为3~6/10万,年死亡例数达3万。现阶段恶性胶质瘤治疗策略仍是以外科手术最大限度的切除肿瘤组织,然后辅以放、化疗的综合治疗。虽然恶性胶质瘤的综合治疗已经有数十年的历史,但是胶质瘤治疗的临床效果仍然差强人意,其综合治疗后的平均存活时间仅为36~48周,2年存活率仅为8%~12%[1]。目前沿用的胶质瘤分类方法为Kenehan分类系统和WHO分类系统[2],但这2种经典的分类方法只是简单反映了胶质瘤的恶性程度,却不能较为准确地判断胶质瘤患者的预后及对化疗药物及放疗的敏感度,所以传统的胶质瘤分类及根据此分类进行的凭经验制定的治疗方案已经不能满足胶质瘤患者的个体化治疗的需要。分子病理学是近些年来在传统的组织病理学的基础上结合分子生物学及分子遗传学的研究成果,并采用相关的分子物理和化学技术逐渐发展完善起来的。依据分子病理学的检查结果,可以使临床医生了解胶质瘤患者的分子病理学特征,相对于传统的组织病理学,可以更加有针对性地选择适合的治疗措施,从而达到胶质瘤的个体化治疗,延长患者的生存期及提高患者的生存质量[3]。
1 资料与方法
1.1 一般资料:选择2008年1月—2010年1月凭经验治疗的胶质瘤患者60例作为对照组,男性30例,女性30例,年龄23~74岁,平均(48±10)岁。2010年1月—2012年1月在分子病理指导下治疗的脑恶性胶质瘤患者60例作为治疗组,男性32例,女性28例,年龄21~75岁,平均(48±12)岁。所有入选病例均经组织病理学检验,病理结果包括多形性胶质母细胞瘤、间变性星形细胞瘤或间变少突胶质细胞瘤;生存质量(Kamofsky score,KPS)评分≥60分;肝肾功能无严重损害,血常规及心功能基本正常范围;每位患者的头颅MRI或强化CT中至少有一个长短径可测量的病灶。
1.2 方法:全部患者均经组织病理学检查确认为恶性胶质瘤,包括胶质母细胞瘤49例,间变星形细胞瘤43例,间变少突细胞瘤16例及间变混合细胞瘤12例,Kenehan分级3~4级或4级。2组均行手术治疗,并于术后行放化疗。治疗组除进行常规组织病理学检查以外,还进行06-甲基鸟嘌呤-DNA-甲基转移酶(06-methylguanine DNA-transferase,MGMT)、拓扑异构酶Ⅱ、表皮生长因子受体(epidermal growth factor receptor,EGFR)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、Ki-67抗原、1p/19q等分子病理标记物检查。治疗组根据分子病理检查结果选择替莫唑胺同步放化疗方案、替莫唑胺5/28单药治疗方案、替莫唑胺改良方案、PCV方案、铂类为基础的方案、亚硝脲类方案;对照组为传统替莫唑胺单药方案、亚硝脲类方案等。均完成至少6个疗程用药。研究期间无病例脱落。
1.3 治疗效果评估
1.3.1 恶性胶质瘤的客观疗效评定标准:依据头颅MRI或强化CT检查结果,评估2组病例在第2、3、6个疗程末肿瘤客观疗效变化。采用WHO制定的实体肿瘤对治疗敏感性的评判标准,分为完全缓解、部分缓解、稳定、病变进展。有效=完全缓解+部分缓解。
1.3.2 无进展存活率的计算:分别计算第2、3和6个疗程末2组患者无进展存活率,进行统计学分析。无进展生存(progression free survival,PFS)定义为从用药治疗开始后,患者病情没有进展且存活。
1.3.3 患者生活质量评定:根据神经学的检查和机能状态判定指标KPS评分评价[4]。KPS评分在80分以上为非依赖级,即生活自理;60~70分为半依赖级,即生活半自理;60分以下为依赖级。
1.4 统计学方法:应用Stata 12.0统计软件进行统计学分析,计量资料以±s表示,组间比较采用t检验,计数资料以百分率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 治疗后体积变化:治疗组有效率为56.67%,对照组有效率为36.67%,治疗组有效率明显高于对照组,差异有统计学意义(P<0.01)。见表1。
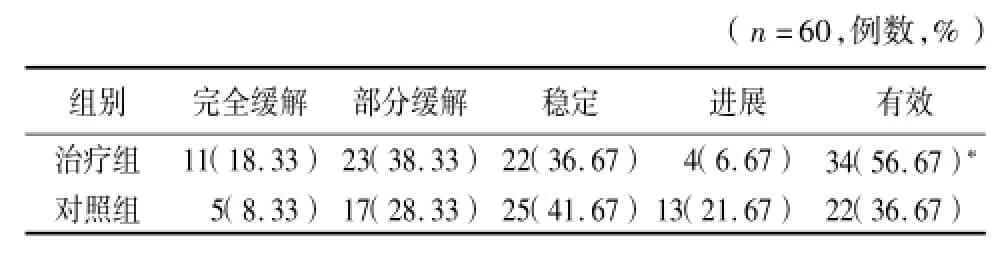
表1 治疗组和对照组疗效比较
2.2 无进展存活率:治疗组不同疗程末的无进展存活率均高于对照组,尤其是第6疗程的无进展存活率为86.67%,为对照组的1.24倍(P<0.05)。见表2。

表2 治疗组和对照组不同疗程末无进展存活率比较
2.3 生活质量:治疗组KPS评分平均值为(86.83±12.66)分,对照组为(74.02±11.81)分,2组差异有统计学意义(t=5.73,P<0.01)。说明治疗组患者的临床症状、体征及功能状态的改善情况优于对照组患者,治疗组患者生活质量优于对照组。
3 讨 论
胶质瘤的发病机制目前未完全清楚。一般认为与遗传、机体免疫功能失调和环境等综合因素有关。近些年随着胶质瘤的分子病理学及肿瘤基因图谱研究的进展,显示胶质瘤可能是一种基因病[5],人体内外的多种因素使抑癌基因与原癌基因失衡导致胶质瘤的发生。众多癌相关基因的相互影响,使细胞生长调节异常,细胞之间缺乏接触抑制和细胞的遗传不稳定,最终影响了细胞周期的调控,细胞凋亡,促进肿瘤血管生成,跨膜信号转导和DNA修复异常,最终导致了肿瘤的发生和发展[6]。但是,肿瘤的发生和发展的细节还远远不清楚,肿瘤的发生发展不仅是单基因改变的结果,而是由众多原癌基因和抑癌基因相互作用的结果,这也就为临床分子病理的检查提供了众多的分子病理标记物,这些分子病理标记物对判断肿瘤患者的预后、药物的敏感性和耐药性以及对放疗的敏感性等提供了个体化治疗的依据[7]。
本研究中应用的分子病理标记物有MGMT、EGFR、VEGF、Ki-67抗原、拓扑异构酶Ⅱ及1p/19q等。
通过检测胶质瘤患者肿瘤MGMT的活性,可以了解肿瘤对烷化剂类化疗药物的敏感性,因为肿瘤细胞自身能够修复被烷化剂破坏的DNA,而使这类患者对烷化剂化疗药物如替莫唑胺、亚硝脲类药物效果不佳或产生耐药性。这也是凭经验治疗的对照组有效率较低、效果较差的原因。而治疗组通过分子病理学检测,了解了患者的分子病理学特征,如果显示MGMT阳性,则采用改良的替莫唑胺治疗方案,每天口服100mg,用21d,停药7d或其他改良方案等[8],或加用顺铂等细胞周期特异性化疗药物等。提高了MGMT阳性胶质瘤患者的治疗效果。
1p/19q联合缺失的少突胶质瘤患者,对放化疗的敏感性都很强,而没有1p/19q缺失的患者则不敏感,预后较前类患者明显差,对判断此类患者预后有指导意义。
EGFR基因位于染色体7p12,在高级别的星形细胞瘤中常见其功能增强,多形性胶质母细胞瘤中有1/3EGFR活性增强[9],EGFR的过度表达会导致肿瘤细胞对放疗不明感[10]。EGFR受体拮抗剂作为分子靶向治疗目前在胶质母细胞瘤治疗中越来越受到重视,并已在临床有了一定的应用。Ki-67抗原活性表示肿瘤细胞核增值的程度,而Ki-67与其他分子病理标记物联合应用,可以更好地判断患者的预后[11]。
目前胶质瘤的治疗仍然是以手术治疗为主,同时辅以放疗和化疗等综合性治疗。随着对胶质瘤发病机制及影响因素了解的深入,尤其是分子病理学的临床应用,使得胶质瘤患者的个体化治疗成为可能。分子靶向治疗为恶性胶质瘤的治疗带来了新的希望,而分子靶向治疗的基础是分子病理学的应用。本研究将进一步筛选不同分子病理标记物及不同组合,并选择适合该分子病理特征的治疗方案。
[1] RANDESAA,ERMANIM,BASSO U,et al.Temozolomide as a second-line systemic regimen in recurrenthigh-gradeglioma:a phaseⅡstudy[J].Ann Onclo,2001,12(2):255-257.
[2] 王忠诚.神经外科学[M].武汉:湖北科学技术出版社,1998:391-394.
[3] HOANG-XUAN K,IDBAIH A,MOKHTARIK,et al.Towards a molecular classification of gliomas[J].Bull Cancer,2005,92(4):310-314.
[4] 章翔.神经系统肿瘤学[M].北京,军事医学科学出版社,1999:192-195.
[5] CANCER GENOME ATLAS RESEARCH NETWORK. Comprehensive genomic characterization defines human glioblastoma genes and core pathways[J].Nature,2008,455(7216):1061-1068.
[6] HEIMBERGER AB,SAMPSON JH.The PEPv III-KLH(CDX-110)vaccine in glioblastoma multiforme patients[J].Expert Opin Biol Ther,2009,9(8):1087-1098.
[7] COLMAN H,ZHANG L,SULMAN EP,et al.A multigene predictor of outcome in glioblastoma[J].Neuro-Oncology,2010,12(1):49-57.
[8] HEGIME,LIU L,HERMAN JG,et al.Correlation of O6-methylguaninemethyltransferase(MGMT)promoter methylation with clinical outcomes in glioblastoma and clinical strategies to modulate MGMT activity[J].J Clin Oncol,2008,26(25):4189-4199.
[9] VERHAAK RG,HOADLEY KA,PURDOM E,et al.Integrated genomic analysis identifies clinically relevant subtypes of glioblastoma characterized by abnormalities in PDGFRA,IDH1,EGFR,and NF1[J].Cancer Cell,2010,17(1):98-110.
[10] NORDEN AD,YOUNG GS,SETAYESH K,et al.Bevacizumab for recurrentmalignant gliomas:efficacy,toxicity,and patterns of recurrence[J].Neurology,2008,70(10):779-787.
[11] PAULUSW.GFAP,Ki-67 and IDH1:perhaps the golder triad of glioma immunohistochemistry[J].Acta Neuropathol,2009,118(5):603-604.
(本文编辑:赵丽洁)
R739.41
B
1007-3205(2012)07-0820-03
2012-02-24;
2012-06-14
王耀伍(1975-),男,河北沧州人,河北省唐山市工人医院主治医师,医学硕士,从事神经外科疾病诊治研究。
*通讯作者。E-mail:chunli-yin@163.com
10.3969/j.issn.1007-3205.2012.07.028

