胰岛素抵抗心肌细胞模型的建立与评价
王 梅,李拥军,刘素云,张 辉,杨 蓉,苗成龙
(河北医科大学第二医院心血管内四科,河北石家庄 050000)
·论 著·
胰岛素抵抗心肌细胞模型的建立与评价
王 梅,李拥军*,刘素云,张 辉,杨 蓉,苗成龙
(河北医科大学第二医院心血管内四科,河北石家庄 050000)
目的建立胰岛素抵抗心肌细胞模型。方法原代培养2~3d SD大鼠心肌细胞分为对照组、葡萄糖组(glucose,G)、胰岛素组(insulin,Ins)、葡萄糖+胰岛素组(G+Ins)。在干预24h和48h后评价细胞的胰岛素敏感性,检测脂联素表达。结果干预48h后,Ins组、G+Ins组心肌细胞3H-D-葡萄糖掺入率分别为(12.46±1.11)nmol·mg-1·h-1、(10.61±1.14)nmol·mg-1·h-1,均较对照组的(14.06±0.43)nmol·mg-1·h-1显著下降,差异有统计学意义(P<0.05)。干预48h后,Ins组、G+Ins组心肌细胞脂联素mRNA表达分别为0.35±0.04、0.38±0.04,均较对照组的0.77±0.08显著下降,差异有统计学意义(P<0.05)。对照组、G组、Ins组、G+Ins组3H-D-葡萄糖掺入率与心肌细胞脂联素mRNA表达量均呈显著正相关(r=0.92、0.82、0.89、0.86,P均<0.05)。结论应用高胰岛素诱导法、高葡萄糖+高胰岛素共同诱导法均可建立胰岛素抵抗心肌细胞模型;胰岛素抵抗下调心肌细胞脂联素表达水平;胰岛素抵抗心肌细胞脂联素表达水平与胰岛素抵抗呈正相关。
肌细胞,心脏;胰岛素;模型,动物
胰岛素抵抗是2型糖尿病、肥胖、高血压等多种疾病的共同病理生理学基础,其代表性特征是高胰岛素血症、高血糖和内环境紊乱。建立相应的模型系统有利于在细胞及分子水平深入研究胰岛素抵抗的发生机制。目前,较为成熟的胰岛素抵抗体外细胞模型主要有地塞米松诱导模型、游离脂肪酸诱导模型、肿瘤坏死因子诱导模型等,但均局限在脂肪细胞、肝细胞、骨骼肌细胞,针对心肌细胞的胰岛素抵抗细胞模型国内外未见报道。本研究应用高葡萄糖、高胰岛素、高葡萄糖加高胰岛素法诱导建立胰岛素抵抗心肌细胞模型,旨在为进一步研究心肌细胞胰岛素抵抗奠定基础。
1 材料与方法
1.1 实验动物:2~3d的Sprague-Dawley(SD)大鼠(河北医科大学实验动物中心提供)32只。
1.2 药品与试剂:DMEM低糖培养液、D-Hanks、Ⅱ型胶原酶干粉、Trizol均为GIBCO公司产品;胰蛋白酶干粉为Hyclone产品;新生牛血清、D-甘露醇、牛胰岛素、多聚甲醛为 Sigma公司产品;双抗为Invitrogen产品;BrdU为Boster产品;多聚赖氨酸为Amresco产品;APN抗体为Abcam产品;PCR扩增试剂为Promega产品;RT-PCR检测试剂盒为大连宝生工程有限公司产品;引物由上海生工生物工程有限公司合成;琼脂糖为北方同正产品;其他试剂均为分析纯。混合酶消化液配置方法,胰蛋白酶干粉0.08g,Ⅱ型胶原酶干粉0.032g,加入37℃预热的D-Hanks液至80mL,匀,过滤除菌,即用即配。
1.3 心肌细胞培养:取新生2~3d的SD大鼠,在无菌的条件下,开胸取出心脏,用D-Hanks液冲洗3次后剪成约1mm3大小的碎块,加入混合酶消化液,取消化完毕后的上清液,200目细胞网筛过滤,所得细胞悬液差速贴壁后以1×106/mL的密度接种于6孔板,加入5-溴脱尿苷0.1 mmol/L,在二氧化碳孵育箱内以含10%血清的低糖DMEM培养基培养。
1.4 实验分组:常规进行心肌细胞原代培养48h后,换为无血清的低糖DMEM培养基培养24h,之后分为4组,每组8只。①对照组(control),以低糖DMEM培养基培养。②葡萄糖组(glucose,G),以30mmol/L葡萄糖干预。③胰岛素组(insulin,Ins),以10-7mmol/L胰岛素干预。④葡萄糖+胰岛素组(G+Ins),以30mmol/L葡萄糖和10-7mmol/L胰岛素共同干预。
1.5 胰岛素抵抗心肌细胞模型的鉴定:采用3HD-葡萄糖掺入实验评价细胞的胰岛素敏感性。上述各组心肌细胞根据干预时间不同再分为24h组(干预24h)和48h组(干预48h),每组3孔。干预结束后,各组加入1mL低糖DMEM培养液再孵育半小时,然后加入3H-D-葡萄糖继续孵育1h。洗涤细胞后将细胞溶解,取100μL测定蛋白质浓度。冷乙醇(660μL/mL)溶液洗涤2次,离心弃上清,将沉淀物置于滤纸片上,洗涤后烤干,置于10mL闪烁液中,用液体闪烁仪测定放射性计数,得出3H-D-葡萄糖掺入率,单位为nmol·mg-1·h-1。
1.6 检测心肌细胞脂联素的表达
1.6.1 RT-PCR检测脂联素mRNA的表达:引物序 列 为 脂 联 素 正 义 链 5′ -CAGGAGATGCTGGAATGA-3′,反义链 5′-GATACTGGTCGTAGGTGAAG-3′;β-actin正义链5′-AGGGAAATCGTGCGTGAC-3′,反义链5′-CTGGAAGGTGGACAGTGAG-3′。按照Trizol试剂说明书提取心肌细胞总RNA并进行逆转录反应,共35个循环,PCR产物10μL经2%琼脂糖凝胶电泳,溴化乙锭染色、照相并经光密度仪扫描分析,以βactin光密度值进行标准校正,计算APN产物的相对量。
1.6.2 心肌细胞脂联素蛋白表达水平的检测:裂解液裂解细胞后进行聚丙烯酰胺凝胶电泳。利用水浴式电印迹法将蛋白转至聚偏二氟乙烯膜上,室温下封闭4h后,加入兔抗APN多克隆抗体稀释液,4℃过夜,用含体积分数为0.5%Tween-20的磷酸缓冲液洗3遍,再加入荧光染料标记的羊抗兔IgG(1∶5 000,Rockland IRDye800CW)二抗稀释液,37℃振 1h后用磷酸缓冲液洗 3遍,用Odyssey9120双色红外激光成像系统仪器扫描PVDF膜后用成像分析软件进行分析,计算每组与β-actin表达量的比值。
1.7 统计学方法:应用SPSS13.0进行统计分析,计量资料以±s表示,多组计量资料比较采用单因素方差分析,两两比较用q检验,两变量间相关性采用直线相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 心肌细胞3H-D-葡萄糖掺入率的变化:干预24h和48h后,G组心肌细胞3H-D-葡萄糖掺入率与对照组比较差异无统计学意义(P>0.05);Ins组、G+Ins组心肌细胞3H-D-葡萄糖掺入率均较对照组显著下降(P<0.05)。见表1。
2.2 心肌细胞脂联素mRNA和蛋白表达的变化:应用高糖、高胰岛素、高糖+高胰岛素干预48h后,G组心肌细胞脂联素mRNA表达与对照组比较差异无统计学意义(P>0.05);Ins组、G+Ins组心肌细胞脂联素mRNA表达均较对照组显著下降(P<0.05)。G组、Ins组、G+Ins组心肌细胞脂联素蛋白表达均较对照组显著下降(P<0.05)。见表2。
表1 干预24、48h后心肌细胞3H-D-葡萄糖掺入率的变化Table 1 IncorPoration rate of3H-D-glucose in different grouPs of myocardial cells after 24,48-hour treatment(n=8,±s,nmol·mg-1·h-1)

表1 干预24、48h后心肌细胞3H-D-葡萄糖掺入率的变化Table 1 IncorPoration rate of3H-D-glucose in different grouPs of myocardial cells after 24,48-hour treatment(n=8,±s,nmol·mg-1·h-1)
*P<0.05 vs control group by q test
Groups Incorporation rate of3HD-glucose after 24h Incorporation rate of3HD-glucose after 48h Control 14.07±0.27 14.06±0.43 G 13.33±0.76 13.58±0.49 Ins 12.48±0.90* 12.46±1.11*G+Ins 10.64±0.95* 10.61±1.14*
表2 干预48h后心肌细胞脂联素mRNA和蛋白表达比较Table 2 AdiPonectin mRNA and Protein level in different grouPs of myocardial cells after 48h treatment(n=8,±s)
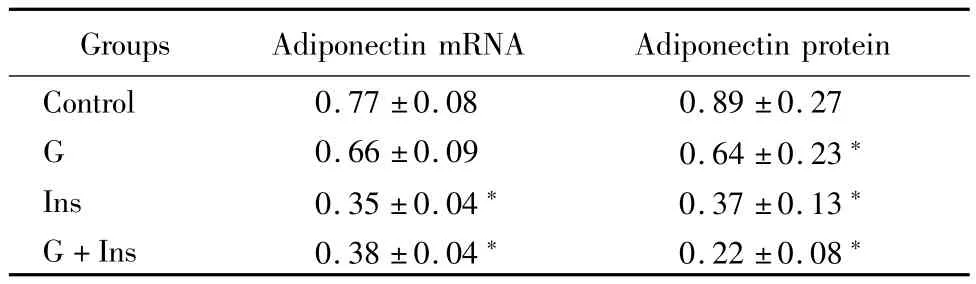
表2 干预48h后心肌细胞脂联素mRNA和蛋白表达比较Table 2 AdiPonectin mRNA and Protein level in different grouPs of myocardial cells after 48h treatment(n=8,±s)
*P<0.05 vs control group by q test
Groups Adiponectin mRNA Adiponectin protein Control 0.77±0.08 0.89±0.27 G 0.66±0.09 0.64±0.23*Ins 0.35±0.04* 0.37±0.13*G+Ins 0.38±0.04* 0.22±0.08*
2.3 直线相关分析:应用高糖、高胰岛素、高糖+高胰岛素干预48h后,对照组、G组、Ins组、G+Ins组3H-D-葡萄糖掺入率与心肌细胞脂联素mRNA表达量均呈正相关(r=0.92、0.82、0.89、0.86,P均<0.05)。
3 讨 论
胰岛素抵抗是指机体对胰岛素生理作用的反应性降低或敏感性降低。产生胰岛素抵抗的主要部位在肝脏、肌肉和脂肪组织[1]。研究[2]发现,约25%正常人群存在胰岛素抵抗,糖耐量减低人群75%存在胰岛素抵抗,2型糖尿病患者胰岛素抵抗的发生率为85%左右。
研究胰岛素抵抗机制以及药物对胰岛素抵抗的影响离不开胰岛素抵抗细胞模型,因此建立可靠的模型极为重要。目前已成功复制出数种胰岛素抵抗细胞模型,这些细胞模型主要有地塞米松诱导模型、高胰岛素诱导培养模型、高类固醇培养模型、肿瘤坏死因子诱导模型、游离脂肪酸诱导模型等,其中以高胰岛素培养模型最为稳定、可靠,使用也最为广泛。但这些模型细胞均为脂肪细胞、骨骼肌细胞、肝脏细胞。目前已知与胰岛素抵抗相关的最重要部位是代谢较旺盛的肝脏、骨骼肌、脂肪。心肌也是人体代谢最旺盛的器官之一。有学者[3]发现,胰岛素受体同样在心肌细胞表面表达,其受体数目受胰岛素水平的调节。当胰岛素受体数目下调至一定程度时,则该细胞对胰岛素的作用产生抵抗[4]。有学者[5]在研究犬体外循环心肌缺血-再灌注损伤时发现,在强应激过程中,不仅机体全身发生了胰岛素抵抗,而且作为胰岛素靶组织之一的心肌也发生了胰岛素抵抗。有学者[6-7]在糖尿病高血糖状态下对心肌细胞进行研究,发现高血糖激活了细胞多元醇代谢通路,最终导致肌醇代谢紊乱、细胞内Na+-K+-ATP酶活性下降、钙离子泵功能障碍、葡萄糖转运异常,引起心肌细胞结构与功能受损。但目前针对心肌细胞的胰岛素抵抗研究,国内外尚未见报道。因此,胰岛素抵抗心肌细胞模型的建立对研究心肌细胞局部胰岛素抵抗的发生机制具有重要意义。
胰岛素抵抗的代表性特征是高胰岛素血症、高血糖和内环境紊乱等[8-9]。高血糖、高胰岛素血症本身可能诱导胰岛素抵抗的发生[10]。因此,本研究采用高浓度葡萄糖、高浓度胰岛素诱导心肌细胞,排除机体全身体液、神经调节的因素影响,进一步探讨高浓度葡萄糖、高浓度胰岛素对体外心肌细胞胰岛素敏感性的影响。
3H-D-葡萄糖掺入实验是目前较为常用的评价细胞胰岛素敏感性的方法之一[11]。脂联素被认为是胰岛素抵抗的标记物[12]。有研究[13]表明高脂饲料喂养的胰岛素抵抗大鼠模型内脏脂肪组织脂联素表达减低,罗格列酮干预后可上调脂肪组织脂联素的表达,降低空腹胰岛素水平,改善胰岛素抵抗。脂联素基因敲除的纯合子小鼠可表现出中度的胰岛素抵抗及轻度的葡萄糖耐量减低,提示脂联素具有纠正胰岛素抵抗的作用[14]。单次给予脂联素后,高脂高蔗糖饮食小鼠血中脂肪酸和三酰甘油明显降低、体质量增加[15]。上述研究表明脂联素与胰岛素敏感性密切相关,脂联素表达水平越低,胰岛素抵抗越严重。本研究运用高葡萄糖、高胰岛素、高葡萄糖+高胰岛素3种方法诱导心肌细胞,结果表明3组心肌细胞脂联素表达均下降。但高葡萄糖诱导法3H-D-葡萄糖掺入率与心肌细胞脂联素mRNA表达较对照组差异无统计学意义,未能诱导出胰岛素抵抗。而高胰岛素诱导法、高葡萄糖+高胰岛素法均可促使3H-D-葡萄糖掺入率显著下降、脂联素表达下降,促使细胞发生胰岛素抵抗。同时,3组中3H-D-葡萄糖掺入率与心肌细胞脂联素表达均呈显著正相关,进一步证明了心肌细胞脂联素是心肌细胞胰岛素抵抗的标志物。
胰岛素抵抗不一定都伴有高血糖,高葡萄糖+高胰岛素诱导的胰岛素抵抗心肌细胞更符合高血糖伴胰岛素抵抗的2型糖尿病机体的内环境状态,更适合作为研究2型糖尿病的心肌细胞模型。
[1] ERDMANN E,DORMANDY J,WILCOX R,et al.PROactive 07:pioglitazone in the treatment of type 2 diabetes:results of the PROactive study[J].Vasc Health Risk Manag,2007,3(4):355-370.
[2] BETTERIDGE DJ.Effects of pioglitazone on lipid and lipoprotein metabolism[J].Diabetes Obes Metab,2007,9(5):640-647.
[3] CHUNG CP,LONG AG,SOLUS JF,et al.Adipocytokines in systemic lupus erythematosus:relationship toinflammation,insulin resistance and coronary atherosclerosis[J].Lupus,2009,18(9):799-806.
[4] KANZAKIM.Insulin receptorsignals regulating GLUT4 translocation and actin dynamics[J].Endocr J,2006,53(3):267-293.
[5] BRUSCATO NM,VIEIRA JL,DO NASCIMENTO NM,et al. Dietary intake is not associated to the metabolic syndrome in elderly women[J].N Am J Med Sci,2010,2(4):182-188.
[6] PALANIVEL R,FANG X,PARK M,et al.Globular and fulllength forms of adiponectin mediate specific changes in glucose and fatty acid uptake and metabolism in cardiomyocytes[J]. Cardiovasc Res,2007,75(1):148-157.
[7] RAPP KD,STRIDSBERG M,ANDERSSON LG,et al.Insulinresistance after cardiopulmonary by pass in the elderly patient[J].Scand Cardiovase J,2007,41(2):102-108.
[8] FANG X,FETROS J,DADSON KE,et al.Leptin prevents the metabolic effects of adiponectin in L6 myotubes[J]. Diabetologia,2009,52(10):2190-2200.
[9] ZUO YQ,LIU WP,NIU YF,et al.Bis(alpha-furancarboxylato)oxovanadium(Ⅳ)prevents and improves dexamethasoneinduced insulin resistance in 3T3-L1 adipocytes[J].J Pharm Pharmacol,2008,60(10):1335-1340.
[10] MAKIMURA H,STANLEY TL,CHEN CY,et al.Relationship of adiponectin to endogenous GH pulse secretion parameters in response to stimulation with a growth hormone releasing factor[J].Growth Horm IGF Res,2011,21(3):155-159.
[11] CHEN Q,XIA Y P,QIU ZY.Establishment of insulin-resistant HepG2 cellmodel induced by high concentration of insulin[J]. Chin Jcell Biol,2005,27(3):334-338.
[12] BASTARD JP,MAACHI M,LAGATHU C,et al.Recent advances in the relationship between obesity,inflammation,and insulin resistance[J].Eur Cytokine Netw,2006,17(1):4-12.
[13] KRUSZYNSKA YT,YU JG,OLEFSY JM,et al.Effeets of troglitazone on blood coneentrationsofPlasmonigenactivator inhibitor 1 in patients with type 2 diabetes and in lean and obese normal subjects[J].Diabetes,2000,49(4):633-639.
[14] SASAKI-SUZUKI N,ARAI K,OQATA T,et al.Growth hormone inhibition of glucose uptake in adipocytes occurs without affecting GLUT4 translocation through an insulin receptor substrate-2-phosphatidylinositol 3-kinase-dependent pathway[J].J Biol Chem,2009,284(10):6061-6070.
[15] HAZEL M,COOKSEY RC,JONES D,et al.Activation of the hexosamine signaling pathway in adipose tissue resultsin decreased serum adiponectin and skeletalmuscle insulin resistance[J].Endocrinology,2004,145(5):2118-2128.
(本文编辑:赵丽洁)
ESTABLISHMENT AND EVALUATION OF INSULIN RESISTANCE CARDIOCYTES MODEL
WANG Mei,LI Yongjun*,LIU Suyun,ZHANG Hui,YANG Rong,MIAO Chenglong
(Department of Cardiology,the Second Hospital of Hebei Medical University,Shijiazhuang 050000,China)
ObjectiveTo establish insulin resistance cardiocytes model.MethodsCardiocytes were cultured for 24h and 48h in vitro and were divided into four groups:control group(control),glucose group(G),insulin group(Ins),glucose and insulin group(G+Ins).The adiponectin(APN)expression in those groups was tested and the insulin sensitivity was evaluated by3H-D -glucose mixing experiment.Results3H-D-glucose mixing rate in Ins group(12.46±1.11)nmol·mg-1·h-1and G+Ins group(10.61±1.14)nmol·mg-1·h-1were all lower than control group(14.06±0.43)nmol· mg-1·h-1(P<0.05).APN expression in Ins group 0.35±0.04,G+Ins group 0.38±0.04,were all lower than control group 0.77±0.08 after 48h(P<0.05).3H-D-glucose mixing rate in four groups was positively related to APN expression(P<0.05).ConclusionThe insulin resistance cardiocytes model can be established by high insulin or high glucose+insulin.Insulin resistance down-regulates cardiocytes adiponectin expression.Insulin resistance is positively related to APN expression.
myocytes,cardiac;insulin;models,animal
R965.1
A
1007-3205(2012)09-0993-04
2012-03-10;
2012-06-14
河北省卫生厅重大科技攻关项目(20100075)
王梅(1973-),女,河北石家庄人,河北医科大学第二医院副主任医师,医学博士,从事心血管疾病诊治研究。
*通讯作者。E-mail:lyjbs2009@yeah.net
10.3969/j.issn.1007-3205.2012.09.001

