HTPP-MDC原核表达载体的构建及在大肠杆菌中的表达
卢雪梅,黄演婷,金小宝,汪 洁,朱家勇
(1.广东药学院 药用生物活性物质研究所,广东 广州 510006;2.广东省生物活性药物研究重点实验室,广东 广州 510006)
乙型肝炎病毒(Hepatitis B virus,HBV) 主要在肝细胞内寄生和复制,导致急慢性乙型肝炎的发生,甚至引起肝硬化和肝癌[1],目前临床上用于抗HBV的药物无组织和器官选择性,疗效不够理想。作者在前期研究中将肝靶向穿膜肽(Hepatocyte-targeting and penetrating peptide,HTPP)与家蝇抗菌肽天蚕素(Muscadomesticacecropin,MDC)融合,构建的肝靶向穿膜融合多肽 HTPP-MDC有望成为定位准确、高效结合、竞争性阻断和靶向杀伤的新型抗HBV药物,对降低乙型肝炎病毒感染引起的肝脏疾病的发病率和死亡率具有深远的意义。
但如何低成本、大量获得多肽类药物以满足其开发与应用的需求是科研工作者积极探索的课题。目前,多肽类药物的来源主要有以下几种:(1)直接从生物体分离纯化,由于数量太少且成本太高,作为应用开发几乎是不可能。(2)根据蛋白质的氨基酸序列,进行人工合成,也存在成本高、活性低等一系列问题[2]。(3)利用基因工程技术生产,该领域的飞速发展为低成本多肽类药物生产提供了一种可持续方案。通过基因重组技术,可大量高效地生产多种生物活性多肽如干扰素、生长因子等,在肿瘤、乙肝、神经系统疾病、创伤以及艾滋病等治疗领域得到了广泛应用[3]。
作者在此利用基因重组技术将目的基因亚克隆入原核表达载体pET32a(+)中,构建重组原核表达质粒,通过大肠杆菌表达,采用 SDS-PAGE 和 Western blot 对表达产物进行检测与鉴定,拟为HTPP-MDC的生物学活性研究及产业化开发奠定基础。
1 实验
1.1 材料与试剂
宿主菌E.coliDH5α、E.coliBL21(DE3),质粒HTPP-MDC/pMD20-T,自行保存;质粒pET32a(+),Novagen公司;限制性内切酶KpnⅠ、HindⅢ、T4DNA 连接酶、Taq DNA 聚合酶、DNA分子量标准,TaKaRa公司;TIANgel Midi Purification Kit、TIANpure Midi Plasmid Kit,北京TIANGEN公司;蛋白质分子量标准,Fermentas公司;丙烯酰胺、N,N′-亚甲基双丙烯酰胺、SDS,Sigma公司;TEMED,北京鼎国生物公司;6×His Tag小鼠单克隆抗体、HRP标记的山羊抗小鼠IgG抗体,美国Pharmacia公司;DAB显色试剂盒,武汉博士德公司;其它化学试剂为进口或国产分析纯。
1.2 表达载体的构建
以质粒HTPP-MDC/pMD20-T为模板,用上游引物P1:5′-CGGGGTACCGACGACGACGACAAGAA-TAGTCGTTCACTTG-3′和下游引物P2:5′-CCC-AAGCTTATTAGTTACCCTTTAATGTGGCGGC-A3′(下划线为酶切位点,粗斜体为肠激酶酶切位点) PCR扩增出目的基因。将获得的PCR片段和表达载体pET32a(+)分别用限制性内切酶KpnⅠ 和HindⅢ进行双酶切,回收酶切产物后,用T4DNA连接酶连接过夜,连接产物转化E.coliBL21(DE3),转化菌种涂于含有氨苄青霉素的平板,培养16~18 h后,挑取单菌落培养后进行菌液PCR、酶切鉴定及DNA测序验证。
1.3 融合基因的诱导表达及表达产物鉴定
将纯化的HTPP-MDC/pET32a质粒转化E.coliBL21(DE3)感受态细胞,经氨苄青霉素抗性筛选,挑取阳性单菌落于5 mL LB液体培养基(1%的蛋白胨,0.5%的酵母抽提粉,85 mmol·L-1的氯化钠)中,37 ℃、220 r·min-1培养8~12 h,然后将此菌液按1∶100比例接种到新鲜的LB液体培养基中,37 ℃、220 r·min-1培养至OD600=0.6时,加入终浓度为1.0 mmol·L-1的IPTG诱导4~6 h,离心收集菌体,进行15% SDS-PAGE电泳。
将收集的菌体重悬于0.1 BV预冷的细菌裂解液(0.2 mol·L-1NaCl,1 mmol·L-1EDTA,25 mmol·L-1Tris-HCl,pH值8.0)中,在超声波破碎仪下破碎12 min(功率250 W,开6 s,停6 s),然后于4 ℃、14 000 r·min-1下离心30 min,分别取上清和沉淀进行15% SDS-PAGE,分析表达产物的可溶性。
IPTG诱导后的表达产物经15%的SDS-PAGE电泳后通过半干电转仪转移至硝酸纤维素膜(Polyvinylidene difluoride,PVDF)上,以6×His Tag小鼠单克隆抗体为一抗,HRP标记的山羊抗小鼠IgG抗体为二抗,用DAB显色系统显色,检测分析Western blot结果。
2 结果与讨论
2.1 表达载体的构建
用PCR方法从HTPP-MDC/pMD20-T质粒中扩增目的基因HTPP-MDC,片段长度为220 bp,凝胶电脉检测其大小与预期一致(图1)。经KpnⅠ和HindⅢ双酶切后产生含有目的基因的DNA片段,定向插入经KpnⅠ和HindⅢ双酶切的含有6×His的pET32a(+)表达载体中,从而构建重组质粒HTPP-MDC/pET32a(图2)。在含有氨苄青霉素的平板上挑取重组质粒HTPP-MDC/pET32a转化后的E.coliBL21单菌落培养并进行菌液PCR,初步鉴定为阳性的克隆摇菌提取质粒进行KpnⅠ/HindⅢ双酶切鉴定,结果表明重组质粒经KpnⅠ/HindⅢ双酶切出与预期大小一致的条带(图3),验证的质粒经DNA测序分析,无碱基错配,最终确定重组表达质粒HTPP-MDC/pET32a构建成功。

M.DL2000 DNA Marker 1.HTPP-MDC PCR扩增产物
图2 HTPP-MDC/pET32a重组质粒图谱

M1/M2.DL2000/DL10 000 DNA Marker 1.重组质粒的PCR鉴定 2.经Kpn Ⅰ、Hin dⅢ双酶切的重组质粒
2.2 融合基因的诱导表达及表达产物的鉴定
将构建成功的重组表达质粒转化E.coliBL21(DE3)感受态细胞,诱导4~6 h后取样,经15% SDS-PAGE电泳检测在大小约25 kDa处出现蛋白条带,而未诱导的菌体蛋白未出现相应的条带(图4)。这是因为,载体pET32a(+)具有Trx标签,蛋白分子量约为18 kDa,而HTPP-MDC分子量约为7 kDa,因此表达的蛋白分子量约25 kDa。超声破碎后离心取上清和沉淀进行15% SDS-PAGE分析,结果显示:表达蛋白主要存在上清中,为可溶性表达(图4)。

M.蛋白质分子量标准 1,2.E.coli BL21/pET32a-HTPP-MDC诱导前和诱导后 3,4.E.coli BL21/pET32a-HTPP-MDC诱导后裂解液上清和沉淀
由于融合蛋白含有pET32a(+)编码的6×His标签,采用鼠源His单克隆抗体为一抗进行Western blot,结果显示诱导后的含重组质粒表达菌株在25 kDa处有一条特异性条带而未诱导的没有,进一步证实了表达的蛋白为带有His标签的融合蛋白(图5)。
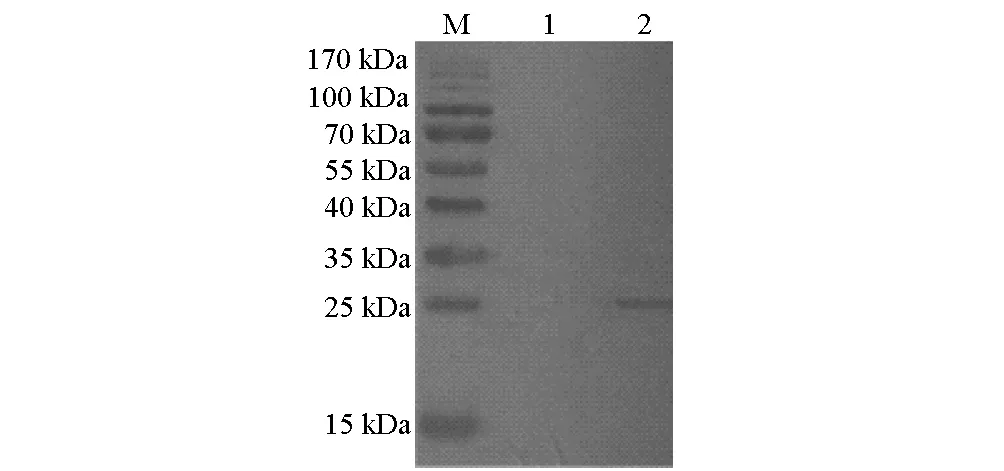
M.蛋白质分子量标准 1,2.E.coli BL21/pET32a-HTPP-MDC诱导前和诱导后全菌蛋白
2.3 讨论
大肠杆菌表达系统具有培养周期短、成本低廉、目的基因表达水平高等特点,是生物技术研究和生物药物产业化进程中的重要工具。但如果表达的生物活性多肽本身具有抗菌活性,则对表达宿主菌具有杀伤作用,即所谓工程菌表达“毒性”蛋白时出现“自杀”现象,其直接表达较困难。另外,利用基因工程技术表达小分子多肽时,产物容易降解,得率较低。因此,表达这类多肽时采用融合表达方式较为理想。应用原核表达系统表达后,通过工具酶切除融合标签,可得到具有天然活性的重组多肽[4]。
本研究采用的原核表达载体为pET32a(+),它是一种带有T7噬菌体Lac强启动子的原核高效融合表达载体,载体中的硫氧还原蛋白标签(Trx Tag)和外源基因一同表达,不仅能增强融合表达蛋白的溶解性,而且在保护融合蛋白免受蛋白酶降解时也起到一定作用[5]。但标签蛋白会在一定程度上影响目的蛋白的生物学活性,所以在很多时候需要将标签蛋白切除[6]。常用酶切割的方法切除标签蛋白[7,8],其中肠激酶最为常用。pET32a(+)载体中本身带有一个肠激酶酶切位点,但如果利用其本身的这个肠激酶酶切位点,由于限制性内切酶位点的存在,酶切后的目的蛋白会在N端引入不必要的氨基酸残基,有可能对目的蛋白的功能产生一定的影响。因此,本研究在构建重组表达质粒时,在目的基因前加入了编码肠激酶酶切位点的核苷酸序列,表达出来的融合蛋白经肠激酶酶切后产生目的蛋白的天然N末端,从而保证了目的蛋白的完整性和真实性。
3 结论
通过双酶切、连接、转化等方法成功构建了融合表达质粒HTPP-MDC/pET32a,转化E.coliBL21(DE3),经IPTG诱导,SDS-PAGE分析表明重组融合蛋白为可溶性表达,Western blot杂交证实了表达蛋白的抗原活性。为HTPP-MDC后续的生物学活性研究及产业化开发应用奠定了基础。
参考文献:
[1]Kew M C.Epidemiology of chronic hepatitis B virus infection,hepatocellular carcinoma,and hepatitis B virus-induced hepatocellular carcinoma[J].Pathol Biol(Paris),2010,58(4):273-277.
[2]Hancock R E,Patrzykat A.Clinical development of cationic antimicrobial peptides:From natural to novel antibiotics[J].Curr Drug Targets Infect Disord,2002,2(1):79-83.
[3]Goeddel D V,Heyneker H L,Hozumi T,et al.Direct expression inEscherichiacoliof a DNA sequence coding for human growth hormone[J].Nature,1979,281(5732):544-548.
[4]Lu X M,Jin X B,Zhu J Y,et al.Expression of the antimicrobial peptide cecropin fused with human lysozyme inEscherichiacoli[J].Appl Microbiol Biotechnol,2010,87(6):2169-2176.
[5]Zhou L,Zhao Z,Li B,et al.TrxA mediating fusion expression of antimicrobial peptide CM4 from multiple joined genes inEscherichiacoli[J].Protein Expr Purif,2009,64(2):225-230.
[6]Erturk-Hasdemir D, Broemer M, Leulier F, et al. Two roles for theDrosophilaIKK complex in the activation of Relish and the induction of antimicrobial peptide genes[J].Proc Natl Acad Sci USA,2009,106(24):9779-9784.
[7]Huang L,Leong S S,Jiang R.Soluble fusion expression and characterization of bioactive human beta-defensin 26 and 27[J].Appl Microbiol Biotechnol,2009,84(2):301-308.
[8]Huang L,Ching C B,Jiang R,et al.Production of bioactive human beta-defensin 5 and 6 inEscherichiacoliby soluble fusion expression[J].Protein Expr Purif,2008,61(2):168-174.

