体外连续传代培养对生物工程细胞CHO凋亡的影响
高 茜,管 莹,曾婉俐,朱洲海,李雪梅,缪明明,夭建华
(云南烟草科学研究院,云南 昆明 650106)
中国仓鼠卵巢(Chinese hamster ovary,CHO)细胞由于生长快、易培养,被广泛应用于生物工程和化学物质的毒理学评价。全球至少70%的药物蛋白来源于CHO细胞系,用CHO细胞生产的生物制品每年超过300万美元[1]。国内外很多组织与机构都采用CHO细胞系来评价化学品或食品添加剂的毒性:OECD化学物质试验指南中推荐采用CHO细胞作为哺乳动物基因突变检测的细胞系[2],FAO/WHO食品添加剂联合专家委员会(JECFA)使用CHO细胞系来评价食品添加剂的安全性[3],加拿大卫生部和雷诺公司采用CHO细胞系用来评价卷烟烟气的细胞毒性[4]。
细胞长期的连续传代培养会对其结构与功能特性造成影响,最终导致基因工程蛋白产量的降低以及检测结果的不稳定。有报道指出,细胞培养时间的延长将增加培养体系中诱导细胞凋亡的环境压力,触发细胞凋亡[5]。细胞凋亡是指为维持内环境稳定,由基因控制的细胞自主的有序的死亡;而细胞坏死是细胞受到强烈理化或生物因素作用引起细胞无序变化的死亡。作为一个程序性细胞死亡的模式,细胞凋亡是一个对于外部信号或者内部压力的有效的控制和监管机制。虽然对于动物细胞在生物反应器中大规模培养的细胞凋亡有所报道[6],但是对于其体外连续传代培养的凋亡状况却少有研究。因此,作者在此对CHO细胞进行了连续传代培养,并对其凋亡情况进行了研究,以期为CHO细胞的蛋白生产及化学品的毒理学评价提供依据。
1 实验
1.1 细胞、试剂与仪器
中国仓鼠卵巢细胞,中国科学院昆明细胞库;DMEM/F12细胞培养液、PBS、胎牛血清,美国Giboco公司;胰蛋白酶,美国Invitrogen公司;Annexin V-FITC/PI双染细胞凋亡检测试剂盒,南京凯基公司;JC-1和细胞凋亡阳性对照试剂盒,碧云天公司;Caspase-3底物Ac-DEVD-pNA、Caspase-8底物Ac-IETD-pNA,美国Sigma公司。
流式细胞仪(FACSVantage SE)、流式管,BD Biosciences公司;荧光显微镜(90i)、TS100-F-HMC型倒置显微镜,Nikon公司;CO2培养箱,Thermo公司;二级生物安全柜,Heal Force公司;6孔板、96孔板、细胞培养瓶,美国Corning公司;XS204型分析天平,Mettler Toledo公司;DT5-5型离心机,北京时代北利离心机有限公司;全波段便携式分光光度计,GE公司。
1.2 方法
1.2.1 CHO细胞的连续传代培养
在37 ℃水浴中复苏CHO细胞,接种到细胞培养瓶中。调整细胞密度,用DMEM/F12完全培养液(含10%胎牛血清)在5% CO2、37 ℃的细胞培养箱中培养,此时记为第1代细胞。待细胞汇合率达到80%后按1∶4的比例传代,传代后记为第3代,连续培养至细胞生长停滞为止,共传到17代。
1.2.2 细胞样品处理
每隔4代取CHO细胞,用胰蛋白酶消化细胞并接种于6孔板,每孔约5×105个细胞。正常培养24 h后将细胞分为两组,一组不做处理,另一组加入细胞凋亡诱导试剂Apopida(1/3000倍稀释),两组都继续于培养箱中培养24 h,然后弃去培养液,用PBS洗涤后用胰蛋白酶消化收集细胞,进行Annexin V-FITC/PI双染检测、线粒体膜电位去极化检测、Caspase-3及Caspase-8的酶活性测定。
1.2.3 Annexin V-FITC/PI双染检测
细胞凋亡与坏死用Annexin V-FITC/PI双染法检测[7]。将收集的细胞重悬于Annexin V-FITC/PI双染检测试剂盒中的Binding buffer中,细胞浓度约为5×105个·mL-1。取500 μL的细胞悬液,加入5 μL AnnexinV-FITC混匀后,再加入5 μL Propidiumiodide(PI),混匀。室温避光反应10 min后用流式细胞仪进行检测。每个样品的数据统计与分析使用至少10 000个细胞。
1.2.4 线粒体膜电位的检测
线粒体膜电位用JC-1染色法检测[8]。将收集的细胞重悬于PBS中,细胞浓度约为5×105个·mL-1。加入JC-1,终浓度为2 μg·mL-1。样品在黑暗中于37 ℃孵育20 min,然后用流式细胞仪分析。细胞用前向散射(FSC)和侧散射(SSC)的门控来分析。每个样品的数据统计与分析使用至少10 000个细胞。
1.2.5 Caspase-3及Caspase-8的酶活性测定
Caspase-3及Caspase-8的酶活性用产生的四肽p-硝基苯胺(pNA)底物来做比色测定[9]。处理后的细胞用细胞裂解液裂解。然后将含有30 μg蛋白质的细胞裂解物与50 μmol·L-1Ac-DEVD-pNA(Caspase-3底物)或50 μmol·L-1Ac-IETD-pNA(Caspase-8底物)孵育。反应体积为100 μL,反应缓冲溶液如下:50 mmol·L-1Hepes,pH值7.5,10 mmol·L-1DTT,1 mmol·L-1EDTA,1% 蔗糖,0.1% Chaps。反应物置于96孔板,37 ℃下孵育。总反应时间持续4 h,其中每隔30 min取出一组在405 nm波长处测定吸光度。对底物裂解速度(pmol硝基苯胺·min-1·μg-1总蛋白)用标准硝基苯胺来校准。
2 结果与讨论
2.1 连续传代培养CHO细胞凋亡和坏死的检测结果
图1为不同代次CHO细胞在凋亡诱导剂Apopida诱导下的凋亡与坏死散点图。

图1 连续传代培养的CHO细胞在凋亡诱导剂存在下的凋亡与坏死象限图
Annexin V与磷脂酰丝氨酸(PS)有高度亲和力,在细胞凋亡早期,细胞膜中的磷脂酰丝氨酸由脂膜内侧翻向外侧。对凋亡晚期的细胞和坏死细胞,PI能够透过细胞膜而使细胞核染红。因此,AV+/PI-象限为早期凋亡细胞,AV+/PI+象限为晚期凋亡细胞或坏死细胞。由图1可知,在相同浓度的凋亡诱导剂作用下,细胞在前9代被诱导发生的凋亡率(AV+/PI-象限)比较稳定,而在第13代及第17代时,细胞被诱导的凋亡率显著上升,柱形统计结果见图2。

图2 连续传代培养的CHO细胞凋亡柱形统计图
由图2可知,在连续传代9代之前,细胞的自然凋亡率均较低(<2%),且没有显著变化,在第13代时,细胞的自然凋亡率显著上升(3倍于第1代细胞)。
由图1可知,第9代之前的细胞的坏死率没有明显改变,但在第13代及第17代时,细胞的坏死率上升,柱形统计结果见图3。
由图3可知,与细胞凋亡情况相近,在连续传代9代之前细胞的自然坏死率非常低(<1%)。但与凋亡状况不同的是,细胞在第13代及第17代时仍没有明显的自然坏死。
由此可见,随着连续传代次数的增加,CHO细胞的生长状态发生了改变,在第9代以后,细胞状态逐渐变得不稳定,对凋亡诱导剂的反应也更为敏感,而在第13代以后,细胞在凋亡诱导剂的作用下发生坏死现象。

图3 连续传代培养的CHO细胞坏死柱形统计图
2.2 连续传代培养CHO细胞线粒体膜电位检测结果
图4为连续传代的CHO细胞在凋亡诱导剂Apopida存在下的线粒体膜电位的散点图。

图4 连续传代培养的CHO细胞在凋亡诱导剂存在下的线粒体膜电位散点图
用亲脂阳离子JC-1作为检测线粒体膜电位的探针。在非凋亡细胞中,JC-1在胞浆以绿色单体形式存在,在线粒体以红色聚集体形式存在。而在凋亡细胞中,线粒体膜电位消失,JC-1仅以单体的形式存在于细胞质中,因此通过检测红色荧光和绿色荧光的比例来观察线粒体膜电位的变化。由图4可知,在相同浓度的凋亡诱导剂诱导下,第13代及第17代细胞表现得更为敏感,线粒体膜电位下降的细胞比率比第1代细胞显著上升,柱形统计结果见图5。

图5 连续传代培养的CHO细胞线粒体膜电位柱形统计图
由图5可知,在连续传代第9代后,细胞线粒体膜电位有所下降,尤其在凋亡诱导剂存在的情况下,细胞线粒体膜电位下降明显。
2.3 连续传代培养CHO细胞Caspase-3活性比较(图6)
Caspase-3作为一个效应Caspase,在凋亡过程中起着重要的作用[10]。为了进一步检测CHO细胞在连续传代过程中是否引起细胞凋亡,用切割底物Ac-DEVD-pNA来检测Caspase-3是否被激活。由图6可知,在无凋亡诱导剂存在的情况下,Caspase-3的活性在前9代未发生明显变化,第13代时略有上升。而在凋亡诱导剂存在的情况下,第13代及第17代细胞的Caspase-3酶活性都高于第9代之前的细胞。
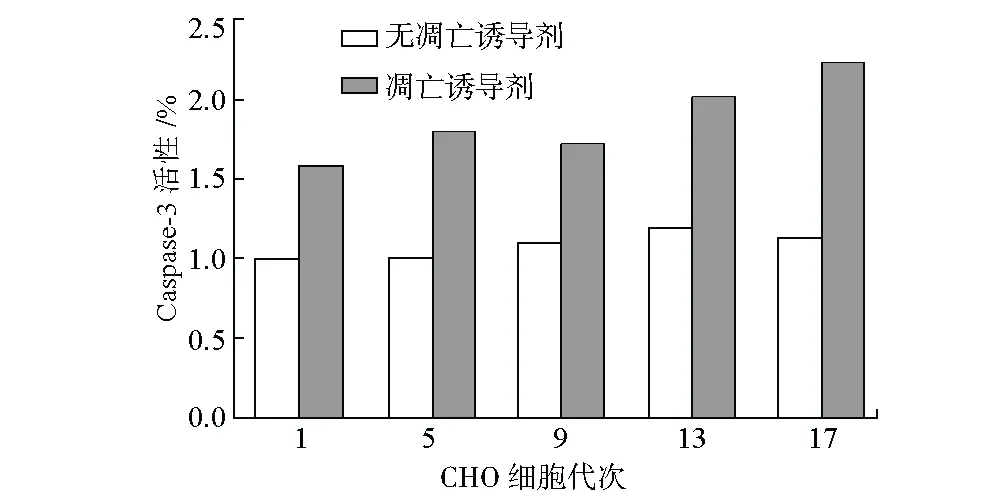
图6 连续传代培养的CHO细胞Caspase-3活性检测图
2.4 连续传代培养CHO细胞Caspase-8活性比较(图7)

图7 连续传代培养的CHO细胞Caspase-8活性检测图
Caspase-8的活化是外源性细胞凋亡中的关键步骤[11],采用Ac-IETD-pNA检测连续传代CHO细胞是否有Caspase-8的激活。由图7可知,在没有凋亡诱导剂存在时,Caspase-8的酶活性在第1代到第17代细胞中均没有明显的变化。而在凋亡诱导剂存在的情况下,其酶活性在第1代到第17代细胞中并未产生明显的改变,表明Caspase-8未被激活。
2.5 讨论
CHO细胞虽属于无限细胞系,但长期的连续培养仍可能对其结构与功能造成不良影响[12]。
蛋白激酶RIP3是启动细胞凋亡和程序性坏死的重要分子开关,可以将肿瘤坏死因子诱导的细胞凋亡转换为细胞坏死[13]。本研究发现,本实验室所使用CHO细胞在连续传代第9代之前的状态较为稳定,细胞自然凋亡率很低,但随着培养时间的延长和传代次数的增加,细胞自然凋亡率逐渐升高,说明细胞的生长状态发生了改变。同时,细胞对凋亡诱导剂的反应也更为敏感,细胞出现凋亡的比例上升,而随着传代培养的继续,细胞对凋亡诱导剂出现了坏死反应,说明细胞的状态进一步恶化,这与国际上对于细胞凋亡和坏死的转变的研究是一致的。
线粒体膜电位下降是细胞凋亡另一个重要特征之一,Bax、Bak、Bcl-2和Bcl-XL通过控制线粒体膜的通透性从而调节细胞凋亡[14]。JC-1染色法表明CHO细胞线粒体膜电位在连续传代9代之后有所下降,尤其是在凋亡诱导剂存在的情况下,线粒体膜电位的下降更为明显。线粒体膜电位的消失将导致细胞色素c从线粒体中释放并与凋亡相关因子1(Apaf-1)结合,形成多聚体,并促使Caspase-9与其结合形成凋亡小体,Caspase-9被激活,进而激活其它的Caspase如Caspase-3等,从而诱导细胞凋亡。
细胞凋亡的途径主要有两条,一条是通过上述的线粒体释放细胞色素c从而激活Caspase(内源性凋亡途径),另一条是通过胞外信号激活细胞内的Caspase(外源性凋亡途径)。这些活化的Caspase可将细胞内的重要蛋白降解,引起细胞凋亡。在外源性细胞凋亡途径中,Caspase-8的前体被死亡效应结构域(Death effector domains)募集到死亡诱导信号复合物上,然后通过自剪切激活自身。下游的效应Caspases比如Caspases-1、Caspases-3、Caspases-6、Caspases-7被激活的Caspase-8切割并激活[15]。本研究证明了第5代后的CHO细胞的Caspase-3被激活,而Caspase-8并未被激活,这说明外部凋亡途径可能未参与凋亡。而线粒体膜电位的下降也表明连续传代培养的CHO细胞凋亡可能主要是通过内部凋亡途径。
有研究报道连续传代培养STO细胞(小鼠胚胎成纤维细胞)会发生退行性变化,但是定期解冻STO细胞复苏使用,可恢复其生长状况[16]。因此,虽然连续传代培养的CHO细胞会发生凋亡,但其经过冻存后是否有所恢复还有待进一步研究。另外,由于本研究的CHO细胞购自于昆明细胞库,没有详细的冻存次数及细胞代次等资料,因此其它来源的CHO细胞的连续传代培养应根据实际情况进行凋亡指标等检测,从而控制其细胞状态,以利于生产和研究。
3 结论
采用Annexin V-FITC/PI双染法检测磷脂酰丝氨酸外翻、JC-1染色法检测线粒体膜电位、底物切割法检测Caspase-3及Caspase-8酶活性等4个指标来评估CHO细胞凋亡。CHO细胞经历长期连续传代培养后,会发生内部凋亡途径介导的细胞凋亡,同时对凋亡诱导剂的敏感性显著增加。因此建议在生物工程生产和化学品毒理学评价检测时,可采用凋亡指标来检测细胞状态,从而提高基因工程菌蛋白的生产效率及化学品毒理学评价的准确性。
参考文献:
[1]Jayapal K P,Wlaschin K F,Hu W,et al.Recombinant protein the-rapeutics from CHO cells-20 years and counting[J].Chemical Engineering Progress,2007,103(10):40-47.
[2]OECD-1998,OECD Guidelines for testing of chemicals[S].
[3]FOOD W-2010,Safety evaluation of certain food additives[S].
[4]Johnson M D,Schilz J,Djordjevic M V,et al.Evaluation ofinvitroassays for assessing the toxicity of cigarette smoke and smokeless tobacco[J].Cancer Epidemiol Biomarkers Prev,2009,18(12):3263-3304.
[5]Al-Rubeai M,Singh R P.Apoptosis in cell culture[J].Curr Opin Biotechnol,1998,9(2):152-156.
[6]叶玲玲,陈昭烈.动物细胞大规模培养过程中细胞凋亡的检测与控制[J].中国生物工程杂志,2003,23(8):1-6.
[7]吴兴新,孙洋,周晓斌,等.蟾毒它灵对人胃癌BGC-823细胞的促凋亡作用[J].中药新药与临床药理,2007,18(2):117-119.
[8]Xu Z,Lin S,Wu W,et al.Ghrelin prevents doxorubicin-induced cardiotoxicity through TNF-alpha/NF-[kappa] B pathways and mitochondrial protective mechanisms[J].Toxicology,2008,247(2-3):133-138.
[9]Liu Y,Zhang S P,Cai Y Q.Cytoprotective effects of selenium on cadmium-induced LLC-PK1 cells apoptosis by activating JNK pathway[J].ToxicolInVitro,2007,21(4):677-684.
[10]Porter A G,Jönicke R U.Emerging roles of Caspase-3 in apoptosis[J].Cell Death and Differentiation,1999,6(2):99-104.
[11]Nagata S.Apoptosis by death factor review[J].Cell,1997,88(3):355-365.
[12]Wei Y Y,Naderi S,Meshram M,et al.Proteomics analysis of Ch-inese hamster ovary cells undergoing apoptosis during prolonged cultivation[J].Cytotechnology,2011,63(6):663-677.
[13]Zhang D W,Shao J,Lin J,et al.RIP3,An energy metabolism regulator that switches TNF-induced cell death from apoptosis to necrosis[J].Science,2009,325(5938):332-336.
[14]Desagher S,Martinou J C.Mitochondria as the central control p-oint of apoptosis[J].Trends in Cell Biology,2000,10(9):369-377.
[15]Budihardjo I,Oliver H,Lutter M,et al.Biochemical pathways of caspase activation during apoptosis[J].Annual Review of Cell and Developmental Biology,1999,15(1):269-290.
[16]剧世强,卢晓,李冬,等.体外连续传代培养对STO细胞生长特性的影响[J].西北农林科技大学学报,2006,34(Z):190-194.

