6-[(1-乙基-2-对硝基苯基-4-硝基咪唑基-5-)硫基]嘌呤的合成
刘 娥
(荆楚理工学院化工与药学院,湖北 荆门 448000)
硫唑嘌呤(Azathioprine,6-AP),别名依木兰(Imuran),化学名为6-[(1-甲基-4-硝基咪唑基-5-)硫基]嘌呤,为嘌呤类抗代谢型药物,通过在体内转化为6-巯基嘌呤而显效[1]。目前主要用作免疫抑制剂,治疗自身免疫性疾病(如风湿性关节炎、血小板减少性紫癜、全身性红斑狼疮等)和预防组织、器官移植后的免疫排斥反应[2]。但对人体所致的肝毒性及白细胞减少等副作用影响了它的广泛应用[3]。
为了减轻药物的副作用并提高药效,作者基于硫唑嘌呤在体内的代谢过程和作用机制,结合其合成路线中的一般性方法及引入不同取代基对分子性质的影响,设计并合成了硫唑嘌呤的衍生物6-[(1-乙基-2-对硝基苯基-4-硝基咪唑基-5-)硫基]嘌呤,以期得到高效低毒的硫唑嘌呤替代药物。
合成路线如下:
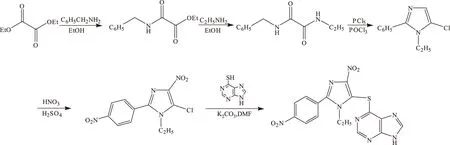
1 实验
1.1 试剂与仪器
6-巯基嘌呤(纯度98%),国药集团化学试剂有限公司;其它试剂均为市售化学纯。
XT-4型双目显微熔点测定仪(温度计未经校正);Nicolet NEXUS470型傅立叶变换红外光谱仪;Varian Mercury 300 MHz型核磁共振仪。
1.2 方法
1.2.1N-苄基草酰胺乙酯的合成
冰浴冷却下通过恒压滴液漏斗向装有81.5 mL(87.68 g,0.60 mol)草酸二乙酯的瓶中缓慢滴加54.6 mL(53.58 g,0.50 mol)苄胺,6 h滴完。抽滤,将滤液转移至250 mL圆底烧瓶中。用水泵减压依次蒸除反应产生的乙醇、过量的草酸二乙酯和可能存在的苄胺,再改用油泵减压蒸出产物,产物蒸汽温度156~158 ℃,冷凝后得无色油状液体57.4 g,然后凝固成白色块状晶体,即N-苄基草酰胺乙酯。
1.2.2N-乙基-N′-苄基草酰胺的合成
称取20.7 g(0.1 mol)N-苄基草酰胺乙酯置于100 mL烧杯中,微热使其熔化,加入100 mL无水乙醇,振摇并用超声辅助使其完全溶解后,通过恒压滴液漏斗将其缓慢滴入装有磁子搅拌、回流冷凝管和31.3 mL(6.76 g,0.15 mol)乙胺溶液(30%)的250 mL二口烧瓶中,立即有白色固体产生。生成的大量固体使得反应液非常粘稠,磁子搅拌效果不佳,需不时用玻璃棒辅助搅拌,3 h后抽滤,用蒸馏水洗涤滤饼,真空干燥,得白色固体粉末N-乙基-N′-苄基草酰胺19.0 g。
1.2.3 1-乙基-2-苯基-5-氯咪唑的合成
称取10 g(0.05 mol)N-乙基-N′-苄基草酰胺和20 mL POCl3置于反应瓶中,搅拌下缓慢地分批加入20.85 g(0.10 mol)PCl5,在80 ℃下反应3 h后,在室温下继续搅拌12 h,蒸除POCl3,冷却,将溶液倒入冷水中,用氯仿萃取,水相用氢氧化钠溶液调节pH值至有固体析出,得到1-乙基-2-苯基-5-氯咪唑6.17 g。
1.2.4 1-乙基-2-对硝基苯基-4-硝基-5-氯咪唑的合成
称取2.07 g(0.01 mol)1-乙基-2-苯基-5-氯咪唑置于反应瓶中,冰浴冷却下缓慢滴加5 mL浓硫酸(98%),固体逐渐溶解,再缓慢滴加5 mL浓硝酸(65%~68%)。于100 ℃反应2 h,冷却后倒入100 mL冰水中,有黄色固体析出,抽滤,用蒸馏水洗涤滤饼,真空干燥,得两种同分异构体相混合的黄色细针状晶体粉末1.52 g,收率约67.04%。用乙酸乙酯∶石油醚(2∶3)作为洗脱剂过柱,得到1-乙基-2-对硝基苯基-4-硝基-5-氯咪唑0.456 g。
1.2.5 6-[(1-乙基-2-对硝基苯基-4-硝基咪唑基-5-)硫基]嘌呤的合成
称取152 mg(0.89×10-3mol)一水合6-巯基嘌呤(6-MP·H2O)、2 mL DMF和267 mg(0.90×10-3mol)1-乙基-2-对硝基苯基-4-硝基-5-氯咪唑置于反应瓶中,再加入无水K2CO3,搅拌,在100 ℃下反应5 h后蒸出溶剂,将剩余物溶于丙酮中,滤出不溶物,通过柱层析得到6-[(1-乙基-2-对硝基苯基-4-硝基咪唑基-5-)硫基]嘌呤。
2 结果与讨论
2.1 反应中间体及产物的收率和熔点(表1)
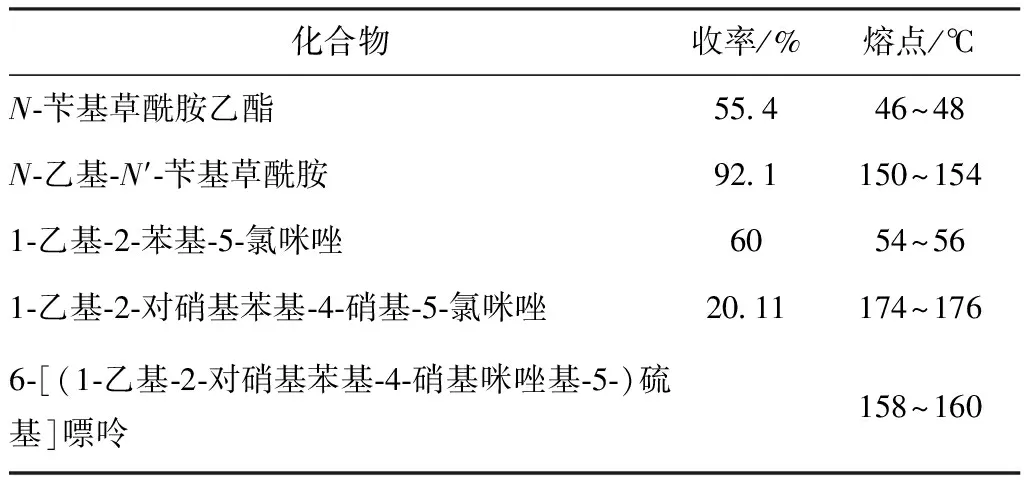
表1 反应中间体及产物的收率和熔点
2.2 1HNMR、IR及MS分析
N-苄基草酰胺乙酯:1HNMR(CDCl3),δ,ppm:7.27~7.39(m,5H,苯环CH),4.54(d,2H,PhCH2),4.37(q,2H,OCH2CH3),1.42(t,3H,OCH2CH3),NH信号被苯环CH的宽峰信号所掩盖。IR(KBr),ν,cm-1:3281.15(N-H st),3035.95(苯环C-H),2975.15(CH3C-H),2931.72(CH2C-H),1744.20(O-C=O),1682.36(NH-C=O),1534.20(N-C=O),1216.44(C-O),1019.28(C-O),744.90、702.65(单取代苯环C-H)。
N-乙基-N′-苄基草酰胺:1HNMR(CD3COCD3),δ,ppm:8.59(s,1H,CH3CH2NH),8.16(s,1H,PhCH2NH),7.23~7.35(m,5H,苯环CH),4.47(d,2H,PhCH2NH),3.30(m,2H,CH3CH2NH),1.14(t,3H,CH3CH2NH),2.05(CH3COCH3)。IR(KBr),ν,cm-1:3292.92(N-H st),1651.90(C=O st),3063.63、3032.53(苯环C-H st),2970.11(CH3C-H st),2934.38(CH2C-H st),1528.42(N-C=O st sy),1228.99(C-N st),1149.78(N-H ip),714.63(N-H oop),754.86、694.11(单取代苯环C-H oop)。
1-乙基-2-苯基-5-氯咪唑:1HNMR(DMSO),δ,ppm:7.55 (m,5H,苯环CH ),4.03 ( q,2H,CH2CH3),1.35 (t,3H,CH2CH3)。IR(KBr),ν,cm-1:1620~1640(C=N),3100、3030(咪唑环4位=C-H st和苯环C-H),1503.08、1469.88(咪唑环4、5位C=C),1106.71(咪唑环5位C-Cl),923.39、767.79、696.80(单取代苯环C-H)。
1-乙基-2-对硝基苯基-4-硝基-5-氯咪唑:1HNMR(DMSO),δ,ppm:8.40 (s,2H,苯环上H,靠近NO2),7.99 (s,2H,苯环上H,靠近咪唑环),4.18 (q,2H,CH2CH3),1.32 (t,3H,CH2CH3)。MS(EI),m/z:296(M+)。
6-[(1-乙基-2-对硝基苯基-4-硝基咪唑基-5-)硫基]嘌呤:1HNMR(CD3COCD3),δ,ppm:8.19( s,2H,苯环上H,靠近咪唑环),8.48 (s,2H,苯环上H,靠近NO2),4.46 (q,2H,CH2CH3),1.42(t,3H,CH2CH3)。MS(EI),m/z:413(M+H)+。
2.3 讨论
(1)制备N,N′-二取代草酰胺主要有两种方法:草酰氯与胺反应、草酸二乙酯与胺反应。草酸二乙酯与胺反应温和,放热少,稍用冰浴冷却或直接在室温下进行即可,而且反应中没有HCl酸气放出。但是,由于酯的活性不及酰氯,因此其胺解反应受胺上的烃基大小即空间位阻的影响较大。实验发现,甲胺与草酸二乙酯反应生成化合物的收率为96.5%,当原料换作苄胺、乙胺分别生成相应化合物时,收率降低至55.4%、45.0%。相反,采用高反应活性的酰氯与乙胺反应,收率提高至67.3%,但反应非常剧烈,放热量大,需在充分冷却下缓慢进行,加之酰氯易水解,反应体系要保证干燥,还需要安装尾气吸收装置处理反应产生的HCl酸气。
(2)本研究仅合成了一种硫唑嘌呤的衍生物。通过查阅文献,发现引入丙基、丁基或者碳链更长的烷基时,也可以环化得到咪唑环化合物,进一步得到硫唑嘌呤的衍生物。
(3)合成1-乙基-2-对硝基苯基-4-硝基-5-氯咪唑的过程中,若一端为芳环、另一端为烷基时硝化,得到的是两种同分异构体的混合物,通过选择适当的洗脱剂柱层析,可以得到各自的纯物质。但由此造成产物损失较大。如何使得两种物质得到较好的分离且损失较小,有待进一步的研究。
(4)合成路线中最后一步反应为SN2亲核取代反应,6-巯基嘌呤中的6位-SH作为亲核基团进攻咪唑环上的5位C原子,同时Cl原子以Cl-形式离去,之后在碱催化下S原子上的质子脱去,形成产物。SN2反应的一个显著特点就是受反应中心邻近基团的空间位阻影响较大。实验结果显示,在反应中心(咪唑环5位)邻近的1、2位上基团最小的化合物进行反应的产率最高(40.2%);当稍远的2位变为体积较大的对硝基苯基时,收率明显下降(12.1%)。相对而言,乙基较甲基的空间体积并未增大很多,但由于其与反应中心的空间距离最近,加之亲核基团-SH自身也带有一个体积庞大的嘌呤基团,因此该反应表现出对咪唑5位邻近的1、2位,特别是1位基团的空间位阻非常敏感。
3 结论
通过分析硫唑嘌呤在体内的代谢过程和作用机制,结合其合成路线中的一般性方法及引入不同取代基对分子性质的影响,设计并合成了嘌呤类化合物6-[(1-乙基-2-对硝基苯基-4-硝基咪唑基-5-)硫基]嘌呤。产物及中间体均采用1HNMR和IR进行结构表征和确证,部分化合物用质谱表征。结果表明,对硫唑嘌呤进行结构改造具有一定的可行性,得到的改造产物为其与先导化合物(硫唑嘌呤)作药理学、药代动力学等研究提供了基础。
参考文献:
[1] 仉文升,李安良.药物化学[M].北京:高等教育出版社,1999:494-495.
[2] 郑虎.药物化学(第五版)[M].北京:人民卫生出版社,2005:224-225.
[3] Hoffmann M,Rychlewski J,Chrzanowska M,et al.Mechanism of activation of an immunosuppressive drug:Azathioprine.Quantum chemical study on the reaction of azathioprine with cysteine[J].J Am Chem Soc,2001,123(26):6404-6409.

