植物根系及其分泌物对微生物生长及活性的影响
鲁 莽
(景德镇陶瓷学院材料科学与工程学院,江西 景德镇 333403)
植物根系能向根际释放多种有用的小分子化合物。陆生植物所能经历的一些复杂的物理、化学和生物的相互作用,通常出现在根系与其周围的土壤环境即根际间,如根-根、根-昆虫以及根-微生物之间。过去数十年来,学术界在不懈地努力探索这些不同类型的相互作用[1],其中根系分泌物在调节这些生物相互作用中的重要性已被认可[2~4]。根际代表一个高度动态的相互作用的前线,位于根系与致病或有益土壤微生物、无脊椎动物及竞争性根系之间[1]。然而,因为植物根系深藏在地下,其中的许多现象难为人知,尤其是一些化学信息在调节地下生物相互作用中的角色才刚被认识。植物根系与其它土壤微生物和邻近植物根系间的化学信息传递通常基于根诱导的化学物质。同一化学信息可对不同的受体诱导出相异的响应。根系分泌物的化学成分可阻止某一生物体而吸引另一生物体,也可能吸引两种对植物有不同作用的差异很大的生物体。
根系分泌物的产生量随植物的种类、栽培品种、株龄及胁迫因素而异。大量的有机化合物释放在幼根表面[5],这些物质有高分子量的多聚糖和多种低分子量的有机物,如简单的多糖(树胶醛糖、麦芽糖、果糖、葡萄糖、甘露糖、寡糖)、氨基酸(精氨酸、半胱氨酸、胱氨酸、天冬酰胺酸、谷氨酸)、有机酸(乙酸、安息香酸、苹果酸、阿魏酸)和酚类物质等。此外,根系也以较大的量释放一些大分子物质诸如类黄酮、酶、脂肪酸、生长调节剂、核苷酸、丹宁酸、类固醇、类萜、生物碱、多炔、维生素等。这些化合物中的多种涉及到初级或次级的植物代谢过程和植物抗性[6]。作者在此收集人工培养得到的植物(黑麦草、高羊茅及紫花苜蓿)根系及其分泌物,并探讨其对微生物生长及活性的影响。
1 实验
1.1 材料和试剂
轻质原油(饱和烃65.14%,芳烃24.37%,胶质9.02%,沥青质1.47%),大港油田。
高羊茅、黑麦草和紫花苜蓿为试验用植物,种子购自北京百绿公司。
二氯甲烷及其它试剂均为分析纯。
1.2 菌株和培养基
实验室筛选保存的原油降解优良菌株W,经鉴定为芽孢杆菌。
Bushell-Hass基础培养基:KH2PO41.0 g,K2HPO41.0 g,NH4NO31.0 g,MgSO4·7H2O 0.2 g,FeCl30.05 g,CaCl2·H2O 0.02 g,蒸馏水1 L,pH值7.0,121 ℃蒸汽灭菌15 min。
1.3 植物根系及其分泌物的制备
植物种子经3% H2O2浸泡30 min后,用去离子水冲洗3次。将灭菌后的种子播撒于覆盖在烧杯口的纱布上,烧杯中盛满半强度Hoagland′s营养液,液面稍稍没过纱布。播种后烧杯放于人工气候箱中,培养条件:白天16 h,温度24 ℃,光照强度6000 lx,湿度80%;夜晚8 h,温度20 ℃,湿度80%。植物每隔1 d用无菌水补充液位,并每7 d补充1次半强度Hoagland′s营养液。植物培养28 d后,进行收获。剪去叶片,塑料袋包装密封,4 ℃保存。使用前将根剪成约1 cm长小段。根系分泌物溶液以0.2 μm微孔滤膜过滤除菌,4 ℃保存。
1.4 根系及其分泌物对微生物生长的影响
以保存备用的根系及其分泌物为基质,考察其对菌株W生长状况的影响,实验分2个处理:(a)菌株W+40 mL Bushell-Hass基础培养基+0.1 g碎根;(b)菌株W+35 mL Bushell-Hass基础培养基+5 mL根系分泌物。
将菌株W活化2 d,8000 r·min-1离心收集菌细胞,无菌水洗涤3次后重新悬浮于磷酸盐缓冲溶液中,制得培养液,测得OD600为0.8。按每瓶接种量1 mL接种培养液,30 ℃下150 r·min-1培养20 d。每12 h测定培养液的OD600,以ΔOD600(ΔOD600=OD600-0.8)表征总的微生物细胞生长量。
1.5 根系及其分泌物对原油降解和脱氢酶活性的影响
考察根系及其分泌物对原油降解的影响,实验分3个处理:(a)菌株W+40 mL Bushell-Hass基础培养基;(b)菌株W+40 mL Bushell-Hass基础培养基+0.1 g碎根;(c)菌株W+35 mL Bushell-Hass基础培养基+5 mL根系分泌物。
在4个三角瓶中加入0.02 g轻质原油,121 ℃蒸汽灭菌15 min,留一瓶作空白,其余冷却后分别加入根及其分泌物。按每瓶接种量1 mL接种培养液,30 ℃下150 r·min-1培养20 d。在第5 d、10 d、15 d、20 d按重量法测定残余油量,计算原油的降解率。
测定菌液脱氢酶活性(DHA),单位为μg TPF·mL-1·(6 h)-1。
2 结果与讨论
2.1 根系对微生物生长的影响(图1)
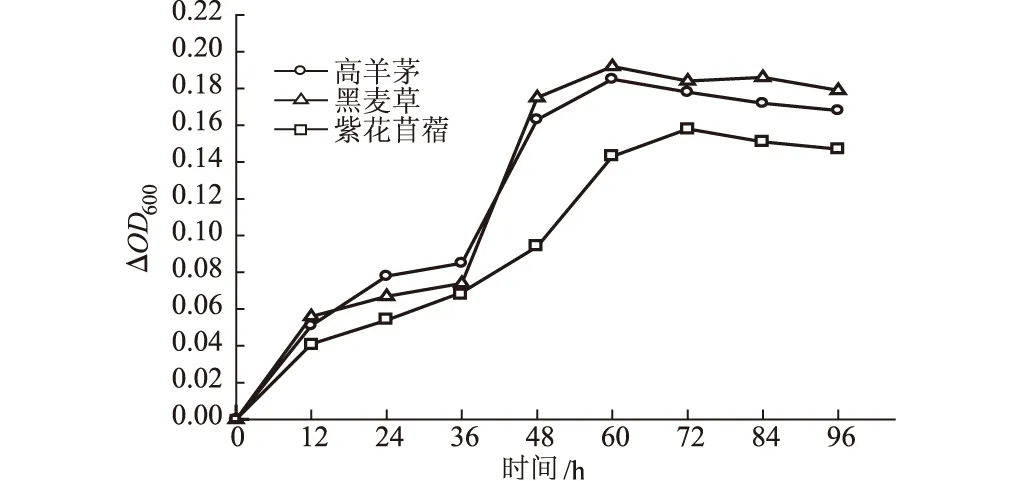
图1 加有3种植物根系的培养基ΔOD600随时间的变化
从图1可知,菌株W能够利用3种植物碎根中的营养物质为唯一碳源和能源,这验证了植物学领域的一个理论,即根际微生物可利用根系老化腐烂所释放出的营养物质而增殖,并强化根际污染物的降解。
在最初的12 h内,各处理的ΔOD600分别从0增加到0.051(高羊茅)、0.056(黑麦草)、0.041(紫花苜蓿)。高羊茅和黑麦草根系处理的ΔOD600在36~48 h增加最快,之后达到稳定期并有所下降。这是因为,根系的营养物质是逐步释放的,随着微生物的生长,根系在这一环境中开始腐解而逐步释放有机物,当腐解所能释放的有机物达到最大值时,微生物生长急剧加快;随着营养物质的消耗,有机物量减少,微生物生长又逐渐减缓。紫花苜蓿的ΔOD600突增期在48~60 h,比高羊茅和黑麦草的突增期推迟了12 h。这可能是因为,紫花苜蓿系豆科植物,与同属草本的高羊茅和黑麦草的根的理化性质有异。
高羊茅和黑麦草的根毛远比紫花苜蓿的发达,这可能导致前者的根系在培养条件下腐解快于后者的根系。在栽培的植物中,根毛最多可贡献高达77%的总根表面积[7]。根毛在植物生命进程中也扮演了重要的角色,如固定植株、吸收水分和营养、产生调节植物-微生物联系的物质、调控植物生长以及决定植物根际微生物群落结构[8~10]。活根毛和活性初生根及次生根代表性地释放大量根系分泌物。根据植物种类和经受环境条件的不同,活根毛系统在根体系结构(包括根毛数目和大小)方面差异很大。
需指出的是,由于不同种植物根系的有机物种类及含量不一致,因此不能因为某种根系处理下的微生物生长量比另一种根系处理下的更大,而认为某种根系比另一种根系对微生物的生长促进作用更显著。最终,各处理的ΔOD600最大值分别为0.185(高羊茅)、0.192(黑麦草)、0.158(紫花苜蓿)。
2.2 根系分泌物对微生物生长的影响(图2)

图2 加有3种植物根系分泌物的培养基ΔOD600随时间的变化
由图2可知,3种植物的根系分泌物也能支持微生物的生长,且各处理样的微生物生长量在24 h时均达到顶峰,随后下降。这主要是因为,根系分泌物中的有机物都是溶解态的,可以迅速被微生物利用,而不像根系中的有机物需要靠腐解来逐步释放。另外,可看到根系分泌物处理样的微生物生长量要小于根系处理样的微生物生长量,但不能由此判定根系对微生物生长的促进作用更大,因为所加入的根系及其分泌物所含营养物质的量不能确定一致。
2.3 根系对原油降解和脱氢酶活性的影响(图3)

图3 3种植物根系对原油累积降解率(a)和脱氢酶活性(b)的影响
由图3可知,3种植物根系对原油降解同样有促进作用。第5 d的原油降解率分别为22.5%(未添加)、29.8%(高羊茅)、34.5%(黑麦草)、27.4%(紫花苜蓿),与微生物生长情况相似。此时,各处理间的原油降解率具有显著差异(P<0.05)。5 d后,未添加与加有根系的处理样间的原油降解率差距有一定程度的减小,这是因为5 d时根系营养物基本耗尽,导致对微生物的刺激作用减弱。因添加的根系已死亡,不可能对微生物产生持续性刺激。20 d时,原油降解率分别为47.6%(未添加)、60.5%(高羊茅)、61.2%(黑麦草)、54.8%(紫花苜蓿)。
由图3还可知,根系可以提高脱氢酶的活性,这主要是有机营养物质的刺激作用所致。脱氢酶活性与原油降解基本呈正相关。
2.4 根系分泌物对原油降解和脱氢酶活性的影响(图4)
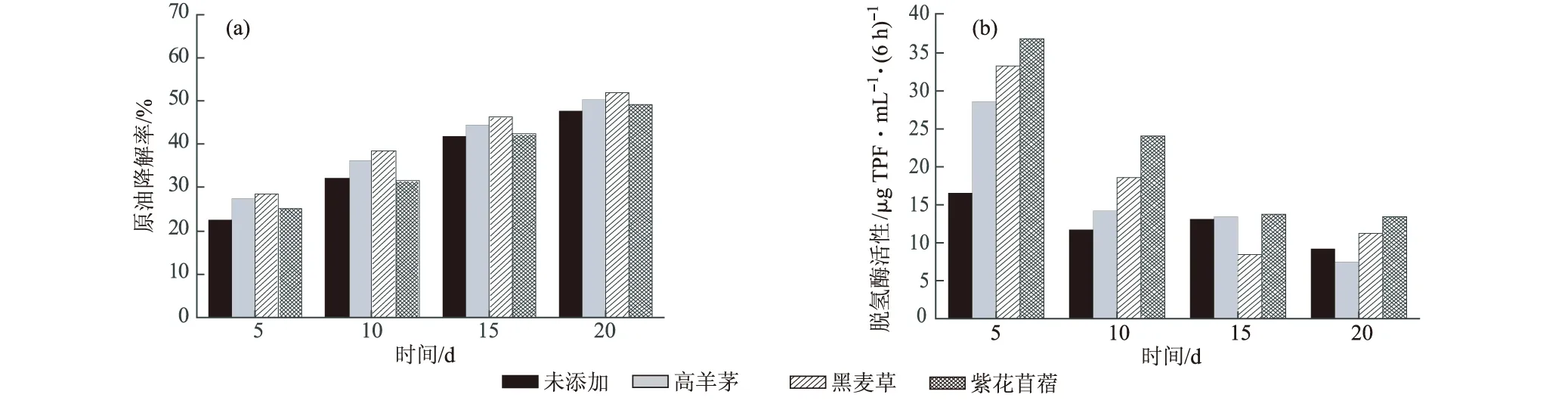
图4 3种植物根系分泌物对原油累积降解率(a)和脱氢酶活性(b)的影响
由图4可知,3种植物根系分泌物促进原油降解也是集中在前5 d,且促进效果不如根系,与微生物生长实验情况类似。第5 d的原油降解率分别为27.6%(高羊茅)、28.4%(黑麦草)、25.1%(紫花苜蓿)。高羊茅与黑麦草处理间差异不显著,但与紫花苜蓿处理间有显著差异(P<0.05)。20 d时,原油降解率分别为50.3%(高羊茅)、51.7%(黑麦草)、49.2%(紫花苜蓿),要显著低于加有相应根系处理的原油降解率。
由图4还可知,根系分泌物也能提高脱氢酶活性,但持续的时间不如根系,这主要是由于根系分泌物的营养在开始培养后很快就被微生物吸收消耗了。
3 结论
通过无土培养获得植物(黑麦草、高羊茅及紫花苜蓿)的根系及其分泌物,以摇瓶培养的方式考察了其对微生物生长及活性的影响。结果表明,黑麦草、高羊茅及紫花苜蓿的根系及其分泌物均能支持微生物的生长,并促进原油的降解。黑麦草与高羊茅处理间的差异不显著,但这两种草本植物与紫花苜蓿处理间有显著差异。根系对微生物生长和原油降解的刺激效应持续时间比根系分泌物的刺激效应持续时间要长。
参考文献:
[1] Bais H P, Vepachedu R, Gilroy S, et al. Allelopathy and exotic plant invasion:From molecules and genes to species interactions[J].Science,2003,301(5638):1377-1380.
[2] Hirsch A M,Bauer W D,Bird D M,et al.Molecular signals and receptors:Controlling rhizosphere interactions between plants and other organisms[J].Ecology,2003,84(4):858-868.
[3] Walker T S,Bais H P,Grotewold E,et al.Root exudation and rhizosphere biology[J].Plant Physiology,2003,132(1):44-51.
[4] Weir T L,Park S W,Vivanco J M.Biochemical and physiological mechanisms mediated by allelochemicals[J].Current Opinion in Plant Biology,2004,7(4):472-479.
[5] Rovira A D.Plant root exudates[J].The Botanical Review,1969,35(1):35-57.
[6] Bertin C,Yang X H,Weston L A.The role of root exudates and allelochemicals in the rhizosphere[J].Plant and Soil,2003,256(1):67-83.
[7] Parker J S,Cavell A C,Dolan L,et al.Genetic interactions during root hair morphogenesis inArabidopsis[J].The Plant Cell Online,2000,12(10):1961-1974.
[8] Fan T W M,Lane A N,Shenker M,et al.Comprehensive chemical profiling of gramineous plant root exudates using high-resolution NMR and MS[J].Phytochemistry,2001,57(2):209-221.
[9] Grierson C S,Parker J S,Kemp A C.Arabidopsisgenes with roles in root hair development[J].Journal of Plant Nutrition and Soil Science,2001,164(2):131-140.
[10] Michael G.The control of root hair formation:Suggested mechanisms[J].Journal of Plant Nutrition and Soil Science,2001,164(2):111-119.

