阿魏酸双苄酯的合成及生物活性研究
孟繁龙,李 硕,张庆一,张宇超,杨云彩,孙学军
(曲阜师范大学化学与化工学院 山东省生命有机分析重点实验室,山东 曲阜 273165)
阿魏酸,化学名为4-羟基-3-甲氧基苯丙烯酸,是植物界普遍存在的一种酚酸,也是当归、川芎、阿魏等中药的有效成分之一[1],作为国际公认的天然抗氧化剂和防癌物质引起世人关注[2]。研究发现,阿魏酸具有抗动脉粥样硬化、抗血小板凝集和血栓、清除亚硝酸盐和氧自由基、抗菌消炎、抗肿瘤、抗突变和增强免疫力等功能[3]。目前,一些国家已批准阿魏酸用于食品、化妆品及药品[4]。
阿魏酸分子中的烷烃较短且含有双键,亲水性较强,难以深入生物膜脂质双分子层中发挥其药理作用[5]。研究表明,阿魏酸衍生物比阿魏酸具有更强的药理活性和较低的毒性[6]。目前,已成功合成了阿魏酸酯类衍生物、阿魏酸酰胺类衍生物、阿魏酸醚类衍生物、阿魏酸酮类衍生物、芳环有取代基的阿魏酸衍生物[5],其中以阿魏酸钠盐、阿魏酸哌嗪、阿魏酸的高分子载体衍生物等为代表的部分化合物已经用于临床或具有临床应用的潜力[7]。然而,有关阿魏酸双苄酯的合成、抑菌活性及与DNA相互作用的研究报道仍不多见[8~15]。
作者在此以二甲基亚砜(DMSO)为溶剂,以阿魏酸与氯化苄在碱性条件下反应,成功合成了阿魏酸双苄酯,对其结构进行了表征,并研究了其生物活性。拟为进一步研究阿魏酸双苄酯及其水解产物的抑菌活性和抗癌作用提供参考。反应方程式为:
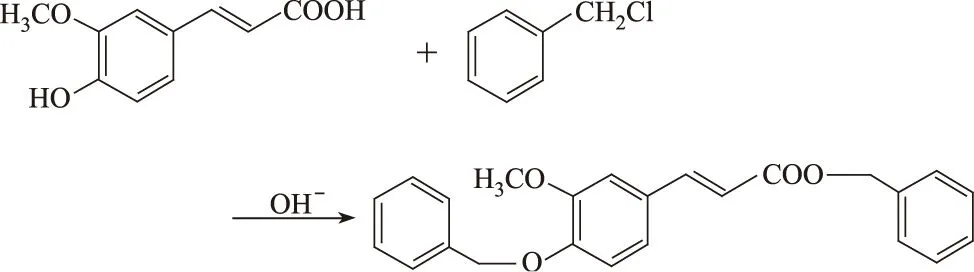
1 实验
1.1 试剂、材料与仪器
阿魏酸(纯度>98.5%),曲阜弘利化工有限公司;大肠杆菌,山东省卫生防疫站;小牛胸腺DNA(ct-DNA,A260/A280>1.8,未做提纯处理)、吖啶橙(Acridine orange,AO),Sigma公司;三羟甲基氨基甲烷(Tris,分析纯),上海展云化工有限公司;其它试剂均为分析纯;实验用水为二次蒸馏水。
牛肉浸膏液体培养基:取200 mL水、2 g蛋白胨、1 g牛肉浸膏、1 g氯化钠,加热煮沸,冷却至室温后,调pH值至7.2~7.4,121 ℃蒸汽灭菌30 min,冷却至室温后,置于冰箱中备用。
WRS-1A型数字熔点仪,上海精贤光电科技有限公司;655A型高效液相色谱仪、F-4600型荧光分光光度计,日本日立;CARY300型紫外可见分光光度计,美国瓦里安;NEXUS-470型傅立叶变换红外光谱仪,美国Nicolet;AVANCE 300型核磁共振仪,德国Bruker公司;7.0T型傅立叶变换离子回旋共振质谱仪,美国IonSpec;SMART APEX CCD型X-射线单晶衍射仪,美国Bruker AXS Inc;3114/3236 TAM Air型八通道微量热活性检测仪,瑞典Thermal Metric AB公司;乌贝路德粘度计,上海化学试剂公司。
1.2 阿魏酸双苄酯的合成
将0.01 mol阿魏酸、0.025 mol NaHCO3和15 mL DMSO加入到带有搅拌的三颈烧瓶中,加热溶解后滴入0.022 mol氯化苄和5 mL DMSO的混合溶液,控温110~120 ℃,控制pH=8~9,反应1.5 h,用TLC检测反应进程[展开剂为V(乙酸乙酯)∶V(石油醚)=1∶3的混合溶液]。反应完成后稍加冷却,倒入100 mL冰水中,即有白色固体析出。静置,抽滤,滤饼用25 mL无水乙醇重结晶,得到白色针状晶体,即阿魏酸双苄酯,产率为94.32%。
1.3 大肠杆菌抑菌活性实验
用微量量热法测定不同浓度的阿魏酸双苄酯溶液对大肠杆菌代谢作用的热功率-时间曲线。
(1)用N,N-二甲基甲酰胺(DMF)准确配制浓度为0.25 mg·mL-1的阿魏酸双苄酯溶液,置于冰箱中备用。
(2)在紫外灯下,用酒精灯灼烧过的取菌器转移大肠杆菌到牛肉浸膏液体培养基中,反复3次,在恒温下密封培养。
(3)将安瓶放在灭菌台上消毒15 min,然后装入培养基并接菌,移入一定量的阿魏酸双苄酯溶液,封口,放入基线稳定且温度恒定在37 ℃的微量热活性检测仪中,开始记录数据,当细菌代谢的热功率—时间曲线返回到基线时即可认为实验结束。
1.4 与DNA相互作用的研究
1.4.1 试剂的配制
ct-DNA:配成浓度为2.3×10-4mol·L-1的水溶液,其浓度据260 nm处的吸光度确定(按ε=6600 L·mol-1·cm-1),置于冰箱中备用。
吖啶橙:配成浓度为1×10-4mol·L-1的水溶液,置于冰箱中备用。
三羟甲基氨基甲烷:用其配制Tris-HCl(pH=7.4)缓冲溶液,内含0.1 mol·L-1NaCl。
阿魏酸双苄酯:用无水乙醇配成浓度(用[D]表示)为1×10-3mol·L-1的溶液,避光保存。
1.4.2 与DNA相互作用的紫外光谱测定
在1 cm比色皿中加入2 mL Tris-HCl缓冲溶液、0.2 mL阿魏酸双苄酯溶液,摇匀,用ct-DNA溶液进行滴定,扫描紫外吸收光谱,每次进样50 μL。
1.4.3 与DNA相互作用的荧光光谱测定
在1 cm比色皿中加入2 mL Tris-HCl缓冲溶液、0.1 mL吖啶橙溶液、0.3 mL ct-DNA溶液,摇匀,放置5 min,用阿魏酸双苄酯溶液滴定,扫描荧光光谱,每次进样20 μL。荧光条件为:激发和发射狭缝均为5 nm,λex=480 nm,电压700 V,扫描速率1200 nm·s-1。
1.4.4 粘度测定
固定ct-DNA浓度,改变阿魏酸双苄酯浓度,以Tris-HCl缓冲溶液配制溶液,在25 ℃恒温水浴槽中用乌氏粘度计测定其粘度。
2 结果与讨论
2.1 产品表征
产品为白色针状晶体,熔点为86~87 ℃,高效液相色谱仪测得纯度为98.5%。
紫外可见分光光度计测得最大吸收波长为204 nm、236 nm、325 nm。
IR(KBr),ν:3133 cm-1处为苯环C-H伸缩振动特征吸收峰,1510 cm-1处为苯环骨架伸缩振动特征吸收峰,1696 cm-1处为羰基伸缩振动特征吸收峰,1400 cm-1处为CH2中C-H变形振动特征吸收峰,1247 cm-1处为芳醚中C-O-C伸缩振动特征吸收峰,999 cm-1处为E型碳碳双键中C-H变形振动特征吸收峰。
1HNMR(CDCl3),δ,ppm:3.90(s,3H,CH3),5.18(s,2H,CH2),5.24(s,2H,CH2),6.35(m,1H,C=CH),6.86(m,1H,C=CH),7.01~7.68(m,13H,3C6H6)。
质谱仪测得其相对分子质量为374.4291 g·mol-1。
X-射线单晶衍射仪测得其分子结构见图1。

图1 阿魏酸双苄酯的分子结构
综合分析,确定合成产物为阿魏酸双苄酯。
2.2 对大肠杆菌的抑菌活性
根据大肠杆菌在一定浓度的阿魏酸双苄酯溶液中代谢作用的热功率-时间曲线数据,用Logistic方程处理细菌的指数生长期,计算出该浓度下的细菌生长速率常数μ[16]。大肠杆菌在不同浓度的阿魏酸双苄酯溶液中的生长速率常数见表1。

表1 大肠杆菌在不同浓度的阿魏酸双苄酯溶液中的生长速率常数
以生长速率常数μ对浓度c作图,所得μ-c曲线见图2。拟合线性回归方程为:μ=0.08793-0.00295c。
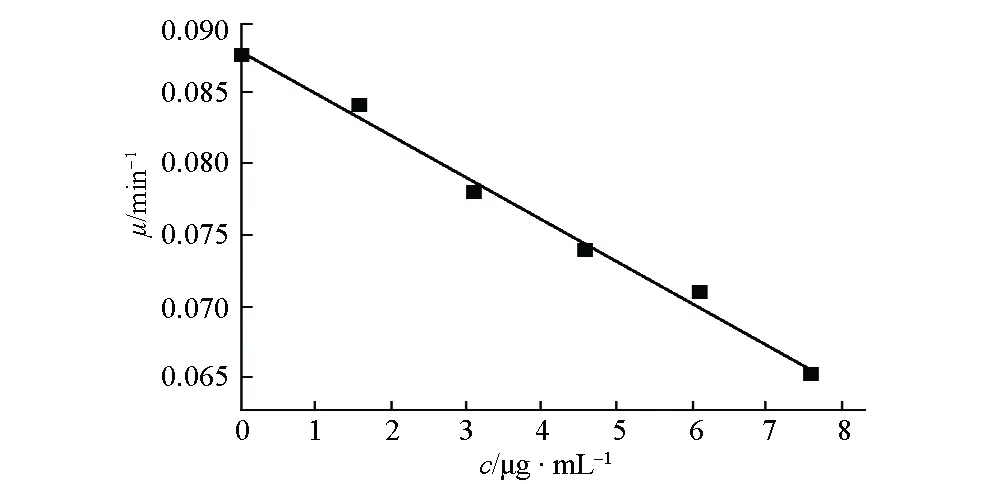
图2 阿魏酸双苄酯对大肠杆菌抑菌活性的μ-c曲线
μ=0 min-1时所对应的c值,即为阿魏酸双苄酯对大肠杆菌的最小抑菌浓度(MIC)。
测得37 ℃下阿魏酸双苄酯对大肠杆菌的最小抑菌浓度为29.81 μg·mL-1,说明阿魏酸双苄酯对大肠杆菌具有一定的抑制作用。
王利萍[11]研究表明,以阿魏酸乙酯为代表的阿魏酸链状酯对大肠杆菌没有抑菌活性;梁盛年等[12]、张春乐等[13]研究表明,只有肉桂酸和少数肉桂酸衍生物对大肠杆菌有抑制作用,例如:肉桂酸和对羟基肉桂酸对大肠杆菌有一定的抑菌活性,其MIC值分别为1 mg·mL-1和0.75 mg·mL-1。该值远大于阿魏酸双苄酯对大肠杆菌的最小抑菌浓度,说明后者对大肠杆菌有更好的抑制作用。这为进一步研究阿魏酸双苄酯及其水解产物的抑菌活性提供了参考。
2.3 与DNA的相互作用
2.3.1 紫外光谱分析
在pH=7.4的Tris-HCl缓冲溶液中,阿魏酸双苄酯与ct-DNA系列溶液的紫外吸收光谱见图3。
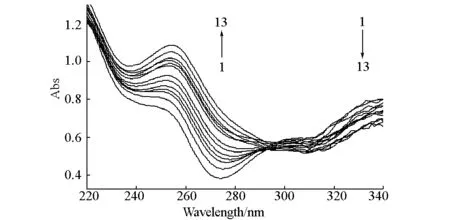
[D]=1×10-3 mol·L-1;[ct-DNA]=2.3×10-4 mol·L-1;ct-DNA用量(μL),1~13:0,50,100,150,200,250,300,350,400,450,500,550,600
由图3可以看出,ct-DNA使阿魏酸双苄酯原本在236 nm、325 nm两处的最大吸收波长发生了红移,对前者的吸收具有明显的增色效应,对后者的吸收具有一定的减色效应,并且在295 nm附近形成一个等色吸收点,这说明阿魏酸双苄酯与ct-DNA发生了相互作用。Long等认为,当小分子与DNA发生嵌插作用时,小分子的π轨道和DNA碱基π轨道相互耦合,最大吸收峰发生红移或蓝移,且存在减色或增色效应;当小分子与DNA发生静电作用时,峰位置不变,只有强度改变[15]。据此初步判断阿魏酸双苄酯是以经典插入方式与ct-DNA键合的。
2.3.2 荧光光谱分析
吖啶橙(AO) 可以插入到DNA双链的碱基对之间,因此AO-DNA复合物中AO的荧光强度比游离AO的荧光强度强得多。然而当其它也能与DNA发生插入作用的化合物存在时,会将AO从AO-DNA复合物中挤出,使得荧光强度降低发生荧光猝灭,因此AO可作为化合物与DNA作用模式的结构探针[17]。
固定AO、ct-DNA浓度,考察阿魏酸双苄酯浓度对AO-DNA体系荧光光谱的影响,结果如图4所示。

[ct-DNA]=2.3×10-4mol·L-1;[AO]=1×10-4mol·L-1;[D]=1×10-3mol·L-1;阿魏酸双苄酯用量(μL),1~11:0,20,40,60,80,100,120,140,160,180,200
由图4可以看出,AO-DNA荧光特征峰的强度随阿魏酸双苄酯用量(即浓度)的增加而下降,说明阿魏酸双苄酯对AO-DNA的荧光具有猝灭作用。这可能是阿魏酸双苄酯同AO竞争与DNA的结合位点,将AO从双螺旋中挤出,从而减弱了AO-DNA体系的荧光强度。
荧光猝灭作用因猝灭机制不同分为动态猝灭和静态猝灭。动态猝灭是猝灭剂和荧光物质的激发态分子之间的相互作用,其作用过程遵循Stern-Volmer方程[18]:
F0/F=1+Kqτ0[D]=1+KSV[D]
式中:F0和F为未加入和加入阿魏酸双苄酯时荧光物质的荧光强度;Kq为双分子猝灭过程的速率常数;τ0为没有阿魏酸双苄酯存在下荧光分子的平均寿命,约10-8s;KSV为Stern-Volmer猝灭常数。
以阿魏酸双苄酯最大发射波长525 nm处的荧光强度按Stern-Volmer方程作线性回归,得到阿魏酸双苄酯对ct-DNA的Stern-Volmer猝灭常数KSV为3.26×103L·mol-1,进一步求得其双分子猝灭过程的速率常数Kq为3.26×1011L·mol-1·s-1,远大于猝灭剂对生物大分子最大扩散控制的碰撞猝灭常数2.0×1010L·mol-1·s-1,由此确定阿魏酸双苄酯对ct-DNA的猝灭并非分子间动态碰撞所致,而是由于形成复合物所引起的静态猝灭。
静态猝灭可用Lineweaver-Burk双倒数方程进行描述[19],即:
式中:KD为阿魏酸双苄酯与ct-DNA的结合常数。


图5 阿魏酸双苄酯对AO-DNA体系作用的Lineweaver-Burk双倒数曲线
由图5中直线的斜率求得阿魏酸双苄酯与ct-DNA的结合常数KD=1.58×103L·mol-1。
2.3.3 粘度测定分析
在缺乏晶体数据的情况下,粘度测定被认为是确定键合模式最可靠的方法之一。配合物以部分插入的方式与DNA结合时,DNA溶液的粘度随配合物含量的增加而减小;以静电或沟面方式结合时,DNA溶液的粘度变化不大;而通过经典插入方式与DNA作用时,DNA溶液的粘度随配合物含量的增加而增大[20]。
25 ℃下,阿魏酸双苄酯用量对ct-DNA相对比粘度的影响见图6。

图6 阿魏酸双苄酯用量对ct-DNA相对比粘度的影响
由图6可以看出,随着ct-DNA中阿魏酸双苄酯浓度的增大,其相对比粘度逐渐增大,由此可进一步判断阿魏酸双苄酯与DNA的作用方式为经典插入方式。
项朋志等[14]用电化学方法研究发现,阿魏酸与DNA的相互作用以嵌插作用为主,结合常数为1.01×104L·mol-1。于婷婷等[15]用紫外光谱法研究发现,阿魏酸乙酯与DNA结合生成了一种非电活性的超分子化合物,结合常数为6.0×106L·mol-1。而本研究发现阿魏酸双苄酯与ct-DNA的作用方式为经典插入方式,结合常数为1.58×103L·mol-1。由此表明,阿魏酸及其不同衍生物与DNA的作用方式和结合强度差别较大。
3 结论
以DMSO为溶剂,以阿魏酸与氯化苄在碱性条件下反应合成了阿魏酸双苄酯,产率为94.32%,纯度为98.5%。通过紫外光谱、红外光谱、核磁共振氢谱、质谱及X-单晶衍射对产物结构进行了表征。用微量量热法测得阿魏酸双苄酯对大肠杆菌的MIC值为29.81 μg·mL-1,说明阿魏酸双苄酯对大肠杆菌具有一定的抑制作用。通过紫外光谱、荧光光谱和粘度测定证实阿魏酸双苄酯与ct-DNA之间存在相互作用,其作用方式为经典插入方式,对ct-DNA的猝灭是由于形成复合物所引起的静态猝灭,与ct-DNA的结合常数为1.58×103L·mol-1。为进一步研究阿魏酸双苄酯及其水解产物的抑菌活性和抗癌作用提供了具有参考价值的信息。
参考文献:
[1] 方文贤.医用中药药理学[M].北京:人民卫生出版社,1998.
[2] Willis W M,Lencki R W,Marangoni A G.Lipid modification strategies in the production of nutritionally functional fats and oils[J].Critical Reviews in Food Science and Nutrition,1998,38(8):639-674.
[3] 欧仕益,包慧燕,蓝志东.阿魏酸及其衍生物的药理作用研究进展[J].中药材,2001,24(3):220-221.
[4] 张娟.阿魏酸单甘油酯的合成及功能性研究[D].无锡:江南大学,2007.
[5] 张岳玲,韦长梅,王锦堂.阿魏酸的合成及其分子改造研究进展[J].淮阴师范学院学报(自然科学版),2003,2(1):50-53.
[6] 马逢时,李家明.阿魏酸及其衍生物的合成及药效研究进展[J].亚太传统医药,2008,4(5):55-56.
[7] 王汝涛.阿魏酸乙酯的合成及其药理活性研究[D].重庆:第四军医大学,2002.
[8] Saibal Kumar Das,Anantha Reddya K,Mukkanti K.Total synthesis of phenylpropanoid glycosides,grayanoside A and syringalide B,through a common intermediate[J].Carbohydrate Research,2007,324(15):2309-2315.
[9] Andrés Leschot,Tapia Ricardo A,Eyzaguirre Jaime.Efficient synthesis of 4-methylumbelliferyl dihydroferulate[J].Synthetic Communications,2002,32(20):3219-3223.
[10] Anuradha V,Srinivas Pullela V,Rao R Ranga,et al.Isolation and synthesis of analgesic and anti-inflammatory compounds fromOchnasquarrosaL.[J].Bioorganic & Medicinal Chemistry,2006,14(20):6820-6826.
[11] 王利萍.酚酸酯类化合物的合成及抑菌活性研究[D].西安:西北大学,2009.
[12] 梁盛年,段志芳,付莉,等.几种肉桂酸衍生物与肉桂酸的抑菌作用比较研究[J].食品科技,2005,(9):71-73.
[13] 张春乐,宋康康,陈祥仁,等.肉桂酸及其衍生物的抑菌活性研究[J].厦门大学学报(自然科学版),2006,45(Z1):16-18.
[14] 项朋志,刘丽梅,郭英,等.阿魏酸与DNA相互作用的光谱电化学研究[J].化学与生物工程,2010,27(9):53-56.
[15] 于婷婷,何平,梁艳,等.阿魏酸乙酯与DNA相互作用的电化学及紫外光谱研究[J].化学传感器,2009,29(1):49-55.
[16] 王建涛,孔哲,闫咏梅,等.微量量热法研究异喹啉类生物碱的抑菌活性[J].化学世界,2008,48(8):460-463.
[17] 古琴,任祥祥,乐学义,等.TATP-铜(Ⅱ)-L-丝氨酸(L-精氨酸)配合物与DNA的相互作用[J].物理化学学报,2008,24(6):1068-1072.
[18] 童裳伦,张晓翔.氧氟沙星和左氧氟沙星与DNA的相互作用研究[J].光谱学与光谱分析,2010,30(2):481-485.
[19] 卢奎,成红丽,马丽,等.L-半胱氨酸二肽与DNA的相互作用研究[J].光谱学与光谱分析,2010,30(1):146-149.
[20] 任祥祥,卢艳梅,乐学义.诺氟沙星-铜(Ⅱ)-TBZ/HPB配合物的合成、抗菌活性及与DNA作用[J].化学通报,2010,(6):551-555.

