微波掺氮改性纳米二氧化钛的研究
邓仕英,
(1.长江大学工程技术学院化学工程系,湖北 荆州 434020;2.武汉工程大学材料科学与工程学院,湖北 武汉 430073 )
二氧化钛(TiO2)由于性质稳定、无毒、价格低廉、光催化活性高,已被制成纳米粉体、薄膜及涂层等各种材料,在除臭、空气与水的净化等环保方面有着广泛的应用[1~11]。但TiO2作为宽禁带半导体化合物,需要在紫外光的激发下才能显示催化活性,然而太阳光中紫外光能量仅占4%,因此,如何改性TiO2使其在可见光甚至是室内光源的激发下产生活性一直是研究热点。早期研究基本集中在过渡金属[2,3]的掺杂上,虽然能够实现TiO2光催化剂的吸收光谱向可见光扩展,却会导致热学上的不稳定,并引入了新的载流子复合中心,降低了TiO2的光催化效率。最近研究表明,掺杂非金属如N[4~10]、C[11]、S[12]、F[13]等原子可以使TiO2光催化剂的光吸收限红移,并提高其在可见光照射下的光催化活性。Asahi等[4]采用N2(30%)/Ar混合气体处理锐钛矿型纳米TiO2薄膜、采用NH3(67%)/Ar混合气体处理锐钛矿型纳米TiO2粉,分别制备了氮杂氧化钛(TiO2-xNx)纳米薄膜和纳米微粉。这种纳米材料在可见光(波长<500 nm)照射下可以使乙醛等分解为二氧化碳和水,但该方法反应温度高、反应速度慢、耗时长、效率低。Liu等[14]采用等离子体法制备了纳米氮杂氧化钛粉体,明显提高了紫外光催化能力,但需要在真空条件下进行,对设备的要求比较高。
微波加热与常规的加热模式相比,具有缩短反应时间及选择性反应的优势。作者在此以高氮含量的水合肼作为掺杂氮源,利用微波加热法制备掺氮纳米TiO2催化材料,并考察了其光催化性能。
1 实验
1.1 试剂
钛酸四丁酯(TNB),化学纯,天津福晨化学试剂厂;无水乙醇(分析纯)、水合肼(化学纯),上海振兴化工厂;硝酸,分析纯,武汉亚泰化工试剂厂;二苯氨基脲(DCPI),分析纯,上海三爱思试剂公司;氨水,分析纯,武汉联碱厂;碳粉,工业品;去离子水,自制。
1.2 纳米TiO2粉体的制备
取一定量TNB的乙醇溶液,搅拌下缓慢滴加到70 ℃的氨水溶液中,滴加完毕后继续搅拌2 h,抽滤,洗涤,再将其转入一定量的HNO3溶液中,调节pH值为2~3,恒温回流2 h,得到乳白色胶体;继而用氨水破胶,搅拌1 h,抽滤,洗涤,将沉淀物转入烧杯中并加入适量去离子水,用超声波分散,转入真空烘箱中80 ℃烘12 h得TiO2粉体,将其放入马弗炉中分别在不同温度下退火2 h。
1.3 微波掺氮改性
按nC∶nTiO2∶n水合肼=3∶6∶70的配比将水合肼、碳粉、TiO2粉体放入微波辐照装置中,在500 W下处理20 min。
1.4 光催化实验
1.5 分析测试
用JEM-100CXⅡ型透射电镜观察TiO2粒子形貌;用D/MAX-Ⅲ型X-射线衍射仪测定TiO2粉体的物相组成并得出TiO2粒子的统计粒径;用KRATOS XSAM-800型X-光电子能谱仪(以沾污碳C 1s=284.8 eV为能量参考)表征TiO2表面的掺氮效果;将微波改性前后的TiO2粉体配成100 mg·L-1的溶液,用岛津Mini-1240型紫外可见分光光度计测定其紫外可见吸收光谱;用722型分光光度仪测量光催化溶液的吸光度。
2 结果与讨论
2.1 微波改性条件对改性TiO2光催化性能的影响
本研究利用微波碳热还原技术对TiO2粉体进行掺氮改性,有两方面考虑:一方面,由于微波加热均匀迅速,缩短了升温周期,可使反应体系在瞬间达到反应临界温度;另一方面,微波的非热效应能降低反应体系所需的温度,缩短反应周期。因此,以高氮含量的水合肼作为掺杂氮源,在微波辐照下完成氮掺杂改性。
2.1.1 不同改性体系的影响
以不同改性体系与TiO2粉体按一定比例混合组成不同改性体系,荧光高压汞灯照射8 min,微波改性后粉体的吸光度曲线见图1。
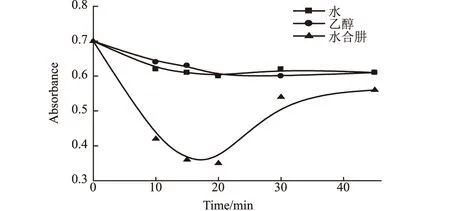
图1 不同改性体系对改性TiO2光催化性能的影响
由图1可知,采用水和乙醇对TiO2粉体改性其光催化性能基本保持不变,而采用水合肼对TiO2进行改性所得粉体的光催化活性很好。这说明水合肼的加入使氮以某种形式掺入了TiO2,提高了TiO2的光催化活性。因此,选择水合肼作为掺杂氮源进行TiO2的微波改性。
2.1.2 碳粉与TiO2摩尔比的影响(图2)
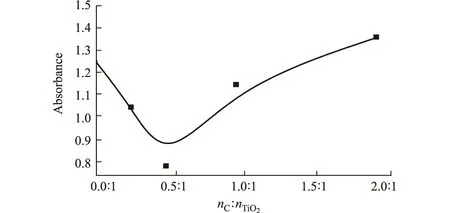
图2 碳粉与TiO2摩尔比对改性TiO2光催化性能的影响
由图2可知,随着碳粉与TiO2摩尔比的增大,改性TiO2的光催化性能有所提高;当碳粉与TiO2的摩尔比为0.5∶1时,改性TiO2的光催化性能最佳;继续增加碳粉的用量,其光催化性能反而下降,甚至低于未改性的TiO2。这可能是因为:在微波改性过程中,碳粉的加入在吸收微波提供反应能量的同时,也起到了碳热还原剂的作用,少量碳粉的加入使水合肼离解产生的游离氮取代TiO2中的氧原子生成氮杂氧化钛,提高了TiO2的光催化活性;随着碳粉用量的增加,氮取代氧的几率大大增加,而只有氮与氧按一定化学剂量比存在时才能提高其光催化性能,因此,碳粉用量过大反而使得改性TiO2的光催化效率下降。因此,选择适宜的碳粉与TiO2摩尔比为0.5∶1。
2.1.3 水合肼与TiO2摩尔比的影响(图3)
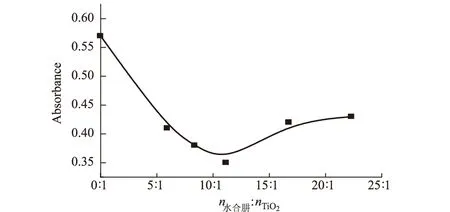
图3 水合肼与TiO2摩尔比对改性TiO2光催化性能的影响
由图3可知,随着水合肼与TiO2摩尔比的增大,改性TiO2的光催化性能有所提高;当水合肼与TiO2的摩尔比为11∶1时,改性TiO2的光催化性能最佳;继续增加水合肼的用量,改性TiO2的光催化性能有所降低,但仍明显优于未改性的TiO2。这可能是因为:当水合肼用量不足时,掺杂氮源不足,未被掺杂改性的TiO2大量存在,因此其光催化性能提高不明显;当水合肼用量过大时,大量氮在TiO2表面掺杂富集,也会导致改性效果不佳。因此,选择适宜的水合肼与TiO2摩尔比为11∶1。
2.1.4 微波辐照功率的影响(图4)
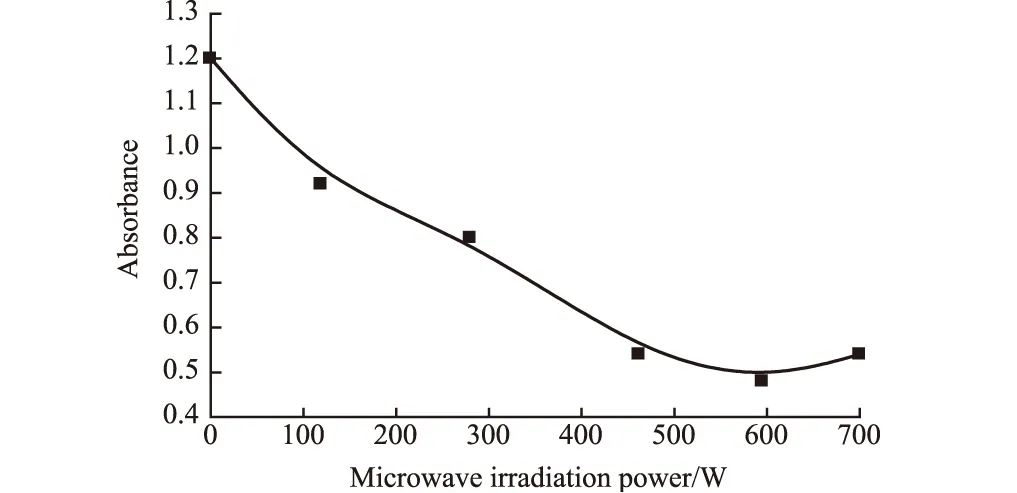
图4 微波辐照功率对改性TiO2光催化性能的影响
由图4可知,随着微波辐照功率的增大,改性TiO2的光催化性能有所提高;当微波辐照功率为450~600 W时,改性TiO2的光催化性能最佳。这是因为:微波作为掺杂反应的能量源,其功率的增大使反应活性及反应速度大大提高,氮掺杂几率也大大提高。综合考虑微波反应的安全性及能耗,选择适宜的微波辐照功率为500 W。
2.1.5 微波辐照时间的影响(图5)
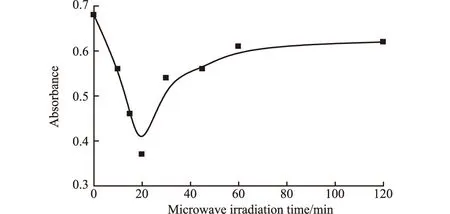
图5 微波辐照时间对改性TiO2光催化性能的影响
由图5可知,随着微波辐照时间的延长,改性TiO2的光催化性能迅速提高;当微波辐照时间为20 min时,改性TiO2的光催化性能最佳;继续延长微波辐照时间,改性TiO2的光催化性能有所下降,处理60 min之后其光催化性能基本保持不变,较改性前略优。这主要是因为:由于TiO2表面直接暴露在水合肼中,当微波辐照时间较短时,掺杂氮的含量很低,且刚好满足电子的跃迁,从而提高了样品表面空穴(或电子)的量,使改性TiO2的光催化性能明显提高;但是随着微波辐照时间的延长,参与反应的水合肼的量迅速增加,使得氧空位增多,造成电子和空穴的复合几率增大,反而使光催化活性降低。因此,选择适宜的微波辐照时间为20 min。
2.1.6 不同光照光源对微波改性前后TiO2粉体光催化性能的影响(图6)
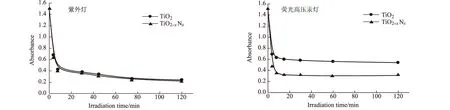
图6 不同光照光源对改性前后TiO2光催化性能的影响
2.2 XPS能谱分析(图7)
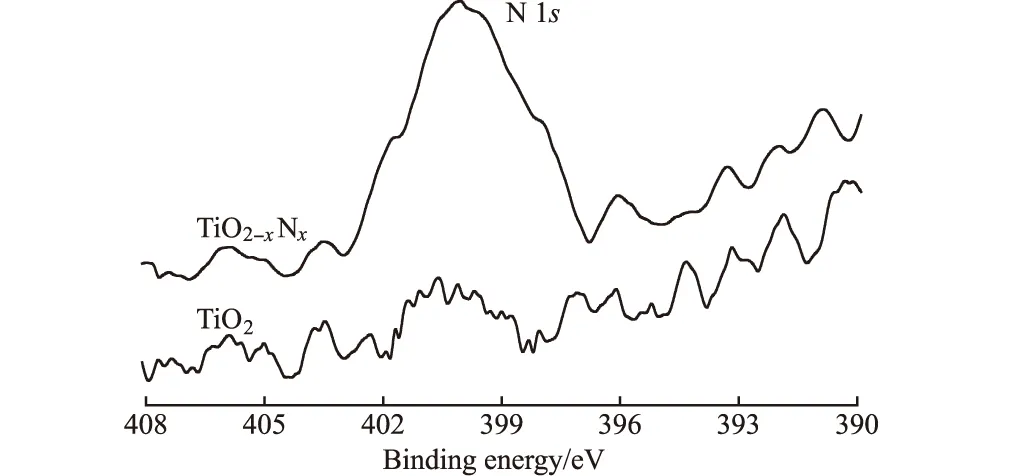
图7 改性前后TiO2的N 1s峰的XPS图谱
由图7可知,改性TiO2在结合能为399.6 eV的地方出现了N 1s峰,证明了其表面氮元素的存在,表明TiO2经微波改性处理后,氮原子已部分取代其中的氧原子,但取代的量很微弱。因此,长时间高温反应所得TiO2的光催化活性可以通过微波辐照改性获得。
2.3 紫外可见吸收光谱分析(图8)
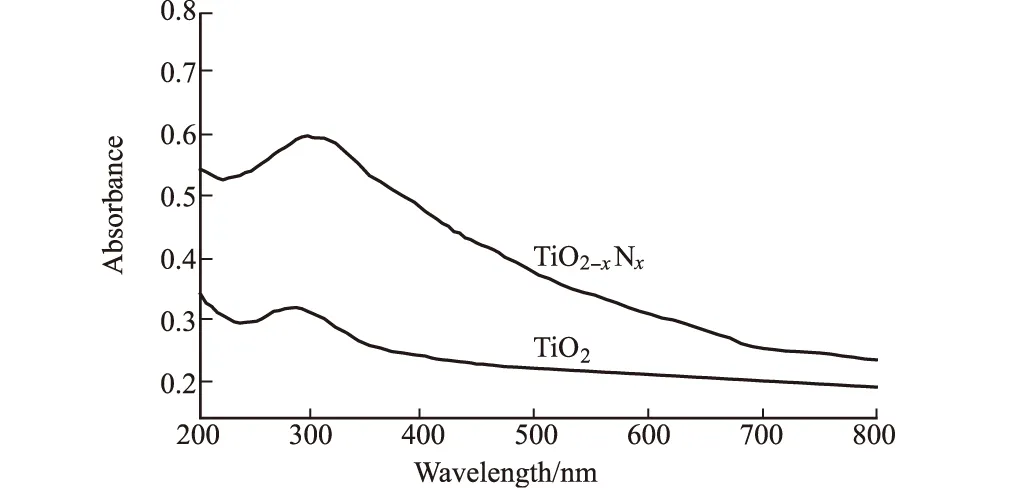
图8 改性前后TiO2的紫外可见吸收光谱
由图8可知,经微波掺氮改性的TiO2在紫外和可见光区域都有明显的吸收,且远远高于未改性的TiO2。这可能是因为:微波掺杂使氮原子的2p轨道与TiO2中氧原子的2p轨道杂化,与纯TiO23.16 eV的带隙相比,掺氮TiO2的带隙降低了0.01~0.05 eV,利于近紫外可见光的激发;掺杂氮的存在使氧与钛的结合程度降低,氧更容易脱离钛形成氧空位,其数目与TiO2可见光活性成正比。
2.4 XRD分析(图9)
由图9中微波辐照改性前后TiO2粉体的X-射线衍射图谱特征峰的位置与相对强弱可知,微波辐照并未改变TiO2粉体原有锐钛矿晶型,是在锐钛矿型高光催化活性的基础上进一步提高光催化性能。
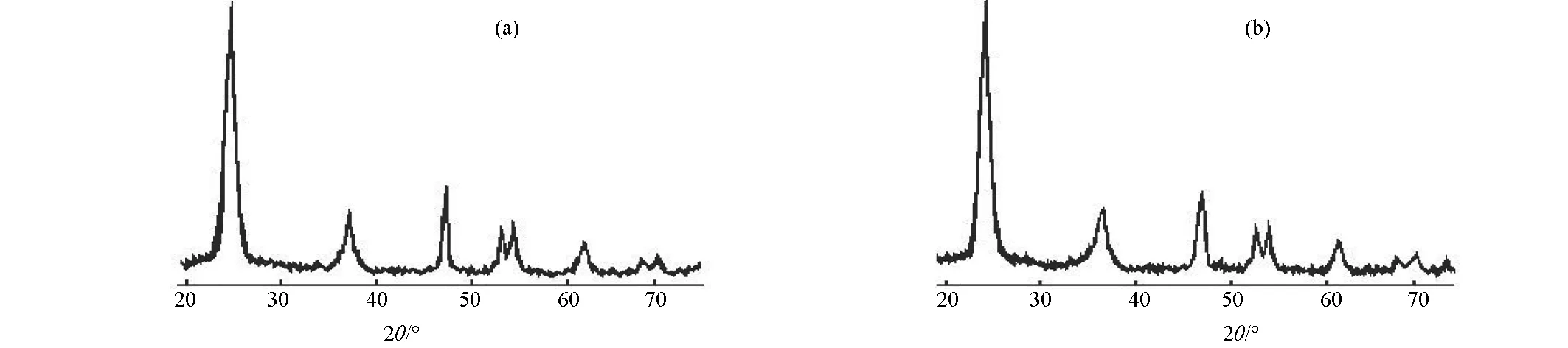
图9 TiO2经微波辐照前(a)、后(b)的X-射线衍射图谱
2.5 TEM分析(图10)

图10 TiO2经微波辐照前(a)、后(b)的TEM照片
由图10可知,TiO2粉体颗粒粒径比较均匀,约为7~10 nm,分布窄;微波辐照前后形貌没有明显变化,表明微波辐照对TiO2粒径没有影响,从而保证了经微波辐照后,TiO2仍保持较高的光催化活性。
3 结论
以水合肼为掺杂氮源,采用微波辐照对锐钛矿型纳米TiO2进行改性,考察了掺氮纳米TiO2的光催化性能,并用XPS、UV-Vis、XRD、TEM等方法对其进行了表征。结果表明,在nC∶nTiO2∶n水合肼=0.5∶1∶11、微波辐照功率为500 W、微波辐照时间为20 min的条件下所得粉体的光催化性能最佳,在可见光下具有较高的反应活性,表明微波掺氮改性纳米TiO2大幅提高了其光催化性能;微波辐照后,氮原子取代了TiO2粉体表面少量氧原子,TiO2的粒径和晶型均保持不变,但吸收边明显向可见光方向偏移。
参考文献:
[1] Fujishima A,Honda K.Electrochemical photolysis of water at a semiconductor electrode[J].Nature,1972,238(5358):37-38.
[2] Fuerte A,Hernández-Alonso M D,Maira A J,et al.Visible light-activated nanosized doped-TiO2photocatalysts[J].Chem Commun,2001,(24):2718-2719.
[3] Subramanian V,Wolf E,Kamat P V.Semiconductor-metal composite nanostrutures.To what extent metal nanoparticles (Au,Pt,Ir) improve the photocatalytic activity of TiO2films[J].Phys Chem,2001,105(46):11439-11446.
[4] Asahi R,Morikawa T,Ohwaki T,et al.Visible-light photocatalysis in nitrogen-doped titanium oxides[J].Science,2001,293(13):269-271.
[5] Sakthivel S,Kisch H.Photocatalytic and photoelectron chemical properties of nitrogen-doped titanium dioxide[J].Chem Phys Chem,2003,4(5):487-490.
[6] Irie H,Watanabe Y.Nitrogen-concentration dependence on photocatalytic activity of TiO2-xNxpowders[J].Phys Chem,2003,107(23):5483-5486.
[7] Burda C.Enhanced nitrogen doping in TiO2nanoparticles[J].Nano Lett,2003,3(8):1049-1051.
[8] Yin S,Zhang Q.Preparation of visible-light active titania photocatalyst by mechanochemical method[J].Chem Lett,2003,2(4):358-359.
[9] Lindgren T,Mwabora J M,Avendao E.Photoelectrochemical and optical properties of nitrogen doped titanium dioxide prepared by reactive D C magnetron Sputtering[J].Phys Chem B,2003,107(24):5709-5716.
[10] 陈杰瑢.低温等离子体化学及其应用[M].北京:科技出版社,2001.
[11] Khan S U M,Al-Shahry M,Ingler W B.Effcient photochemical water splitting by a chemically modifiedn-TiO2[J].Science,2002,297(5590):2243-2245.
[12] Ohno T,Mitsui T,Matsumura M.Visible light-induced degradation of methylene blue on S-doped TiO2[J].Chem Lett,2003,32(4):364-365.
[13] Yu J C,Yu J G,Ho W K,et al.Effects of F doping on the photocatalytic activity and microstructures of nancorystalline TiO2powders[J].Chem Mater,2002,14(9):3808-3816.
[14] Liu Changsheng,Ma Zhibing.Study on modification of nano-sized anatase titanium dioxide by nitrogen-plasma[J].Plasma Science & Technology,2006,8(2):1-5.

