响应面法优化Aspergillus oryzae Cs007产酯水解酶发酵条件
刘虹才,鄢洪德,徐 玮,汪 钊
(浙江工业大学生物与环境工程学院,浙江 杭州 310014)
酯水解酶(Ester hydrolase),是一类极其重要的生物催化剂,可水解酯类物质产生相应的酸和醇,在日用化学品、食品、医药、制革、纺织等行业应用极其广泛[1];也可以在有机相中催化可逆的合成反应,如酯化、转酯化、酯交换等,其催化作用具有化学选择性、区域选择性和立体选择性[2,3]。
米曲霉(Aspergillusoryzae)是丝状真菌中普遍存在的种属,具有表达多种酶蛋白的能力,如蛋白酶、淀粉酶、酯酶、纤维素酶等,且不产生黄曲霉素等毒性物质,是公认为对人体安全的菌株,广泛应用于食品、饲料、酿酒等发酵工业。米曲霉还具有分泌蛋白质及产胞外酶的能力,其发酵性能优良,因此又成为具有商业潜力的基因工程表达系统[4,5]。实验室筛选到一株产酯水解酶的米曲霉菌株WZ007,是既产胞内酶又产胞外酶的典型菌株,其所产的酶在酯化拆分生物素中间体内酯和硫辛酸时表现出良好的光学选择性[6,7],但酶活力较低,所需反应时间长,不利于工业化应用。为了提高其产酶活力,采用γ-射线对米曲霉WZ007进行诱变,获得一株诱变效果较好的突变株米曲霉Cs007。
响应面法(RSM)是一类简易、迅速、可靠的统计学优化方法,在微生物培养基组成和培养条件的优化工作中发挥着极其重要的作用[8]。比起传统的优化方法如逐因子实验和部分因子实验,响应面法能快速有效地分析各因素的主效应及交互效应,在一定水平范围内求得最佳值。
作者在此利用响应面法结合单因子实验来优化米曲霉Cs007的发酵产酶条件,以进一步提高其产酶活力,为其应用创造条件。
1 实验
1.1 菌种、试剂和培养基
AspergillusoryzaeCs007为实验室保藏菌种,经500Gy137Csγ-射线辐照(剂量为1.3 μSv·h-1)诱变筛选获得。其原始菌种为AspergillusoryzaeWZ007,由实验室筛选得到,保藏于中国典型培养物保藏中心(CCTCC No.M206105)。
对硝基苯酚乙酸酯(pNPA),Alfa公司;橄榄油、蛋白胨、酵母膏、蔗糖、阿拉伯胶等生化试剂为进口或国产分析纯。
斜面培养基(质量浓度,%):马铃薯 20,蔗糖 2,琼脂 2,pH值自然。
发酵培养基(质量浓度,%):蛋白胨 1,KH2PO40.15,MgSO40.05,NaCl 0.05,橄榄油1(体积分数),pH值自然。
1.2 方法
1.2.1 培养方法
将米曲霉Cs007在斜面培养基上于30 ℃培养4 d。用无菌水将斜面上的孢子洗下,制成1×106个·mL-1的孢子悬浮液。按10%(体积分数)接种量接至50 mL/250 mL 三角瓶液体发酵培养基中,30 ℃、200 r·min-1下培养48 h。将培养液于4 ℃、12 000 r·min-1离心15 min,取上清液测定发酵液酶活力。
1.2.2 酶活测定方法
酯水解酶活力的测定以pNPA为底物,参照Gao等[9]的测定方法并进行改进。将0.1 mL 30 mmol·L-1pNPA的乙腈溶液和2.8 mL 0.05 mol·L-1磷酸缓冲溶液(pH值 7.5)混合后,于40 ℃恒温水浴保温5 min;加入适量酶液,反应5 min后立即加入1 mL无水乙醇终止反应,在405 nm下测定吸光度。以灭活的酶液作对照。
酶活力单位定义:每分钟催化产生1 μmol对硝基苯酚所需的酶量定义为1个酶活力单位(U)。
1.2.3 实验设计
首先通过单因子实验确定米曲霉Cs007产酶发酵培养基的主要组分;再采用SAS 9.0软件进行Plackett-Burman设计筛选影响米曲霉Cs007产酶发酵的显著因素,然后根据实验拟合的一次多项式确定最速上升方向,通过最陡爬坡实验和Box-Behnken中心组合实验进行进一步优化,实验结果用二次多项式回归拟合,用微分计算预测最佳点,并对拟合方程作显著性检验及方差分析,采用响应面法分析确定显著因素的最优水平;最后通过单因子实验确定最佳摇床转速和培养时间。
2 结果与讨论
2.1 单因子实验筛选最佳碳源、最佳氮源及最佳表面活性剂
2.1.1 碳源对米曲霉Cs007产酯水解酶的影响
分别以1%的葡萄糖、蔗糖、麦芽糖、可溶性淀粉、甘油、三油酸甘油酯、橄榄油、大豆油、玉米油作为培养基的碳源,考察不同碳源对米曲霉Cs007发酵产酶的影响,结果见图1。

图1 不同碳源对产酶的影响
由图1可看出,培养基中碳源的种类对产酯水解酶的影响很大,以碳水化合物作碳源时,胞外酶活力很低,其中以可溶性淀粉作碳源的酯水解酶活力最低,仅0.04 U·mL-1,由此可见,米曲霉Cs007对碳水化合物的利用能力很弱,可能碳水化合物对该酯水解酶的产生有一定的抑制作用;而以甘油或油脂作碳源时,产酶效果明显,这与Hoshino等[10]所报道的其它米曲霉菌种利用碳源情况相似,其中橄榄油作碳源的酯水解酶活力最高,达2.8 U·mL-1,因此,选择橄榄油为发酵产酶的最佳碳源。
2.1.2 氮源对米曲霉Cs007产酯水解酶的影响
以1%的橄榄油为培养基的碳源,分别添加1%(质量浓度,下同)的酵母膏、蛋白胨、牛肉膏、豆饼粉、玉米粉、硫酸铵、氯化铵为氮源,考察不同氮源对米曲霉Cs007发酵产酶的影响,结果见图2。

图2 不同氮源对产酶的影响
由图2可看出,米曲霉Cs007对氮源的利用有极大的选择性,无机氮源不利于菌体生长,几乎不产酶;有机氮源有利于菌体生长,其中以蛋白胨为氮源时,产酶效果最明显,这与王小花等[11]的研究结果相似。因此,选择蛋白胨为发酵产酶的最佳氮源。
2.1.3 表面活性剂对米曲霉Cs007产酯水解酶的影响
表面活性剂能提高橄榄油在水中的可溶性,对产酶有着重要的影响。在培养基中分别添加浓度为0.2%(质量浓度,下同)的吐温-20、吐温-80、Triton X-100、阿拉伯胶和聚乙烯醇,考察不同表面活性剂对米曲霉Cs007发酵产酶的影响(以不加表面活性剂的培养基作为对照),结果见图3。

图3 不同表面活性剂对产酶的影响
由图3可看出,Triton X-100和阿拉伯胶可明显促进产酶,其中阿拉伯胶的效果更好。因此,选择阿拉伯胶为产酶培养基的表面活性剂。
2.2 Plackett-Burman实验设计及结果分析
根据单因子的优化结果,通过SAS 9.0软件进行Plackett-Burman设计(n=12):实验设计橄榄油(X1)、蛋白胨(X2)、MgSO4(X3)、KH2PO4(X4)、起始pH值(X5)、阿拉伯胶(X6)、温度(X7)等7个因素,另设一个虚拟项(X8),每个因素各取高(+1)、低(-1)两个水平,响应值Y为发酵所产酯水解酶酶活。实验设计和结果见表1,各因素水平及效应评价见表2。
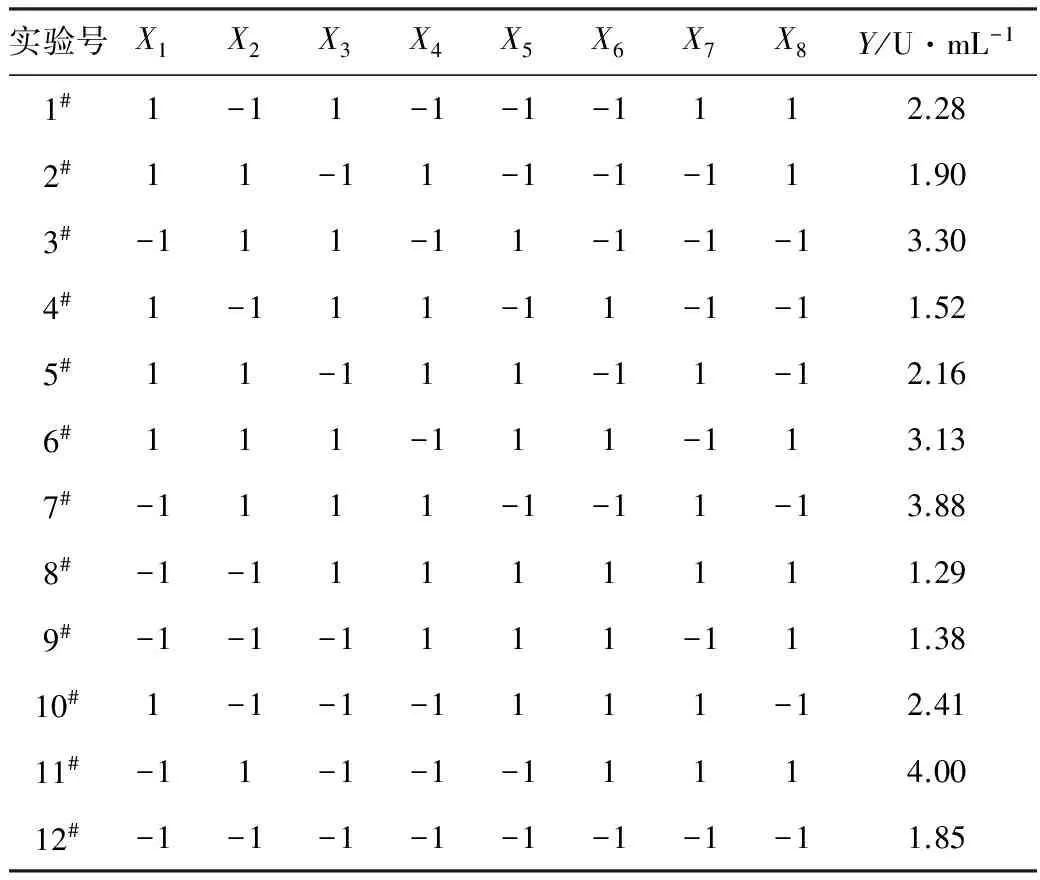
表1 Plackett-Burman实验设计及结果

表2 Plackett-Burman设计的各因素水平及效应评价(α=0.05,置信度95%)
由表2可知,在7个影响产酶因素中,对产酶的影响显著且置信度在95%以上的因素为:蛋白胨>KH2PO4>阿拉伯胶>温度>橄榄油。选择蛋白胨、KH2PO4和阿拉伯胶这3个因素作为进一步研究对象。其中蛋白胨和阿拉伯胶对产酶呈现正效应,KH2PO4则呈现较大的负效应,要提高产酶能力,应适当提高蛋白胨、阿拉伯胶的浓度,降低KH2PO4的浓度。其它因素根据其效应的正负,分别固定在较好水平上,即橄榄油和MgSO4的浓度分别为1%、0.05%(质量浓度,下同),起始pH值为5,培养温度为30 ℃。
2.3 最陡爬坡实验确定主要因素的水平中心点
根据Plackett-Burman实验结果,对蛋白胨、KH2PO4和阿拉伯胶3个因素进行最陡爬坡实验。根据各自效应的大小,设定蛋白胨(X2)、KH2PO4(X4)和阿拉伯胶(X6)增长的方向和步长依次为+0.1、-0.01、+0.05,最陡爬坡实验设计及结果见表3。

表3 最陡爬坡实验设计及其结果
由表3可知,最大产酶区在4#实验附近,故以4#实验的条件为水平中心点,进行响应面实验设计。
2.4 响应面法优化显著因子水平
2.4.1 Box-Behnken实验设计及结果
采用Box-Behnken中心组合设计,以酯水解酶酶活为响应值设计了3因素3水平共15个实验点的响应面实验,其中设3个零点,零点实验进行3次,以估计误差。Box-Behnken实验的因素和水平见表4,结果见表5。

表4 Box-Behnken实验因素与水平
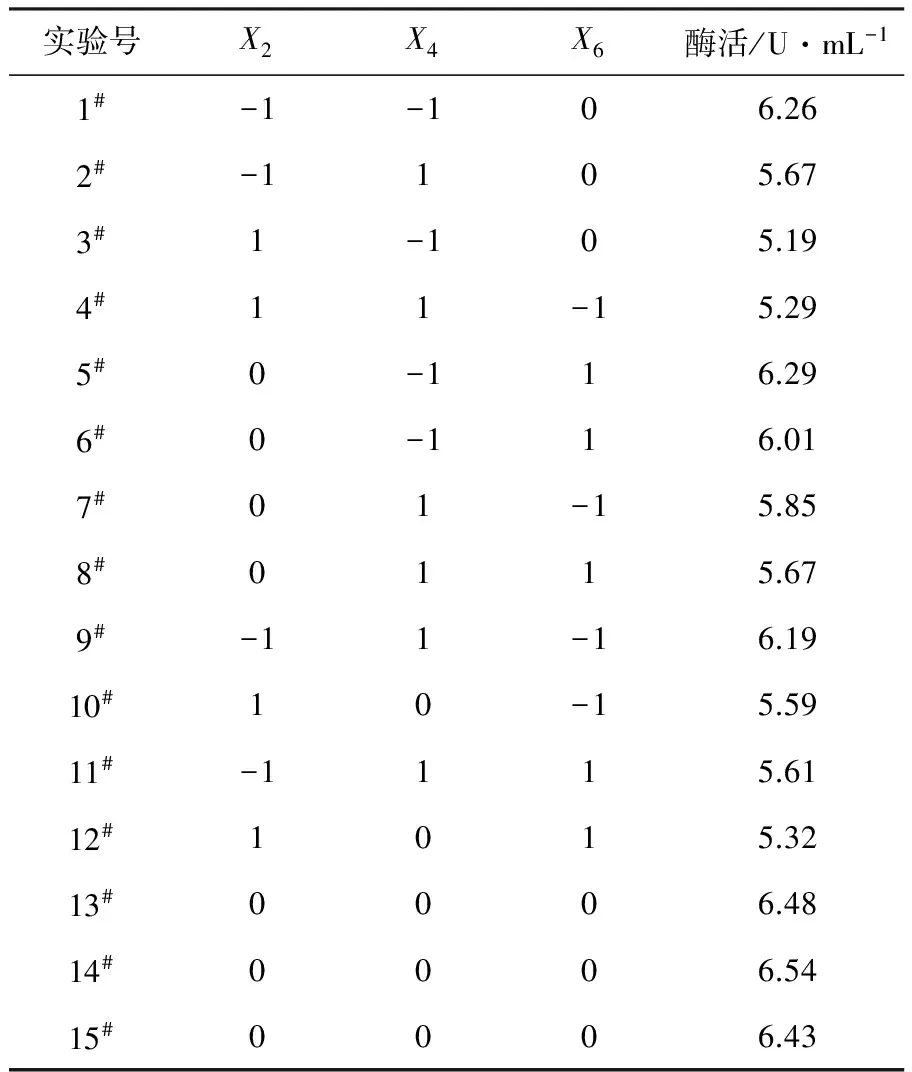
表5 Box-Behnken响应面实验设计及结果
2.4.2 二次回归拟合及方差分析
根据表5的实验结果,用SAS 9.0进行二次回归拟合,得到酯水解酶酶活(Y,U·mL-1)与影响产酶的显著因素(自变量,X)的函数关系式为:
Y=6.483333-0.2925X2-0.15875X4-0.16375X6

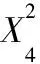
对回归分析的结果进行方差分析,见表6。

表6 方差分析
由表6可知,该方程的各因子与响应值之间的关系显著,回归方程的一次项、平方项都高度显著,交互项不显著。在α=0.05水平上,该模型失拟项不显著,回归高度显著。由置信度分析可得该模型决定系数R2为97.43%,表明97.43%的酶活变化可由该模型分析,回归拟合度较好。该方程为米曲霉Cs007发酵产酯水解酶提供了一个合适的模型,因此可用该模型分析和预测米曲霉Cs007发酵产酶情况。
2.4.3 响应因子水平的优化
根据表5的实验结果作三维响应面图,见图4。

图4 酶活与蛋白胨、KH2PO4和阿拉伯胶的响应面图
由图4可知,回归模型存在最大值,该值稳定点在(-0.33825,-0.37806,-0.43989),对应的X2、X4、X6实际取值为1.76、0.11、0.37,Y的最大预测值为6.59,即当蛋白胨、KH2PO4和阿拉伯胶质量浓度分别为1.76%、0.11%、0.37%时,该模型预测的最高酶活为6.59 U·mL-1。实际发酵酶活为6.49 U·mL-1,进一步说明该模型能够较好地预测实际发酵情况。
2.5 摇床转速和培养时间对产酶的影响
在上述优化的培养条件下(即橄榄油 1%,蛋白胨 1.76%,KH2PO40.11%,MgSO40.05%,NaCl 0.05%,阿拉伯胶 0.37%,起始pH值 5,培养温度30 ℃),进一步考察摇床转速和培养时间对产酶的影响。
2.5.1 摇床转速对产酶的影响
摇床转速主要影响发酵液的溶氧浓度,米曲霉Cs007是好氧性菌种,在生长和产酶过程中要消耗大量的氧,所以发酵过程中应不断振荡来增加发酵液的溶氧浓度。培养时间为48 h,考察摇床转速对产酶的影响,结果见表7。

表7 摇床转速对产酶的影响
由表7可知,米曲霉Cs007的发酵过程需氧程度较高,低转速条件下,不能满足细胞产酶的需求;当摇床转速提高到200 r·min-1时,产酶量最高,达到6.49 U·mL-1;再提高转速,产酶量基本不变。因此,选择200 r·min-1为最佳的摇床转速。
2.5.2 培养时间对产酶的影响
摇床转速为200 r·min-1,考察培养时间对产酶的影响,结果见图5。

图5 培养时间对产酶的影响
由图5可看出,米曲霉Cs007培养24 h后酶活快速上升,48 h时酶活达到最高6.49 U·mL-1,60 h后酶活开始下降。因此,选择48 h为最佳的培养时间。
3 结论
利用响应面方法结合单因子实验确定米曲霉Cs007菌株最优培养条件为:橄榄油 1%(体积分数),蛋白胨 1.76%(质量浓度),KH2PO40.11%(质量浓度),MgSO40.05%(质量浓度),NaCl 0.05%(质量浓度),阿拉伯胶 0.37%(质量浓度),起始pH值 5,培养温度30 ℃,摇床转速200 r·min-1,培养时间48 h。优化条件下所产酯水解酶酶活达6.49 U·mL-1,比初始酶活2.8 U·mL-1提高了1.32倍。
参考文献:
[1] Bornscheuer U T. Microbial carboxyl esterases:Classification,pr-operties and application in biocatalysis[J].FEMS Microbiol Reviews,2002,26(1):73-81.
[2] Saxena R K,Davidson W S,Sheoran A,et al.Purification and ch-aracterization of an alkaline thermostable lipase fromAspergilluscarneus[J].Process Biochemistry,2003,39(2):239-247.
[3] Jaeger K E,Eggert T.Lipases for biotechnology[J].Current Opinion in Biotechnology,2002,13(4):390-397.
[4] Christensen T,Woeldike H,Boel E,et al.High level expression of recombinant genes inAspergillusoryzae[J].Nat Biotechnol,1988,6(12):1419-1422.
[5] Uchima C A,Tokuda G,Watanabe H,et al.Heterologous expression and characterization of a glucose-stimulatedβ-glucosidase from the termiteNeotermeskoshunensisinAspergillusoryzae[J].Appl Microbiol Biotechnol,2011,89(6):1761-1771.
[6] Yan H D,Wang Z,Chen L J.Kinetic resolution ofα-lipoic acid via enzymatic differentiation of a remote stereocenter[J].J Ind Microbiol Biot,2009,36(5):643-648.
[7] Zheng J Y,Wang Z,Zhu Q,et al.Resolution of biotin intermediate lactone by enzyme-catalyzed stereoselective lactonization in organic solvent[J].J Mol Catal B-Enzym,2009,56(1):20-23.
[8] Kalil S J,Maugeri F,Rodrigues M I.Response surface analysis and simulation as a tool for bioprocess design and optimization[J].Process Biochem,2000,35(6):539-550.
[9] Gao L,Xu J H,Li X J,et al.Optimization ofSerratiamarcescenslipase production for enantioselective hydrolysis of 3-phenylglycidic acid ester[J].J Ind Microbiol Biotechnol,2004,31:525-530.
[10] Hoshino T,Ogura T,Okano K,et al.Lipase ofAspergillusoryzaeⅢ.Inductive conditions of lipase byAspergillusoryzaeand its localization in a cell [J].Bulletin of the Japanese Society of Scientific Fisheries,1991,57(3):511-515.
[11] 王小花,洪枫,朱利民,等.米曲霉产胞外脂肪酶培养条件的优化[J].食品与发酵工业,2005,31(4):25-27.

