一种新的纸基微流开关及其活跃方法*
查 燕,尉一卿,韩庆江,章安良
(宁波大学信息学院电路与系统研究所,浙江宁波315211)
微流控器件因具有操作简单、试剂消耗量少、可极大减少操作中引入的人为误差等诸多优点,已成为生化分析领域的研究热点[1-3],在DNA测序、单细胞分析、单分子分析、蛋白质结晶、食品安全和疾病诊断等领域中得到越来越广泛的应用[4-7]。尤其是纸基微流器件的出现,进一步降低了微流控器件的成本,它不仅制作工艺十分简单,而且无需专用的制作设备[8-9]。一经出现,它即成为微流控学的前沿研究热点,为市场潜力十分巨大的POCT[10]更广泛应用,克服了成本障碍。然而,纸基微流器件的一个特点是微流器件的功能在器件制作完成后也就确定,无法由用户根据现场需要进行自行编程,以确定其功能;用户也无法根据分析要求自行选择微流体流经的微通道。可编程微流器件的出现可克服上述缺点,可进一步发挥微流器件优点。要实现微流器件的可编程性,微流开关是关键。哈佛大学的George M.Whitesides及其合作者[11]提出了3维可编程纸基微流开关。它通过纸和胶带数层叠层,用户只要按压纸基微通道上的纸基按钮,即可实现纸基微通道的开关功能。但纸基微流开关的纸基和胶带层数较多,开关动作通过用户的手动实现,不易实现自动化。Xu等[12]报道了将纸基片疏水化后,采用等离子体处理实现亲水纸基微通道,并将亲水微通道截成两微通道,通过设计特殊形状纸基开关,实现纸基微流通道内微流体控制。另外,已报道通过阀机理实现传统的硅基、玻璃和塑料等材料构成的微流器件的微流输运[13-14],实现微流开关功能,但由于纸基微流器件微流体的输运是依靠纸基中的毛细管力作用来实现微流输运,因此,微阀机理无法应用于纸基微流器件上。
本文在前期工作[15]基础上提出了一种新的纸基微流开关,它由声表面波(SAW)控制其开关功能。只要编程实现加到叉指换能器上电信号,即可实现其开关功能,便于微流自动分析。
1 实验部分
1.1 声表面波作用微流原理及压电器件设计
在压电基片的叉指换能器上加合适频率的电信号时,叉指换能器激发声表面波,并沿压电基片表面传播。在所加的信号频率为叉指换能器的声同步频率时,叉指换能器激发的声表面波强度决定于加到其上的电信号功率和叉指换能器的指对数。对于一制作好的叉指换能器,它激发的声表面波强度随所加的信号功率增加而增加。
当在压电基片的声路径上有微流体,且基片表面传播的声表面波遇到该微流体时,声表面波按瑞利角θR向微流体辐射能量[16],

式(1)中VW是声波在液体中传播速度,VR为声波在压电基片表面传播速度。
在SAW向微流体辐射能量的同时,声表面波对微流体产生单位体积力[17]:
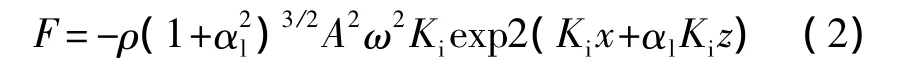
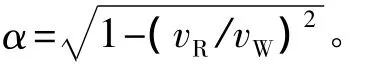
声表面波作用于微流体的原理如图1所示。
为激发两相向声表面波,在(XY)/128°LiNbO3基片上采用微电子工艺制作一对叉指换能器和一对反射栅。每一个叉指换能器叉指周期为144 μm,铝指条厚度为500 nm,叉指换能器的孔径为4.32 mm,叉指换能器的指对数均为35。压电基片的声路径表面涂覆Teflon AF 1600(Dupont,USA)。

图1 声能量按θR·角向微流体辐射能量
当压电基片上微流体同时受两相向声表面波作用时,该微流体由于受相向作用力而发生形变,使得基片上微流体变窄、变高,其形变程度与所加的电信号功率有关。
1.2 纸基微流开关制作
纸基微流开关制作工艺如图2所示。

图2 纸基微流开关制作工艺
图2中,先采用模塑法制作PDMS微架(图2(a)),将成形的纸通道穿过PDMS微架中设计的通孔(图2(b)),采用 PDMS楔子固定纸通道(图2(c)),并将纸一端折叠(图2(d)),贴放于光刻有叉指换能器和反射栅的压电基片上(图2(e)),待连接的两纸基微通道通过PDMS垫块置放于纸开关上方(图2(f))。
1.3 声表面波控制微流开关原理及实验装置
在正常情况下,纸基微流开关处于断开状态,当需要两通道连接时,将放大了的RF信号加到叉指换能器上,激发两相向声表面波,使得压电基片上微流体发生形变,并为纸基开关所吸收,进而增大折叠纸通道的折叠角,从而连接待连通的两纸基微通道,实现开关‘on’功能。声表面波激活开关的实验装置如图3所示。
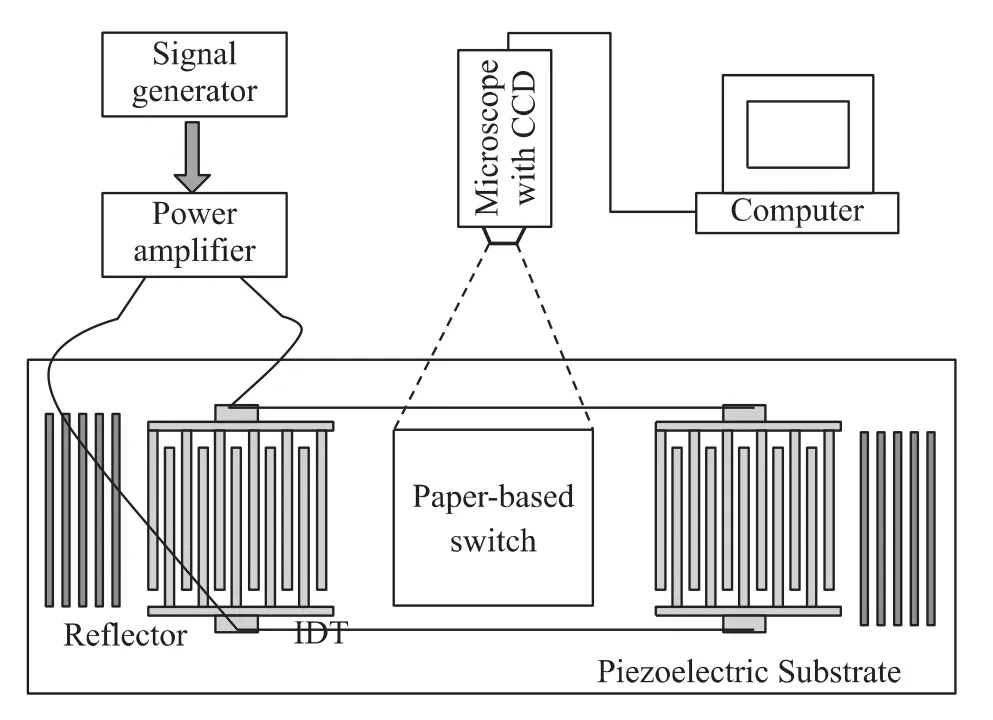
图3 纸基微流开关实验装置
图3中,射频(RF)信号发生器(SP1461,EPRE,China)用来提供实验所需要的27.5 MHz正弦波信号,它与叉指换能器的声同步频率相同,激发声表面波。功率放大器用于放大信号发生器输出的电信号,它的工作频率范围是2 MHz~30 MHz,增益为48 dB,最大不饱和输出功率为30 W。高灵敏度电荷耦合器(CCD)(DCE-2,Novel,China)用来监测微流体运动状况及纸基微流器件颜色变化,并储存于计算机中。实验中,采用 MDVNT软件(Novel,China)进行图像处理和控制。加到叉指换能器上的功率采用功率计(YM2462,Yamei,China)来测量。
2 结果与讨论
2.1 纸基微通道的扩展
折叠纸通道在没有外界作用力时,它将有恢复原来状态的趋势而一定程度扩展。图4(a)是折叠后的纸通道在不受外界作用下,恢复两天后状况。从微架开始的三折纸通道长度分别3.90 mm,4.10 mm和4.05 mm,纸通道宽度为2.53 mm,一折纸通道的折叠角为128.4°。由图4(a)可知,折叠纸通道发生了一定程度的恢复,但其折叠角均小于90°。若将微流体进样到折叠纸通道,则折叠纸通道的折叠角将进一步增加,该纸通道长度也随之增加。图4(b)~4(e)为5 μL红色染料溶液微流体通过纸通道,折叠角发生变化的视频截图。图4(f)为5 μL红色染料溶液微流体还尚未到达第二折叠处,而前一折叠角增加较大后,导致该折叠角部分减少。图4(g)~4(h)为5 μL红色染料溶液微流体开始到达第二折叠处,该处折叠角增大情况。图4(i)为经过85.7 s后,折叠纸通道折叠处两折叠角大小。

图4 微流输运导致折叠角增加
由图4可知,经过21.8 s后,折叠纸通道的两折叠角都增加到125°以上。再经过1 min以后,折叠角仅增加不到10°。
为了进一步检验折叠纸通道恢复程度,对一折、不同宽度纸通道在有和无5 μL红色染料溶液微流体通过纸通道时,其折叠角变化如图5所示。
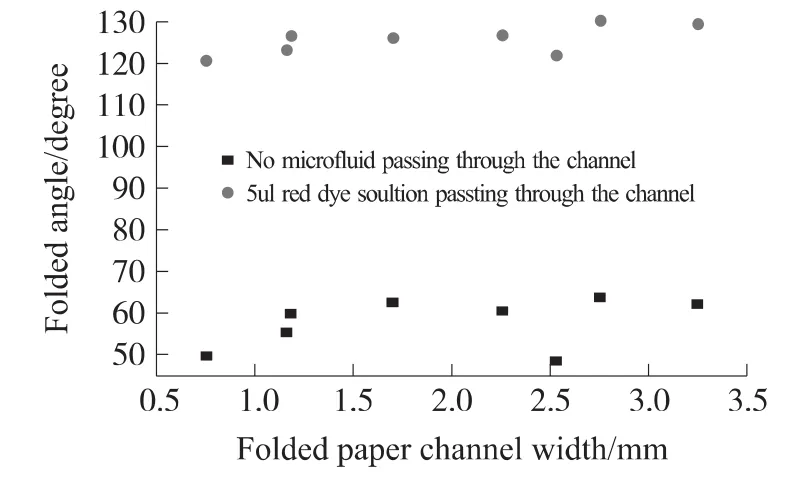
图5 有、无微流输运时纸通道折叠角变化
由图5可知,在没有微流体通过纸通道时,折叠纸通道经过两天后,其折叠角均远小于90°。而5 μL红色染料溶液微流体经过纸通道输运后,折叠角增大到120°以上,极大增加了纸通道长度。
对不同宽度,相同折叠通道长度进行15次实验,折叠纸通道经2 d恢复后没有微流体通过时,折叠角均在48°~64°之间;经过5 μL红色染料溶液微流体后,折叠纸通道变化后的折叠角增加到120.7°~138.0°之间,满足纸基开关对纸通道折叠角的要求。
折叠纸通道垂直高度H=H1+H2可由下式计算得到:

式(3)中各量的含义如图6直观示出。

图6 计算纸折叠通道长度示意图
图6中,由于纸通道底端固定于PDMS微架中,且纸通道在该折叠处的折叠角已经较大,为计算简便,可认为α值近似不变,则当微流体通过纸通道后,根据式(3)可计算折叠纸通道长度变化量。对于图4 所示纸通道,α 为38.4°,L2为 4.1 mm,L3为3.9 mm,θ1和 θ2分别从47.5°,48.4°增加到 141.1°和134.9°,则长度变化量为2.8 mm。
根据实验,微流体流过折叠纸通道后,最低折叠角均超过120°,同时,微流体首先使得折叠角θ1达到至少120°,为此,假设 θ1取最低条件 120°,则要使折叠纸通道接触到其上方2 mm处待连接的纸微通道,θ2只需 112.2°,其值小于 120°。因此,折叠纸通道能可靠保证开关功能的实现。
2.2 两相向声表面波作用下微流体高度变化
两相向声表面波作用于微流体使得微流体发生形变,即,声表面波作用使得压电基片上微流体的高度发生了变化。为研究微流体高度变化与RF电信号功率关系,在压电基片上2 mm高度处放置滤纸片,在滤纸片下方的压电基片上采用微量进样器进样微流体,为便于观察,采用红色染料溶液微流体为实验对象,进行声表面波作用下不同体积微流体到达2 mm高度所需电信号功率做了实验。图7是4 μL红色染料溶液在声表面波作用下发生形变,从而增加该微流体高度,并到达滤纸片的视频截图。

图7 4μL红色染料溶液微流体输运到纸基片视频截图
图7中,图7(a)为4 μL红色染料溶液采用微量进样器进样到压电基片上,图7(b)为纸基片放置于2 mm高度的PDMS垫块上,图7(c)为RF信号功率较小时,微流体高度不足以接触到其上的纸基片,图7(d)为当RF信号功率增加到2.3 W时,红色染料溶液微流体发生较大形变,微流体高度刚能接触到纸基片,图7(e)和图7(f)为红色染料溶液微流体在纸基片上进一步扩展输运。
改变进样到压电基片上红色染料溶液微流体的体积,进行相同实验。结果可得到:当进样的微流体体积分别为5 μL和6 μL时,两相向声表面波作用下,实现其高度增加到2 mm所需RF信号功率分别为1.6 W和0.6 W。而当红色染料溶液体积为3 μL时,增加RF电信号功率到3.1 W也不能实现微流体到达纸基片,为避免压电基片因所加功率过大而破裂,故实验中不进一步增加RF信号功率。
由此可见,两相向声表面波作用,可增加压电基片上微流体高度,且不同体积微流体达到同一高度所需RF信号功率随微流体体积增大而减少。
2.3 声表面波激活纸基微流开关
声表面波作用可改变压电基片上微流体高度,因此,可采用声表面波控制纸基微流开关。图8是声表面波控制纸基微流开关的视频截图。为便于观察,也采用红色染料溶液微流体作为实验对象,进行纸基微流开关的控制实验。

图8 声表面波活跃纸基微流开关
图8中,图8(a)为两待连通的纸基微通道;图8(b)为采用微量进样器将15 μL红色染料溶液微流体进样到一纸基微通道后,该微流体在该微通道内输运;图8(c)为该微流体已经输运到达该纸基微通道端口处;图8(d)为在叉指换能器对上加1.2 W电信号后,压电基片上水微流体在声表面波作用下在纸基开关输运并使其扩展;图8(e)为纸基开关进一步扩展;图8(f)为纸开关一端与微通道接触;图8(g)为纸开关连接两微通道;图8(h)~8(i)为微流体经过纸开关输运到另一微通道,实现声表面波控制微流体在不同微通道内输运。
由图8可知,在压电基片的叉指换能器上不加RF电信号时,纸基开关保持‘off’状态,而当叉指换能器上加足够强度的电信号后,压电基片上微流体因形变而输运到纸基开关,使得纸基开关连通两微通道,实现开关的‘on’功能。因此,只要控制加到叉指换能器上电信号,即可控制开关功能。
此外,为避免压电基片上微流体(液滴)对待连接通道带来外来物质的干扰,可采用待输运微流体替代压电基片上的液滴。
3 结论
提出了一种新的、声表面波活跃的纸基微流开关,采用红色染料溶液微流体和27.5 MHz电信号实验验证了纸基微流开关的开关功能。本文工作可得如下结论:(1)微流体通过折叠微通道可使折叠纸通道的折叠角增加,增加纸通道长度;(2)两相向声表面波可使得其声路径上微流体发生形变,而使其高度发生变化,且达到同一高度,所需RF信号功率随微流体体积增加而减少;(3)声表面波可活跃纸开关实现两个不相连接的两纸基微通道微流体的输运。本文工作对可编程纸基微流器件研究具有参考价值。
[1] Jang E J,Koh W G,Multiplexed Enzyme-Based Bioassay within Microfluidic Devices Using Shape-Coded Hydrogel Microparticles[J].Sensors and Actuators B:Chemical,2010,143(2):681-688.
[2] 陈亚东,李榕生,干宁,等.基于纳米金组合电极的HIV p24微流控安培免疫传感芯片研究[J].传感技术学报,2009,22(2):165-170.
[3] Mu Q H,Li Y G,Zhang Q H,et al.TiO2Nanofibers Fixed in a Microfluidic Device for Rapid Determination of Chemical Oxygen Demand via Photoelectrocatalysis[J].Sensors and Actuators B:Chemical,2011,155(2):804-809.
[4] Dae N K,Lee Y,Koh W G.Fabrication of Microfluidic Devices Incorporating Bead-Based Reaction and Microarray-Based Detection System for Enzymatic Assay[J].Sensors and Actuators,B,Chem,2009,137(1):305-312.
[5] Bienvenue J M,Lindsay A L,Jerome P F,et al.An Integrated Microfluidic Device for DNA Purification and PCR Amplification of STR Fragments[J].Forensic Science International:Genetics,2010,4(3):178-186.
[6] Mu C J,Zhang F L,Zhang Z Y,et al.Highly Efficient Dual-Channel Cytometric-Detection of Micron-Sized Particles in Microfluidic Device[J].Sensors and Actuators B:Chemical,2011,151(2):402-409.
[7] Zhang H,Xu T,Li C W,et al.A Microfluidic Device with Microbead Array for Sensitive Virus Detection and Genotyping Using Quantum Dots as Fluorescence Labels[J].Biosensors and Bioelectronics,2010,25(11):2402-2407.
[8] Robert P.Bioactive Paper Provides a Low-Cost Platform for Diagnostics[J].Trends in Analytical Chemistry,2009,28(8):925-942.
[9] Lee W G,Kim Y G,Chung B G,et al.Micro-and Nano-Patterns Created via Electrohydrodynamic Instabilities[J].Advanced Drug Delivery Reviews,2010,62(4):449-457.
[10] Pamela A W.The Equine Neonatal Intensive Care Laboratory:Point-of-Care Testing[J].Clinics in Laboratory Medicine,2011,31(1):125~137.
[11] Andres W M,Scott T P,Nie Z H,et al.Programmable Diagnostic Devices Made from Paper and Tape[J].Lab on a Chip,2010,10(8):2499-2504.
[12] Li X,Tian J F,Nguyen T,et al.Paper-Based Microfluidic Devices by Plasma Treatment[J].Anal.Chem.2008,80(10):9131-9134.
[13] Zhang W H,Lin S C,Wang C M,et al.PMMA/PDMS Valves and Pumps for Disposable Microfluidics[J].Lab Chip,2009,9(21):3088-3094.
[14] Maltezos G,Garcia E,Hanrahan G,et al.Design and Fabrication of Chemically Robust Three-Dimensional Microfluidic Valves[J].Lab Chip,2007,7(9):1209-1211.
[15]章安良,尉一卿,韩庆江,叶丽军,基于声表面波技术实现纸基微流开关研究[J].传感技术学报,2011,24(6):788-792.
[16] Uchida T K,Suzuki T,Shiokawa S.Investigation of Acoustic Streaming Excited by Surface Acoustic Waves[C]//IEEE Ultrasonics Symposium,New York,USA,Nov.7-10,1995.
[17] Shiokawa S,Matsui Y,Ueda T.Liquid Streaming and Droplet Formation Caused by Leaky Rayleigh Wave[C]//IEEE Ultrasonics symposium,New York,USA,Oct.3-6,1989.

