骨髓间充质干细胞功能异常在雌激素所致骨质疏松发病中的作用研究
廖 立,杨小红,金 岩
骨质疏松是最常见的三大老年性疾病之一,严重危害老年人群的身体健康。其发病机制不一,包括遗传性、废用性、代谢异常、退行性、激素水平异常、药物因素等[1],其中,绝经后雌激素缺乏导致的骨质疏松在其中占据了很大一部分,>50岁女性因骨质疏松导致骨折的风险>20%[2]。相关的机制研究过去主要集中于破骨细胞的异常活化上,大量研究表明,雌激素缺乏可以通过核因子活化因子受体及其配体(RANKL/RANK)途径刺激破骨前体细胞向破骨细胞的转化[3-4];还能够直接导致破骨细胞和成骨细胞中凋亡相关因子配体(FasL)表达下降,使破骨细胞凋亡下降,延长存活时间[5]。但是,近年来不少学者提出,骨改建是一个成骨与破骨动态平衡的过程,成骨及破骨的失衡才是骨质疏松发生的根本原因[6]。干细胞作为各种组织细胞的来源,在维持组织的新陈代谢和稳态中发挥了重要作用,越来越多的研究提出,干细胞功能障碍与许多疾病的发生密切相关,特别是衰老等退行性变中作用明显[7]。骨髓间充质干细胞(BMMSC)作为成骨细胞的前体细胞,其在骨骼发育与重建的过程中的作用逐渐受到重视。研究发现[8-9],BMMSC成骨和成脂分化的失调会导致骨质疏松或者骨量过高;二聚糖基因(Biglycan)敲除导致小鼠成骨祖细胞凋亡增加和增殖减弱,导致进行性的骨质疏松[10];细胞凋亡蛋白酶3(caspase3)抑制剂能够通过影响BMMSC的分化而加速骨质疏松的发生过程[11];活化的T细胞可以通过凋亡相关因子及其配体(Fas/FasL)通路导致BMMSC的凋亡而促进骨质疏松[12];老年人群的BMMSC的增殖及分化功能均有减退,与骨质疏松的表现相一致[13]。这些实验证明了BMMSC功能和数量的异常将导致骨骼发育和骨改建的异常。但是对于雌激素缺乏如何导致BMMSC的功能失调仍尚不明确。在本研究中,我们通过建立去势小鼠骨质疏松动物模型,提取BMMSC进行体外培养和功能检测,明确其内源性的增殖及分化功能改变,并采用检测关键基因表达水平和microRNA表达谱分析,从分子水平探索其生物学行为变化的原因。
材料与方法
1 卵巢切除组(OVX)小鼠骨质疏松模型的建立
取8周龄C57小鼠40只,随机分为OVX组和假手术组(Sham)组,每组20只。OVX组以1%戊巴比妥钠麻醉后,从背部开口寻找到双侧卵巢,于子宫颈部结扎后切除卵巢,缝合伤口。Sham组寻找到卵巢后仅切除部分脂肪组织,缝合伤口。置于无特定病原体(SPF)级动物房饲养,自由进食水3个月后取双侧股骨进行组织学检测。
2 组织学检测
取小鼠双侧胫骨及股骨,多聚甲醛固定4h后置于10%乙二胺四乙酸(EDTA)内脱钙10d,隔天换液。流水冲洗过夜后石蜡包埋,常规切片,行苏木精-伊红(HE)染色。光镜下观察并照相。
3 BMMSC体外培养
小鼠BMMSC的体外培养参照以往的方法。小鼠颈椎脱臼后剥取股骨及胫骨,剔除表面肌肉及软组织,以1ml针管冲洗骨髓后接种于含10%胎牛血清(FBS,杭州四季青公司)的α-最小必须培养基(α-MEM)内,37℃、5%CO2培养箱常规培养。每2天半量换液,当密度达到80%后以2×104/cm2的密度传代。
4 生长曲线
采用P3代的小鼠细胞以5×104每孔分别接种于12孔板中,接种后2、4、6、8、10、12、14、16d以胰酶消化后计数。
5 成骨诱导及检测
成骨诱导液配方为α-MEM,加入10% FBS,100nmol/L地塞米松,5mmol/L甘油磷酸钠和50μg/ml左旋维生素C(Sigma公司)。细胞按照2×105/孔接种于6孔板内,待密度达到85%以后加入成骨诱导液诱导21d。以4%甲醛固定后,采用茜素红染色检测成骨分化,并以10%西吡氯铵洗脱后用分光光度计检测570nm光吸收值,行定量分析。
6 成脂诱导及检测
成脂诱导液配方为α-MEM,加入10% FBS,0.5nmol/L异丁基甲基黄嘌呤(IBMX;Sigma),2μmol/L胰岛素(Sigma)和10nmol/L地塞米松(Sigma)。细胞按照2×105/孔接种于6孔板内,待密度达到95%以后加入成脂诱导液诱导14d。以4%甲醛固定后,采用油红染色检测成脂分化,并以异丙醇洗脱后用分光光度计检测520nm光吸收值,行定量分析。
7 microRNA芯片分析
取术后3个月OVX组及sham组小鼠各9只,取股骨及胫骨骨髓常规培养BMMSC,待原代细胞密度达到80%后分别提取RNA,质检合格后以同组每3个RNA样本等量混合,将得到的每组各3个混合RNA混合样本行双色microRNA微阵列芯片检测(LC-μParafloTM微流体芯片,杭州联川生物信息技术有限公司)。3张芯片的信号数据进行归一化处理后,进行统计学分析。
结 果
1 C57小鼠骨质疏松模型的建立及鉴定
C57小鼠行双侧卵巢切除术后3个月,进行体重检测,发现OVX组小鼠体重明显重于Sham组。颈椎脱臼处死后,尸检在OVX组内未发现卵巢,且子宫明显萎缩;而Sham组具有正常的卵巢。取股骨远端进行组织学检测(图1),均显示OVX组股骨远端松质骨吸收明显,骨小梁数量低于Sham组。同时发现干骺端生长板也较正常变薄,可能软骨的形成和再生也受到了雌激素的影响。但是皮质骨厚度和结构没有明显变化,这与以往研究报道相一致,因为皮质骨的改建需要较长的时间。以上结果表明本实验成功建立了OVX小鼠骨质疏松模型。
2 OVX小鼠中BMMSC的增殖能力下降,多向分化能力改变
将OVX组及Sham组小鼠BMMSC进行常规体外培养,取P3代细胞进行细胞增殖和多向分化能力检测。结果 显示,OVX组BMMSC体外扩增能力较Sham组有一定下降(图2)。对BMMSC进行分化能力检测,成骨诱导染色后镜下可以观察到OVX组形成的钙化结节较Sham组少,染色浅(图3、4);但成脂诱导时OVX组有更多的脂滴形成(图5、6);定量检测也证明了这些区别(P<0.05)。证明OVX组BMMSC成骨分化能力要低于Sham组,而成脂分化能力则较强,与观察到的组织学表现相一致。提示BMMSC的功能异常确实在骨质疏松的发病中发生了重要的作用。
3 OVX小鼠BMMSC的功能障碍受到多种方式调控
通过对OVX组和Sham组BMMSC中mRNA表达水平进行RT-PCR检测(图7),发现与干细胞成骨成脂分化相关的关键调控基因如骨钙素(OCN)、脂蛋白酯酶(LPL)和碱性磷酸酶(ALP)的表达发生了明显的改变,其变化趋势与细胞成骨成脂分化功能改变相一致,但Runt蛋白相关转录因子2(RUNX2)和过氧化物酶体增生物激活受体(PPAR-γ)这两个在成骨成脂分化中发挥重要调控作用的关键基因在mRNA水平并没有发生明显改变,提示可能在转录后水平受到了调控。
通过对两组BMMSC细胞RNA样本进行microRNA微阵列芯片检测,发现OVX组BMMSC的microRNA表达谱与Sham组相比发生了较明显的改变。在BMMSC表达的339种已知microRNA中,有71种出现差异性表达,占所有表达microRNA的20.94%。其中,在OVX组中上调的microRNA为29种,而下调的microRNA为42种。倍数差异在4倍以上的microRNA有24种,占总microRNA的7.08%(表1)。以上数据表明,microRNA表达水平在OVX小鼠BMMSC中发生了较明显的变化,可能在骨质疏松BMMSC中功能改变中发挥了重要的调控作用。
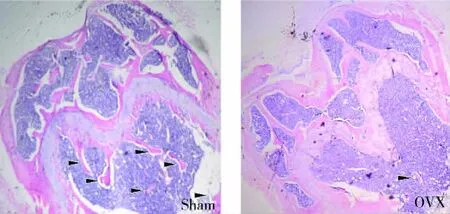
图1 Sham及OVX组股骨远端切片(箭头标示为骨小梁结构)(HE×10倍)
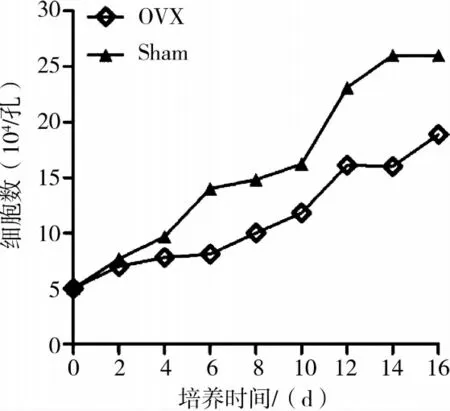
图2 两种BMMSC生长曲线比较

图3 两种BMMSC成骨分化后形成的钙化结节(茜素红×100倍)

图4 两种BMMSC成骨分化定量分析
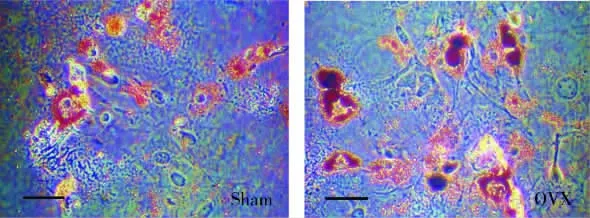
图5 两种BMMSC成脂分化后形成的脂滴(油红 ×200倍)

图6 两种BMMSC成脂分化定量分析
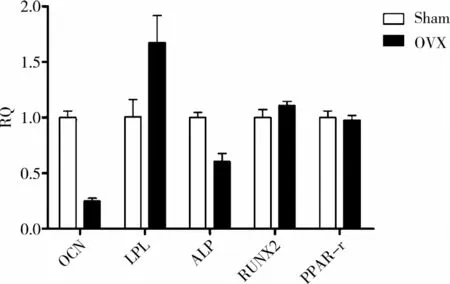
图7 两种BMMSC基因表达RT-PCR结果

表1 芯片中差异性表达microRNA统计
讨 论
实验结果表明,在雌激素缺乏条件下,BMMSC在增殖及分化能力上都出现了一定的异常,并且此异常与骨质疏松中成骨能力下降的表型相一致,从而可能在骨质疏松的发生及发展过程中起到了一定的促进作用。有研究报道[1],在骨质疏松发生早期,破骨细胞的过度活化发挥了主要作用,但随着病情的发展,成骨功能的下降是导致后期骨质疏松加重的主要因素。我们的研究采用的是去势后3个月的小鼠,从骨质吸收情况看,已经到达了中后期,此期BMMSC功能异常所导致的成骨功能缺陷可能发挥了更为重要的作用。在后续实验中可以观察去势小鼠短期和长期BMMSC的生物学行为改变,并与中后期BMMSC相比较,从而观察BMMSC在骨质疏松发病全程中的动态功能改变。
同时,我们观察到,虽然造成去势后骨质疏松的启动因素是由于雌激素水平的下降,但是当OVX组BMMSC进行正常体外培养(含雌激素培养基)时,BMMSC功能缺陷在体外培养期间(30d左右)并没有恢复,其增殖及分化能力中仍存在异常。一方面,因为BMMSC自身表达雌激素受体,受到雌激素的直接调控,可能是因为长期的激素缺乏可能对细胞造成一种“记忆效应”[14],造成细胞难以短期逆转的生物学行为改变,但是当雌激素水平恢复后能否完全逆转或者多长时间能够逆转其功能改变将是一个有意义的课题,将为以后临床作用于BMMSC治疗的疗效提供参考依据。另一方面,因为雌激素的靶点广泛分布于全身各种组织和细胞中,雌激素水平的下降将引发全身一系列的改变,所以BMMSC也可能受到活化辅助性T细胞(Th)、继发性激素改变、代谢改变等多种因素的共同作用,最终导致功能异常,所以单纯体外恢复雌激素水平不能完全恢复其功能改变[15]。
因为干细胞的功能很大程度上由重要功能基因的转录来决定,所以我们对成骨分化相关的ALP、OCN、RUNX2以及成脂分化相关的LPL、PPAR-r等重要基因进行了RT-PCR检测,发现ALP、OCN、LPL的表达改变与BMMSC的功能改变相一致,但是RUNX2以及PPAR-r的变化不明显。由于近年来越来越多的研究发现了microRNA在基因的转录后调控中发挥了很重要的作用,所以骨质疏松状态下的BMMSC功能缺陷不仅由基因转录失调所引起,也可能由microRNA表达谱及表达水平的改变所决定。microRNA微阵列芯片的结果也支持我们的推断,约1/5的microRNA表达发生了改变。但是,因为microRNA具有1个microRNA调控多个靶基因或者1个靶基因受多个microRNA调控的特点,所以具体是哪些microRNA参与了重要分化相关基因的转录后调控,以及具体如何调控,还需要进一步的实验验证。
结论:本实验证明了在雌激素缺乏所致骨质疏松中,BMMSC的增殖能力减弱,成骨能力减弱,而成脂能力增强,这些功能障碍可能在骨质疏松的发病中发挥了重要的作用。而BMMSC的功能障碍可能是由基因转录水平和转录后水平的调控异常所共同引起。
[1]Raisz LG.Pathogenesis of osteoporosis:concepts,conflicts,and prospects[J].J Clin Invest,2005,115(12):3318-3325.
[2]Sambrook P,Cooper C.Osteoporosis[J].Lancet,2006,367(9527):2010-2018.
[3]Hsu H,Lacey DL,Dunstan CR,et al.Tumor necrosis factor receptor family member RANK mediates osteoclast differentiation and activation induced by osteoprotegerin ligand[J].Proc Natl Acad Sci USA,1999,96(7):3540-3545.
[4]Suda T,Takahashi N,Udagawa N,et al.Modulation of osteoclast differentiation and function by the new members of the tumor necrosis factor receptor and ligand families[J].Endocr Rev,1999,20(3):345-357.
[5]Nakamura T,Imai Y,Matsumoto T,et al.Estrogen prevents bone loss via estrogen receptor alpha and induction of Fas ligand in osteoclasts[J].Cell,2007,130(5):811-823.
[6]Rodan GA,Martin TJ.Therapeutic approaches to bone diseases[J].Science,2000,289(5484):1508-1514.
[7]Rossi DJ,Jamieson CH,Weissman IL.Stems cells and the pathways to aging and cancer[J].Cell,2008,132(4):681-696.
[8]Verma S,Rajaratnam JH,Denton J,et al.Adipocytic proportion of bone marrow is inversely related to bone formation in osteoporosis[J].J Clin Pathol,2002,55(9):693-698.
[9]Qiu W,Andersen TE,Bollerslev J,et al.Patients with high bone mass phenotype exhibit enhanced osteoblast differentiation and inhibition of adipogenesis of human mesenchymal stem cells[J].J Bone Miner Res,2007,22(11):1720-1731.
[10]Chen XD,Shi S,Xu T,et al.Age-related osteoporosis in biglycan-deficient mice is related to defects in bone marrow stromal cells[J].J Bone Miner Res,2002,17(2):331-340.
[11]Miura M,Chen XD,Allen MR,et al.A crucial role of caspase-3 in osteogenic differentiation of bone marrow stromal stem cells[J].J Clin Invest,2004,114(12):1704-1713.
[12]Yamaza T,Miura Y,Bi Y,et al.Pharmacologic stem cell based intervention as a new approach to osteoporosis treatment in rodents[J].PLoS One,2008,3(7):2615.
[13]Moerman EJ,Teng K,Lipschitz DA,et al.Aging activates adipogenic and suppresses osteogenic programs in mesenchymal marrow stroma/stem cells:the role of PPARgamma2 transcription factor and TGF-beta/BMP signaling pathways[J].Aging Cell,2004,3(6):379-389.
[14]Asselin-Labat ML,Vaillant F,Sheridan JM,et al.Control of mammary stem cell function by steroid hormone signalling[J].Nature,465(7299):798-802.
[15]Matsuo K,Irie N.Osteoclast-osteoblast communication[J].Arch Biochem Biophys,2008,473(2):201-209.

